Урок химии по теме «Гидролиз солей». 11-й класс
Разделы: Химия
Класс: 11
Тип урока: урок усвоения новых знаний и закрепления изучаемого материала. Обучение применению изученного материала в упражнениях формата ЕГЭ.
- Образовательные: сформировать понятие о гидролизе солей, научить составлять уравнения реакций гидролиза различных солей. Углубить знания учащихся об обратимых химических реакциях. Закрепить практические навыки определения среды раствора. Совершенствовать умения в работе с тестовыми заданиями разных типов.
- Развивающие: развивать у учащихся умения сравнивать и анализировать теоретические сведения, применять их на практике, делать выводы; выделять главное в процессе демонстрации опыта, развивать логическое мышление.
- Воспитательные: формировать естественно-научное мировоззрение; информационную культуру.
Методы, используемые на уроке: частично-поисковые.
Оборудование: периодическая таблица химических элементов Д.И.Менделеева; таблица “Кислотность среды”; схема – таблица “Гидролиз солей”; тестовые задания с выбором одного правильного ответа (задания части А ЕГЭ); тестовые задания на соответствие (задания части В ЕГЭ). Растворы солей : хлорида калия, хлорида цинка, карбоната калия.
| Ход урока | Методы |
| I. Организация начала урока. | |
| II. Вводная часть. Сообщение темы, целей и задач урока. | |
| III. Повторение основных важнейших опорных знаний. | Фронтальный опрос; работа у доски и в тетрадях. |
| IV. Актуализация знаний. Постановка проблемной задачи. | Беседа; Демонстрационный опыт; лабораторный опыт; работа с микролабораториями. |
| V. Объяснение нового материала. | Рассказ учителя; работа с таблицами; беседа. |
| VI. Обучение употреблению изученного материала в упражнениях формата ЕГЭ. | Совместная работа с тестами. Самостоятельная работа учащихся с тестовыми заданиями. |
| VII. Обобщение и закрепление темы. | Индивидуальные карточки задания. |
| VIII. Домашнее задание. | |
| IX. Организационное окончание урока. |
План – конспект урока.
После приветствия учитель называет тему урока и сообщает его цели и задачи.
Учитель: Тема сегодняшнего урока логически продолжает изучение закономерностей протекания химических реакций, смещения равновесия обратимых процессов и является одним из существенных вопросов теории растворов. Понимание процессов, происходящих при гидролизе солей, необходимо для объяснения явлений, происходящих в живых организмах, природных комплексах и системах. Многие вопросы биологии, медицины, гидрологии связаны с явлением гидролиза солей, поскольку он является основой их устойчивости и равновесия.
Повторение основных важнейших опорных знаний.
- Электролиты; Сильные и слабые электролиты (определение, представители классов неорганических соединений).
- Определение солей в свете теории электролитической диссоциации.
- Классификация солей.
- Составление уравнений диссоциации солей (хлорида натрия, гидроксохлорида кальция, гидросульфата натрия).
- Реакции ионного обмена, условия их протекания.
- Водородный показатель (р Н).
Актуализация знаний. Постановка проблемной задачи.
Вопрос: Какая среда в водных растворах кислот?
Ответ: кислотная, так как присутствуют ионы Н + .
Вопрос: Какая среда в водных растворах щелочей?
Ответ: щелочная, так как присутствуют гидроксид – ионы ОН — .
Вопрос: Какая среда в воде?
Ответ: нейтральная, так как вода незначительно, но диссоциирует на ионы Н + и ОН — . Концентрация этих ионов в воде одинакова.
Вопрос: Как экспериментально определить характер среды?
- К раствору кислоты добавляем несколько капель индикатора лакмуса. Наблюдаем изменение окраски индикатора.
- К растворам щелочи добавляем несколько капель фенолфталеина, лакмуса. Наблюдаем изменение окраски индикатора.
Вопрос: Какая среда в водных растворах солей? Давайте экспериментально проверим характер среды в растворах выданных вам солей. Результаты опытов запишем в таблицу. Выполнение лабораторного опыта.
| Формула и название исследуемой соли | Изменение цвета индикатора | Среда раствора соли | |
| лакмуса | фенолфталеина | ||
| KCl Хлорид калия | Не изменяется | Не изменяется | Нейтральная |
| ZnCl2 Хлорид цинка | розовый | Не изменяется | кислотная |
| K2CO3 Карбонат калия | синий | малиновый | щелочная |
Делаем вывод: в растворах солей нет общих для всех солей ионов (по сравнению с растворами кислот и растворами щелочей). Химические свойства соли определяются свойствами ее катиона и аниона, которые имеются в ее водном растворе.
Объяснение нового материала.
Катионы металлов и анионы кислотных остатков, входящие в состав солей, называют компонентами соли. Катионы – остатки щелочей – и анионы сильных кислот электролитов называют сильными компонентами соли. Соответственно катионы и анионы нерастворимых в воде оснований и кислот, а также растворимых, но слабодиссоциирующих электролитов называют слабыми компонентами соли. (Работа с таблицей – схемой, раздаточный материал, Приложение 1).
В обменный процесс с водой вступают только те соли, в составе которых есть слабый компонент или оба компонента слабы.
Гидролиз (от греч. hỳdör – вода и lỳsis – разложение) – это разложение водой. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Давая такое определение реакции гидролиза, мы подчеркиваем, что соли в растворе находятся в виде ионов и движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможны три типа гидролиза:
- гидролиз по катиону (в реакцию с водой вступает только катион);
- гидролиз по аниону (в реакцию с водой вступает только анион);
- совместный гидролиз (в реакцию с водой вступает и катион, и анион).
Гидролиз по катиону. Как катион может взаимодействовать с водой? Отмечаем, что катион – это положительно заряженная частица, а молекула воды полярна, условно можно представить ее состоящей из положительно заряженного атома водорода и отрицательно заряженной гидроксильной группы. Какую же часть молекулы воды оторвет и присоединит к себе катион? Ученики с удовольствием отвечают: “Гидроксильную группу!” Ответ подтверждаем записью уравнения, отмечая обратимость реакции:
M n+ + H–OH 
Написав формулу образовавшейся частицы, тут же обсуждаем, что это за частица, будет ли она иметь заряд и какой, приходим к выводу, что, как правило, это гидроксокатион. А что останется от молекулы воды? Какую реакцию водного раствора обусловливает избыток этих частиц? Какова будет реакция индикатора? А теперь проверим нашу гипотезу (обращаемся к таблице результатов опыта).
После этого школьники самостоятельно делают вывод: гидролиз по катиону приводит к образованию гидроксокатионов и кислой среды раствора.
Отмечаем, что иногда (при n = 1) вместо гидроксокатионов получаем молекулы слабого основания. А может ли гидроксокатион вступить в реакцию со следующей молекулой воды? Сообщаем, что это будет вторая ступень гидролиза, что каждая следующая ступень протекает в тысячи раз слабее, чем предыдущая, что даже первая ступень протекает обычно на доли процента. Поэтому, как правило, рассматривается только первая ступень гидролиза.
Гидролиз по аниону разбираем аналогично, записывая уравнение:
An n– + H–OH 
Подводим учеников к выводу: гидролиз по аниону приводит к образованию гидроанионов и щелочной среды раствора.
Совместный гидролиз. Из самого названия следует, что в этом случае в растворе протекают две выше рассмотренные реакции. Предлагаем школьникам проанализировать их и сделать вывод о реакции среды. Опровергаем представление о том, что среда будет нейтральной. Одинаковое число ионов водорода и гидроксид-ионов существует только на бумаге. На самом деле здесь протекают две независимые обратимые реакции, и каких ионов в растворе окажется больше – зависит от степени протекания каждой реакции. А это, в свою очередь, зависит от того, что слабее – кислота или основание. Если слабее основание, то в большей степени будет протекать гидролиз по катиону и среда раствора будет кислой. Если слабее кислота – наоборот. Как исключение возможен случай, когда среда будет почти нейтральной, но это только исключение. Одновременно обращаем внимание учащихся на то, что связывание гидроксид-ионов и ионов водорода в воду приводит к уменьшению их концентрации в растворе. Предлагаем вспомнить принцип Ле Шателье и подумать, как это повлияет на равновесие. Подводим их к выводу, что при совместном гидролизе степень его протекания будет значительно выше и в отдельных случаях это может привести к полному гидролизу.
Полный гидролиз. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно в какой-то степени растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты. Если вернуться к обычным солям, то полностью гидролизующиеся соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)) нельзя получить реакциями обмена в водных растворах. Вместо ожидаемых продуктов в результате реакции мы получим продукты гидролиза. Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основный карбонат меди (CuOH)2CO3.
В таблице растворимости для полностью гидролизующихся солей стоит прочерк. Однако прочерк может стоять по другим причинам: вещество не изучено, разлагается в ходе окислительно-восстановительной реакции и т.п.
Алгоритм написания уравнений гидролиза: Составляем вместе с ними алгоритм написания уравнений гидролиза. Рассмотрим его на конкретных примерах.
Пример 1. Гидролиз хлорида цинка.
1. Определяем тип гидролиза. На этом этапе школьники могут написать уравнение диссоциации соли: ZnCl2 
Можно дать им “правило цепочки”: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита. Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду: Zn 2+ + H–OH 
Образуется катион гидроксоцинка и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. Получаем: ZnCl2 + H2O 
Обращаем внимание, что продукт реакции относится к группе основных солей.
Пример 2. Гидролиз карбоната калия.
1. Определяем тип гидролиза: K2CO3 
Калий – щелочной металл, его гидроксид – сильное основание, угольная кислота, слабая кислота. Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду: CO3 2– + H–OH 
Продукты – гидрокарбонат– и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение: K2CO3 + H2O 
Получили кислую соль – гидрокарбонат калия.
Пример 3. Гидролиз ацетата алюминия.
Соль образована катионом слабого основания и анионами слабой кислоты. Идет совместный гидролиз.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al 3+ + H–OH 
CH3COO – + H–OH 
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая. Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
4. Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O 
Обучение применения изученного материала в упражнениях формата ЕГЭ.
Гидролиз в заданиях ЕГЭ по химии.
Задания части А.
1. Фенолфталеин можно использовать для обнаружения в водном растворе соли:
1) ацетата алюминия; 2) нитрата калия; 3) сульфата алюминия; 4) силиката натрия.
Фенолфталеин – индикатор на щелочную среду, в которой он принимает малиновую окраску. В растворе соли щелочная среда может возникнуть при гидролизе по аниону.
1) ацетат алюминия рассмотрен выше, идет совместный гидролиз, среда получается слабокислая;
2) нитрат калия образован сильными кислотой и основанием, гидролиз не идет, среда нейтральная;
3) сульфат алюминия образован сильной кислотой и слабым основанием, гидролиз идет по катиону, среда получается кислая;
4) силикат натрия образован слабой кислотой и сильным основанием, гидролиз идет по аниону, среда получается щелочная: Ответ. 4.
Выполняем задания Части А № 1–5 (Приложение 2).
Задания части В. 1. Установите соответствие между названием соли и отношением ее к гидролизу.
| ФОРМУЛА СОЛИ А) (NH4)2CO3 Б) NH4Cl В) Na2CO3 Г) NaNO2 | ТИП ГИДРОЛИЗА 1)по катиону 2) по аниону 3)по катиону и аниону |
Используя полученные знания о гидролизе солей, приходим к выводу: А – 3; Б – 1;В – 2; Г – 2
3. Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе:
| ФОРМУЛА СОЛИ А) K2S Б) A12(SO4)3 В) С6Н5ОК Г) Na3PO4 | ОКРАСКА ИНДИКАТОРОВ 1) лакмус красный, фенолфталеин малиновый 2) лакмус красный, фенолфталеин бесцветный 3) лакмус синий, фенолфталеин малиновый 4) лакмус синий, фенолфталеин бесцветный 5) лакмус фиолетовый, фенолфталеин малиновый 6) лакмус фиолетовый, фенолфталеин бесцветный |
Определяем по какому типу гидролизуется соль, среду раствора и окраску в ней индикаторов. Получаем: А (гидролиз по аниону, среда раствора щелочная, лакмус – синий, фенолфталеин – малиновый) – 3; аналогично Б – 2; В – 3; Г – 3.
Выполняем задания Части В № 2,3,6, 20 (Приложение 3).
Обобщение и закрепление темы. Заполняем карточку схему по образцу:
| Образец: K2CO3 | H2CO3 –сл. | Гидролиз по аниону. СО3 2- +НОН | Среда щелочная | Лакмус – синий Фенолфталеин – малиновый |
| Сульфат натрия | Лакмус – Метилоранж – Фенолфталеин – | |||
| Нитрат цинка | Лакмус – Метилоранж – Фенолфталеин – | |||
| Хлорид аммония | Лакмус – Метилоранж – Фенолфталеин – |
| Образец: Карбонат калия K2CO3 | KOH – сил. H2CO3 –сл. | Гидролиз по аниону. СО3 2- +НОН | Среда щелочная | Лакмус– синий Метилоранж –желтый Фенолфталеин – малиновый |
| Нитрат аммония | Лакмус – Метилоранж – Фенолфталеин – | |||
| Фосфат калия | Лакмус – Метилоранж – Фенолфталеин – | |||
| Хлорид натрия | Лакмус – Метилоранж – Фенолфталеин – |
Работа с тестами (приложение №2, 3) ; для сильных учеников (приложение № 4)
- Учебник “Химия 11 класс. Базовый уровень”, О.С. Габриелян, Москва 2007, Дрофа.
- “Настольная книга учителя. Химия 11 класс” Часть 1, О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская, М.: 2003, Дрофа.
- “Готовимся к единому государственному экзамену. Химия” , О.С. Габриелян, П.В. Решетников, И.Г. Остроумова, А.М. Никитюк, М.: 2004, Дрофа.
- Учебник “Химия 11 класс”, О.С. Габриелян,Г.Г. Лысова М.: 2002, Дрофа.
- “Учебно-методическое пособие по химии для профильного обучения в медико-биологических классах” , Краснодар 2008 год, составитель профессор Т.Н. Литвинова, зав. Кафедрой общей химии КГМУ.
- “Самое полное издание типовых вариантов реальных заданий ЕГЭ 2010. Химия” Федеральный институт педагогических измерений, М.: 2010, Астрель.
Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
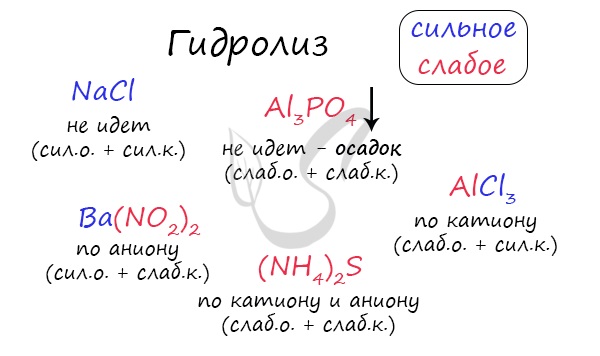
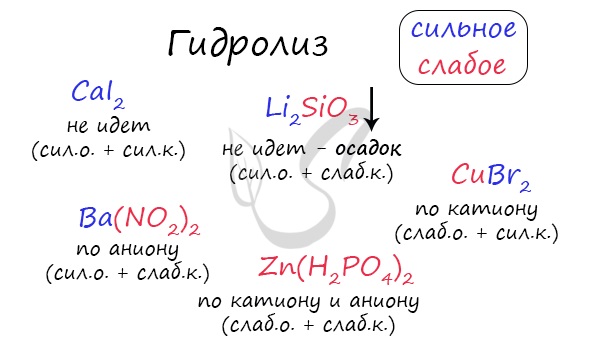
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
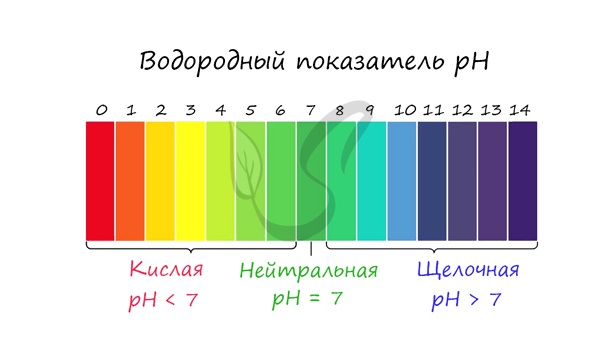
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
http://studarium.ru/article/158
http://chemege.ru/gidroliz/