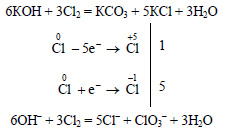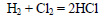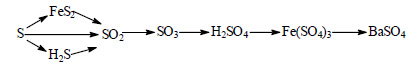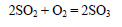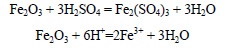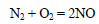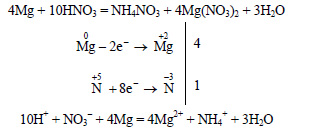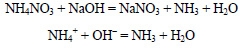Гипохлорит кальция
Гипохлорит кальция, кальций гипохлорит — неорганическое соединение состава Ca (ClO) 2. Вещество является белыми кристаллами, легко поглощает из воздуха влагу и углекислый газ. Проявляет сильные окислительные свойства.
Применяется для отбеливания тканей, бумаги, для обеззараживания воды (дезинфекции), а также для синтеза других гипохлоритов.
Физические свойства
Гипохлорит кальция является белым кристаллами. Соединение поглощает влагу из воздуха, образуя гидраты с двумя-четырьмя молекулами H 2 O.
Взрывоопасный в присутствии органических соединений.
Получение
Гипохлорит кальция получают путем хлорирования гидроксида кальция (гашеной извести) с последующим разделением смеси путем выпаривания при низком давлении:
Применяется метод обработки реакционной смеси гидроксидом натрия (каустической содой) для предотвращения образования лишних солей кальция:
Используется также обменная реакция — взаимодействие холодного гипохлорита натрия и солей кальция (или гидроксида):
Химические свойства
Гипохлорит кальция, как и гипохлориты, является малоустойчивой. При нагревании свыше 175 ° C он разлагается с выделением кислорода:
В горячих растворах гипохлорита может происходить реакция диспропорционирования:
Образующиеся гипохлоритом кристаллогидраты дегидратируются при низких температурах:
Если вещество сохраняется в негерметичных контейнерах, она поглощает из воздуха углекислый газ:
При взаимодействии с соляной кислотой выделяется газообразные хлор:
Гипохлорит кальция является сильным окислителем. Он активно взаимодействует с серной кислотой, выделяя кислород:
Применение
Основным применением гипохлорита кальция отбеливание тканей, бумаги и дезинфекция воды. Однако, его использование ограничено из-за склонности к взаимодействию с углекислым газом в воздухе и, как следствие, потере окислительных свойств. Поэтому его используют для синтеза более устойчивого и более дорогого гипохлорита натрия.
Галогены: решение задач методом полуреакций
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом полуреакций разобраны на странице «Метод полуреакций».
Ниже приведены примеры решения задач ОВР галогенов и их соединений в кислотной среде.
Уравнения ОВР соединений хлора
Соляная кислота
1. Уравнение реакции меди с кислородом в кислотной среде:
2. Уравнение реакции соляной и селеновой кислот (HCl+H2SeO4):
3. Уравнение реакции соляной кислоты с оксидом свинца (HCl+PbO2):
4. Уравнение реакции соляной кислоты с оксидом марганца (HCl+MnO2):
5. Уравнение реакции соляной кислоты с перманганатом калия (HCl+2KMnO4):
6. Уравнение реакции соляной и ортосурьмяной кислот (HCl+H3SbO3):
7. Уравнение реакции соляной кислоты и гипохлорита кальция (HCl+Ca(ClO)2):
8. Уравнение реакции соляной и хлористой кислот (HCl+HClO2):
9. Уравнение реакции соляной кислоты с гипохлоритом калия (HCl+KClO):
10. Уравнение реакции соляной кислоты с хлоратом калия (бертолетовой солью) (HCl+KClO3):
11. Уравнение реакции соляной и хлорноватой кислот (HCl+HClO3):
12. Уравнение реакции соляной кислоты и оксида хрома (HCl+CrO3):
13. Уравнение реакции соляной кислоты с хроматом калия (HCl+K2CrO4):
14. Уравнение реакции соляной кислоты с дихроматом калия (HCl+K2Cr2O7):
Хлорные кислоты вида HClOn
14. Уравнение реакции хлорноватистой кислоты с пероксидом водорода (HClO+H2O2):
15. Уравнение реакции хлорноватистой кислоты с оксидом азота (HClO+NO):
16. Уравнение реакции разложения хлористой кислоты:
Возможен и такой вариант:
17. Уравнение реакции хлорноватой кислоты с фосфором (HClO3+P):
18. Уравнение реакции хлорноватой кислоты с серебром (HClO3+Ag):
19. Уравнение реакции хлорноватой кислоты с серой (HClO3+S):
20. Уравнение реакции хлорной кислоты с йодом (HClO4+I2):
Хлориды
21. Уравнение реакции хлорида натрия с перманганатом калия (NaCl+KMnO4):
22. Уравнение реакции хлорида натрия с оксидом марганца (NaCl+MnO2):
23. Уравнение реакции хлорида натрия с оксидом свинца (NaCl+PbO2):
24. Уравнение реакции хлорида натрия с хлоратом калия (NaCl+KClO3):
25. Уравнение реакции хлорида калия с оксидом свинца (KCl+PbO2):
26. Уравнение реакции хлорида калия с тетраоксидом трисвинца (KCl+(Pb2Pb)O4):
27. Уравнение реакции хлорида железа с хлоратом калия (FeCl2+KClO3):
28. Уравнение реакции хлорида железа с перманганатом калия (FeCl2+KMnO4):
29. Уравнение реакции хлорида железа с тетраоксидом трисвинца (FeCl2+(Pb2Pb)O4):
30. Уравнение реакции хлорида железа с азотной кислотой (FeCl2+HNO3):
31. Уравнение реакции хлорида стронция с дихроматом калия (SnCl2+K2Cr2O7):
Другие соединения хлора
32. Уравнение реакции гипохлорита кальция с медью (Ca(ClO)2+Cu):
33. Уравнение реакции хлората калия с серной кислотой (KClO3+H2SO4):
34. Уравнение реакции хлората натрия с оксидом серы (NaClO3+SO2):
35. Уравнение реакции перхлората калия с алюминием (KClO4+Al):
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Составьте уравнения реакций, при помощи которых молено осуществить следующие превращения:
Уравнения реакций, если это возможно, составьте в полном и сокращенном ионном виде
Ответ:
а) При реакции хлора с гидроксидом кальция образуется смесь хлорида кальция и гипохлорита кальция:
При реакции хлора с горячим раствором гидроксида калия образуется хлорат калия:
Хлорат калия является сильным окислителем, при его реакции с соляной кислотой выделяется хлор:
Хлор реагирует с водородом с образованием хлороводорода:
При реакции хлороводорода с гидроксидом кальция образуется хлорид кальция:
При реакции раствора хлорида кальция с раствором нитрата серебра в осадок выпадает хлорид серебра:
При реакции хлора с железом при нагревании образуется хлорид железа (III):
При реакции раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (желтая кровяная соль) образуется осадок гексацианоферрата (II) железа (III), так называемая берлинская лазурь:
При реакции серы с железом при нагревании можно получить дисульфид железа FeS2:
Сера реагирует при нагревании с водородом с образованием сероводорода:
При окислении дисульфида железа образуется оксид серы (IV):
Оксид серы (IV) образуется также при сжигании серы или сероводорода:
При окислении оксида серы (IV) кислородом в присутствии катализатора и при повышенной температуре образуется оксид серы (VI) (триоксид серы, серный ангидрид):
Триоксид серы бурно реагирует с водой с образованием серной кислоты:
При реакции серной кислоты с оксидом железа (111) образуется сульфат железа (III):
При реакции сульфата железа (III) с хлоридом бария выпадает осадок сульфата бария:
Азот реагирует с кислородом в условиях электрического разряда с образованием оксида азота (II):
В присутствии катализатора азот реагирует с водородом с образованием аммиака:
При окислении аммиака кислородом в присутствии катализатора образуется оксид азота (II):
Оксид азота (II) окисляется кислородом в оксид азота (IV):
Оксид азота (IV) реагирует в присутствии кислорода с водой с образованием азотной кислоты:
При реакции 30%-ной азотной кислоты с медью выделяется оксид азота (II):
При реакции разбавленной (15%-ной) азотной кислоты с цинком выделяется оксид азота (I):
При реакции сильно разбавленной (5%-ной) азотной кислоты с магнием образуется нитрат аммония:
При действии щелочи на нитрат аммония выделяется аммиак:

задача №11
к главе «Глава VI. Неметаллы».
http://prosto-o-slognom.ru/chimia_ovr/zadachi_01_galogeny_mp.html
http://5terka.com/node/161