ru.aclevante.com

Содержание:
Хлор — это раствор гипохлорита натрия и воды. Газообразный хлор возникает, когда серная кислота смешивается с хлорным отбеливателем. Эта реакция является функцией изменения рН раствора щелочной кислоты в сочетании с сильными окислительными свойствами хлорноватистой кислоты.
Кислоты и основания
Кислота — это химическое соединение, которое отдает ион водорода (Н +) другому соединению. Соединение, которое получает ион водорода, называется основанием. Нормальное измерение рН в чистой воде составляет 7,0. Когда кислое соединение растворяется в воде, полученный раствор имеет рН ниже 7,0. Когда основание или щелочное соединение растворяются в воде, pH раствора превышает 7,0.
Окисляющие агенты
Окислитель — это химическое соединение с сильным сродством к электронам. В восстановительной реакции окисления (или окислительно-восстановительной химической реакции) окислитель получает электроны, в то время как восстановитель теряет электроны.
Хлорный отбеливатель
Гипохлорит натрия (NaClO) является стабилизированной формой хлора. Хлорный отбеливатель, используемый дома, обычно представляет собой смесь от 3% до 6% гипохлорита натрия с водой. Добавление гипохлорита натрия к воде приводит к образованию хлорноватистой кислоты (HOCl) и гидроксида натрия (NaOH). Формула для этой реакции может быть выражена следующим образом: NaOCl + H 2 O? HOCl + NaOH. Гидроксид натрия является основой, делающей щелочной бытовой отбеливатель, имеющий рН около 12,5.
Серная кислота
Серная кислота (H2SO4) представляет собой бесцветную жидкость без запаха и вязкости. Это очень едкий окислитель. При разбавлении в растворе воды он диссоциирует на серную кислоту в виде водорода (H +) катионов и сульфатного (SO4-2) аниона. Серная кислота в воде создает сильно кислый раствор с pH, который изменяется в зависимости от соотношения серной кислоты и воды.
Отбеливатель и серная кислота
Когда кислоту смешивают с гипохлоритом натрия, кислота будет отдавать молекулу водорода в соединении, заменяя молекулу натрия (Na) с образованием хлорноватистой кислоты (HClO). Смесь серной кислоты с раствором гипохлорита натрия приведет к получению раствора сульфата натрия (Na2SO4) и хлорноватистой кислоты. Используя индекс (aq) для представления соединений в растворе, формулу можно выразить следующим образом: 2NaOCl (aq) + H2SO4 (ac) => Na2SO4 (aq) + 2HClO (aq)
Отбеливатель и газообразный хлор
Реакция серной кислоты и гипохлорита натрия не прекращается с образованием сульфата натрия и хлорноватистой кислоты. В водных растворах гипохлорит (HClO) и хлор (Cl 2) достигают равновесия в зависимости от pH раствора. В кислотном растворе равновесие благоприятствует хлору следующим образом: хлорноватистая кислота частично разлагается на анион гипохлорита (OCl) и катион водорода (H +). Хлорноватистая кислота является сильным окислителем, поэтому хлорноватистая кислота, остающаяся в растворе, окисляет анион гипохлорита, образуя раздражающий и токсичный газообразный хлор (Cl2).
Чистая вода — дело техники!
БИБЛИОТЕКА ЗНАНИЙ МВТ
БИБЛИОТЕКА ЗНАНИЙ МВТ
ГИПОХЛОРИТ НАТРИЯ. СВОЙСТВА, ТЕОРИЯ И ПРАКТИКА ПРИМЕНЕНИЯ.
(автор: Ген.директор компании «МИРОВЫЕ ВОДНЫЕ ТЕХНОЛОГИИ» — С.В.Черкасов)
1. ОБЩИЕ СВЕДЕНИЯ
Гипохлорит натрия — NaClO, получают хлорированием водного раствора едкого натра (NaOH) молекулярным хлором (Cl2) или же электролизом раствора поваренной соли (NaCl). Подробно о методах получения гипохлорита натрия (ГПХН) можно прочитать в статье, размещенной на нашем сайте: «Гипохлорит натрия. Процесс получения.».
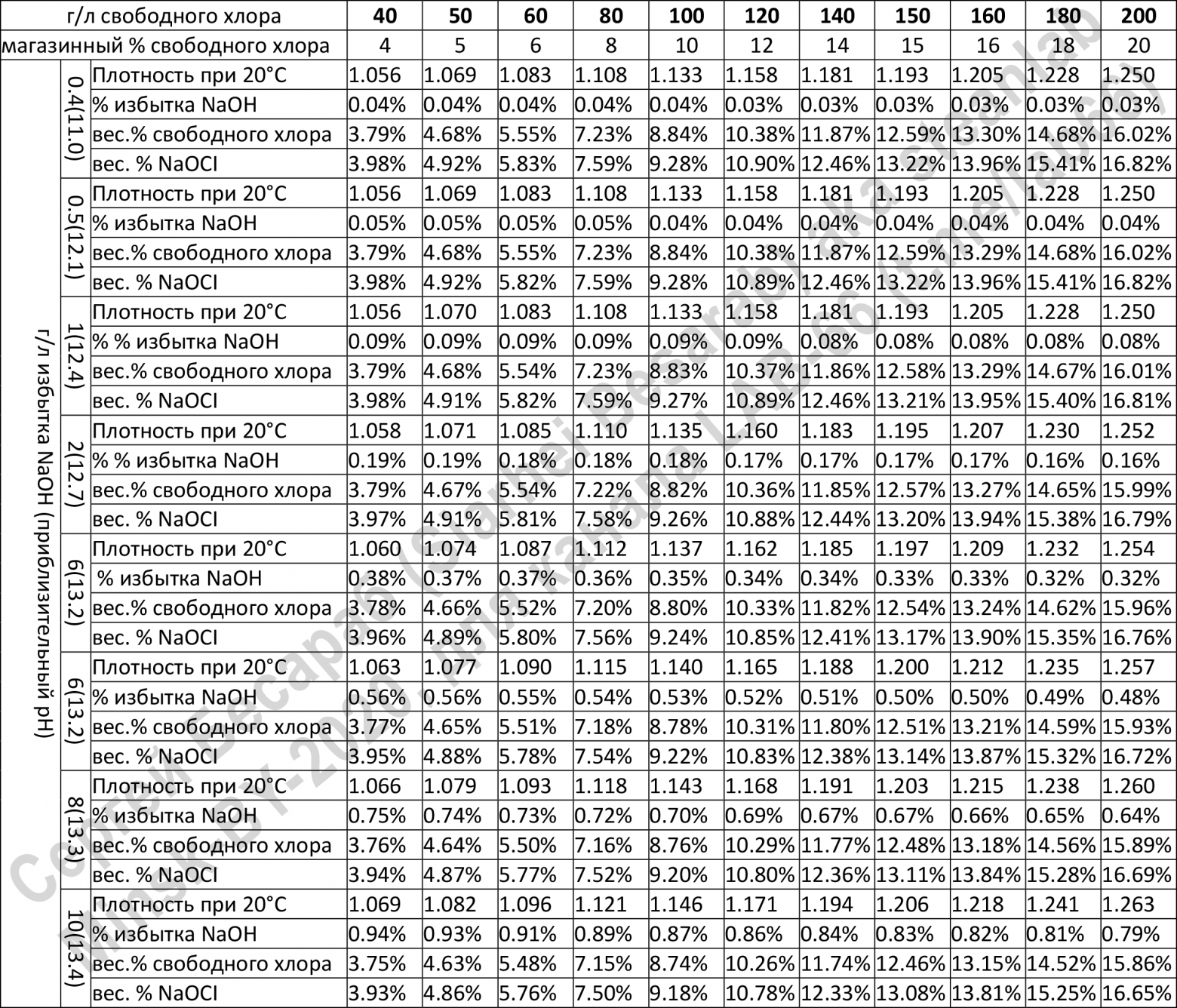
В РФ состав и свойства ГПХН, выпускаемого промышленностью, или получаемого непосредственно у потребителя в электрохимических установках, должен соответствовать требованиям, предъявляемым в ГОСТе или ТУ. Основные характеристики растворов ГПХН, регламентируемые этими документами, приведены в Таблице 1.
2. ОПИСАНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
Безводный гипохлорит натрия (ГПХН) представляет собой неустойчивое бесцветное кристаллическое вещество.
Элементный состав: Na (натрий) (30,9 %), Cl (хлор) (47,6 %), O (кислород) (21,5 %).
Молекулярная масса NaClO (по международным атомным массам 1971 г.) -74,44.
Хорошо растворим в воде: 53,4 г гипохлорита натрия растворяется в 100 граммах воды при 20°C (или 130 г в 100 г воды при 50°C). Растворимость NaClO представлена в таблице 2.1.
| Температура, °С | — 10 | 0 | 10 | 25 | 30 |
| Растворимость, % | 20,6 | 22,8 | 27,5 | 45,0 | 50,0 |
Плотность водных растворов гипохлорита натрия
| Концентрация, % | 1 | 2 | 4 | 6 | 8 | 10 | 14 |
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| Концентрация, % | 18 | 22 | 26 | 30 | 34 | 38 | 40 |
| Плотность, г/л | 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия
| Концентрация | 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
| Температура замерзания, °C | − 1,0 | − 2,2 | − 4,4 | − 7,5 | − 10,0 | − 13,9 | − 19,4 | − 29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔH o 298: − 350,4 кДж/моль;
- стандартная энергия Гиббса, ΔG o 298: − 298,7 кДж/моль.
Водные растворы ГПХН весьма неустойчивы и со временем разлагаются даже при обычной температуре (со скоростью 0,08 до 0,1 % в сутки). На скорость распада ГПХН влияет воздействие солнечного излучения, наличие катионов тяжелых металлов и хлоридов щелочных металлов. При этом наличие в водном растворе сульфата магния или кальция, борной кислоты, силикатов и пр. замедляют процесс разложения ГПХН. Следует заметить, что наиболее устойчивы растворы с сильнощелочной средой (значение pH > 10).
У гипохлорита натрия известно три кристаллогидрата:
- моногидрат NaOCl·H2O – крайне неустойчив, разлагается выше 60°C, при более высоких температурах со взрывом.
- кристаллогидрат NaOCl·2,5 H2O – более устойчив, чем моногидрат, плавится при 57,5°C.
- пентагидрат NaOCl·5 H2O – наиболее устойчивая форма, представляет собой белые или бледно-зелёные ромбические кристаллы. Негигроскопичен, хорошо растворим в воде. В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления:18 – 24,4°C. При нагревании до температуры 30 – 50 °C разлагается.
2.1 Химические свойства ГПХН
Диссоциация, гидролиз и разложение ГПХН в водных растворах
Гипохлорит натрия (ГПХН) – неустойчивое соединение, легко разлагающееся с выделением кислорода. Самопроизвольное разложение медленно происходит даже при комнатной температуре: например, за 40 суток наиболее устойчивая форма – пентагидрат ГПХН (NaOCl·5H2O) теряет около 30 % активного хлора:
2 NaOCl → 2 NaCl + O2
При нагревании ГПХН параллельно с его разложением происходит реакция диспропорционирования:
3 NaOCl → NaClО3 + 2NaCl
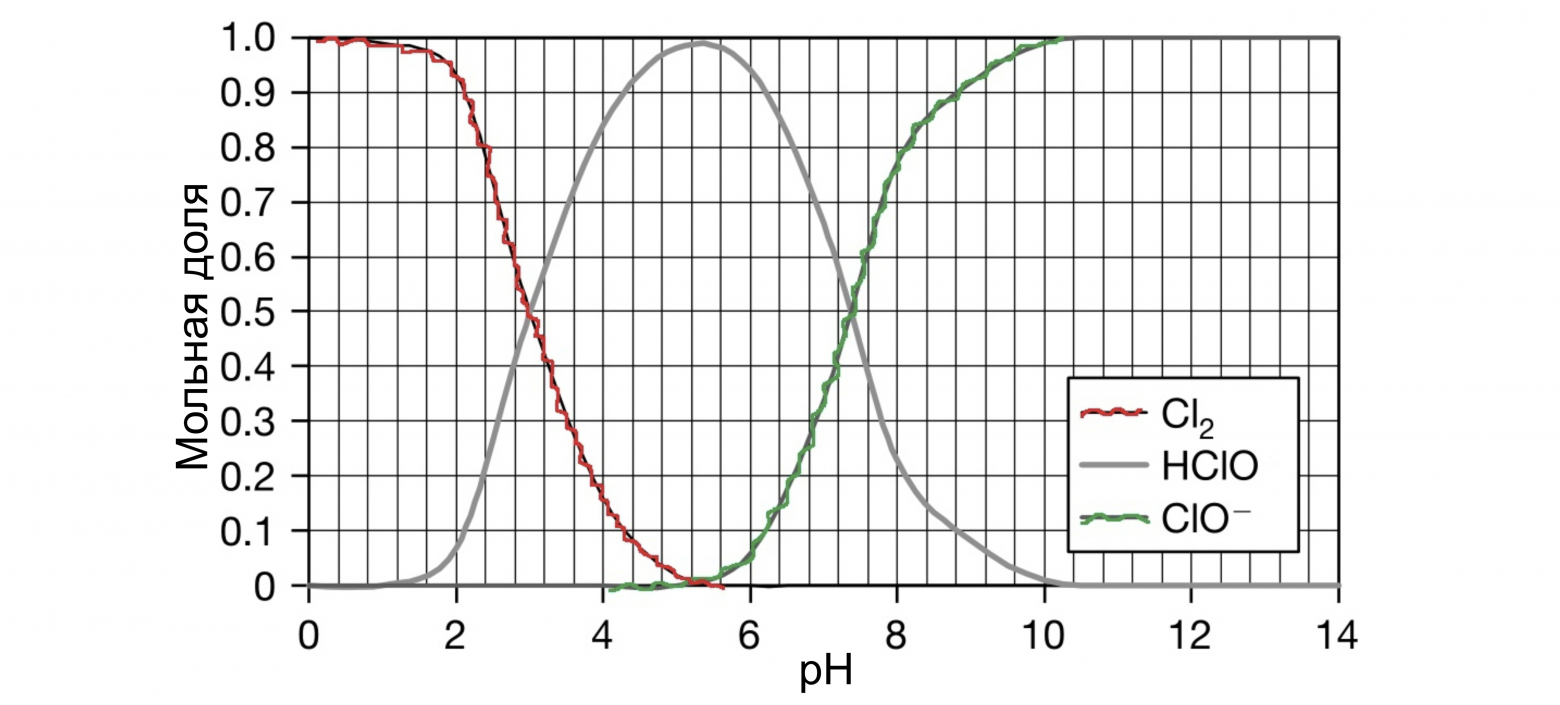
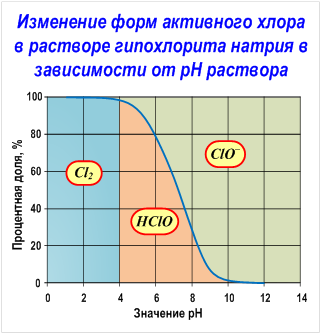
Гипохлорит натрия образует в воде хлорноватистую кислоту и гипохлорит ион в соотношениях, определяемых рН раствора, а именно соотношение между ионом гипохлорита и хлорноватистой кислотой определяется протеканием реакций гидролиза гипохлорита натрия и диссоциации хлорноватистой кислоты (см. Рис. Изменение форм активного хлора в растворе гипохлорита натрия в зависимости от рН раствора).
Растворяясь в воде, ГПХН диссоциирует на катионы натрия и анионы хлорноватистой кислоты:
NaOCl → Na + + OCl −
Так как хлорноватистая кислота (HOCl) является очень слабой, гипохлорит-ион в водной среде подвергается гидролизу:
OCl − + Н2О ↔ НОСl + ОН −
Так как же происходит разложение ГПХН?
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
2 OCl − → 2 Cl − + O2
При температурах выше 35°C распад сопровождается реакцией диспропорционирования:
OCl − → ClO3 − + 2 Cl −
В среде со значением рН от 5 до 10, когда концентрация хлорноватистой кислоты в растворе заметно выше, разложение протекает по следующей схеме:
HOCl + 2 ClO − → ClO3 − + 2 Cl − + H +
HOCl + ClO − → O2 + 2 Cl − + H +
При дальнейшем уменьшении рН, когда в растворе уже нет ClO − ионов, разложение идет следующим путем:
3 HClO → ClO3 − + 2 Cl − + 3 H +
2 HClO → O2 + 2 Cl − + 2 H +
В конце концов, когда рН раствора ниже 3, разложение будет сопровождаться выделением молекулярного хлора:
Как резюме, изложенному выше можно сказать, что при рН выше 10 происходит кислородное разложение, при рН 5-10 — кислородное и хлоратное, при рН 3-5 — хлорное и хлоратное, при рН меньше 3 — хлорное разложение растворов гипохлорита натрия.
Таким образом, подкисляя раствор гипохлорита натрия соляной кислотой, можно получить хлор:
NaOCl + 2HCl → NaCl + Cl2 + H2O.
Окислительные свойства ГПХН
Водный раствор гипохлорита натрия, являющийся сильным окислителем, вступает в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Основные варианты развития окислительно-восстановительного процесса в водной среде мы уже рассмотрели:
в кислой среде:
NaOCl + H + → Na + + HOCl
2 HOCl + 2 H + + 2e − → Cl2↑ + 2 H2O
HOCl + H + + 2e − → Cl − + H2O
в нейтральной и щелочной среде:
NaOCl → Na + + OCl −
2 OCl − + 2H2O + 2e − → Cl2↑ + 4OH −
OCl − + H2O + 2e − → Cl − + 2 OH −
Ниже приведены основные окислительно-восстановительные реакции с участием гипохлорита натрия.
Так в слабокислой среде иодиды щелочных металлов окисляются до йода:
NaClO + 2 NaI + H2O → NaCl + I2 + 2 NaOH, (1)
в нейтральной среде до иодата:
3 NaClO + NaI → 3 NaCl + NaIO3,
в щелочной среде до периодата:
4 NaClO + NaI → 4 NaCl + NaIO4
Надо упомянуть, что на реакции (1) основан принцип колориметрического определения хлора в воде.
Под воздействием гипохлорита натрия сульфиты окисляются до сульфатов:
нитриты до нитратов:
оксалаты и формиаты до карбонатов:
NaClO + NaOH + CHOONa → NaCl + Na2CO3 + H2O
и т.д.
Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот.
Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин (аналогично реагирует и мочевина). Мы уже рассматривали этот процесс в своей статье «Хлорирование питьевой воды», поэтому здесь приведем только суммарные химические реакции этого взаимодействия:
Приведенные окислительно-восстановительные реакции очень важны, т.к. влияют на потребление активного хлора и переход его в связанное состояние при хлорировании воды. Расчет дозы потребления активного хлора при использовании в качестве хлорагента аналогичен тому, что мы приводили в статье «Хлорирование питьевой воды».
2.2. Бактерицидные свойства ГПХН
Наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства.
Гипохлорит натрия (NaOCl) на сегодняшний момент одно из лучших известных средств, проявляющих благодаря гипохлорит-аниону сильную антибактериальную активность. Это средство убивает микроорганизмы очень быстро и при достаточно низких концентрациях, поскольку разложение гипохлорита сопровождается образованием ряда активных частиц (радикалов) и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. (подробнее см. в статье «Хлорирование питьевой воды». Образующиеся при распаде ГПХН частицы (радикалы) способствуют в уничтожении микроорганизмов (способных к окислению), разрушая окружающую их биопленку, что приводит к «гибели» микроорганизмов.
Примечание: Исследованиями установлено, описанный выше процесс аналогичен тому, что происходит естественным образом во всех высших организмах. Так, некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие ей высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Наивысшая бактерицидная активность гипохлорита натрия проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO − в процессе гидролиза и диссоциации ГПХН приблизительно равны.
Что касается бактерицидных свойств ГПХН, то можно привести несколько примеров:
- грибки, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0 ± 0,5%-го раствора NaOCl (при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость только спустя 24 часа после воздействия на них ГПХН);
- более резистентные к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25% -ым раствором или через 30 минут после обработки 0,5%-ым раствором;
- грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 ± 0,5%-м раствором NaOCl.
Количественная оценка эффективности химических бактерицидов и их квалификация приведена в Таблице 2.2.
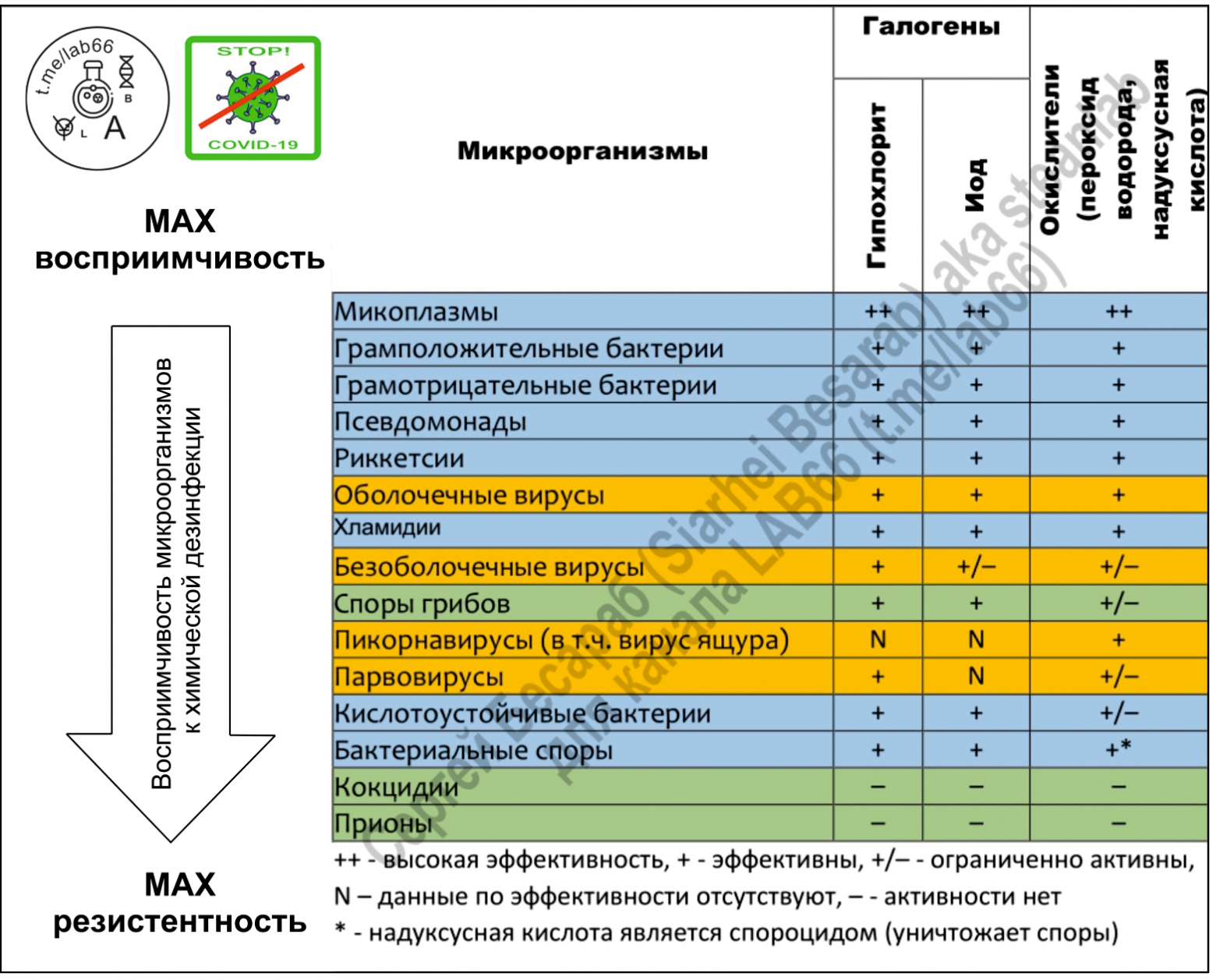
Спектральная активность дезинфицирующих средств по отношению к определенным видам микроорганизмов приведена в Таблице 2.3.
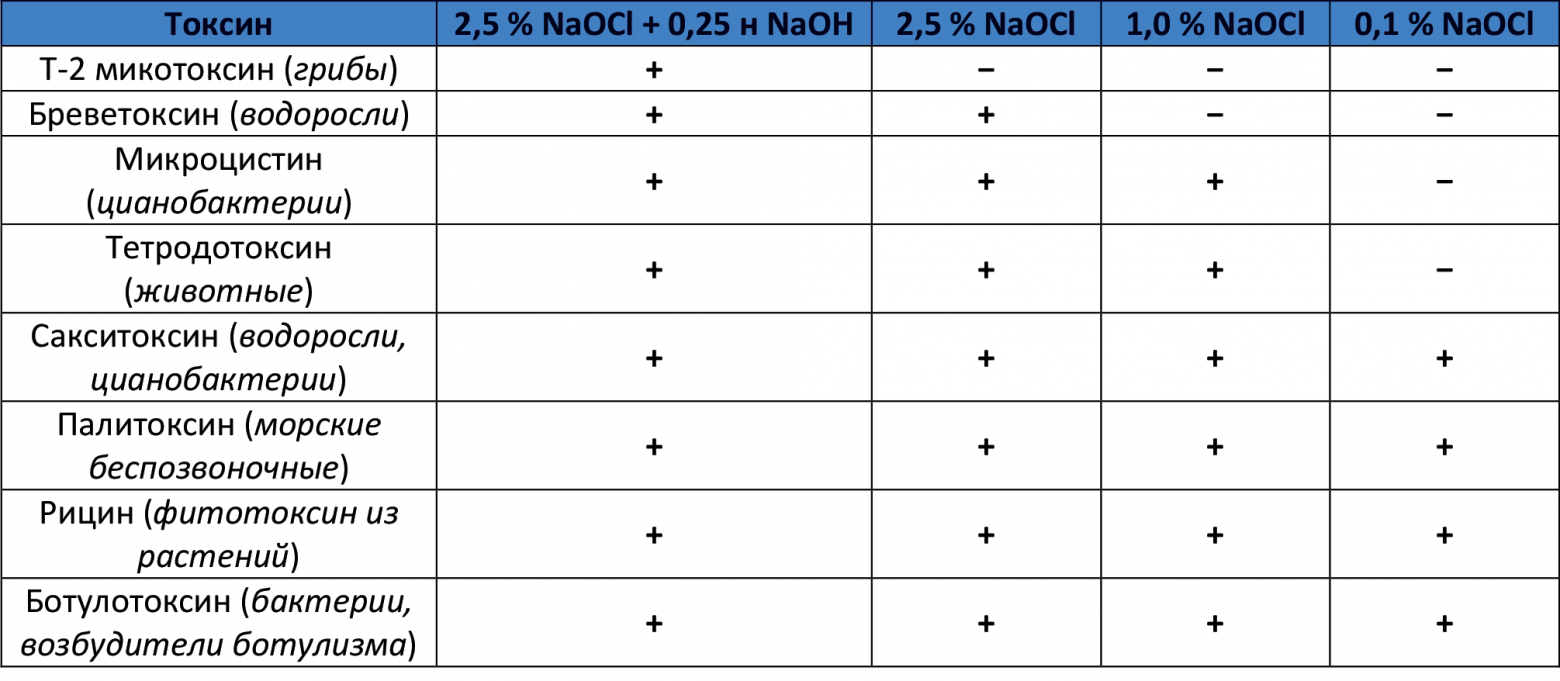
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов (см. Таблицу 2.4).
2.3. Коррозионная активность ГПХН
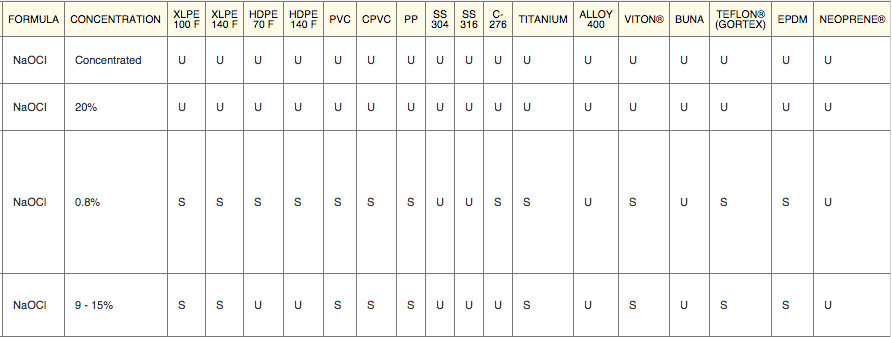
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы. Это обусловлено его высокими окислительными свойствами, которые были рассмотрены нами ранее. Поэтому при подборе конструкционных материалов для изготовления установок очистки воды это необходимо учитывать. В таблице, которая приводится ниже, представлены данные по скорости коррозии некоторых материалов при воздействии на них растворов гипохлорита натрия различной концентрации и при различной температуре. Более подробную информацию по коррозионной устойчивости различных материалов по отношению к растворам ГПХН можно найти в Таблице химической совместимости (в формате rar-архива), размещенной на нашем сайте.
Не менее важно учитывать и то обстоятельство, что фильтрующие загрузки, которые используются для скорых насыпных фильтров, могут изменять свои фильтрующие свойства при воздействии на них ГПХН, точнее активного хлора, например, при подборе фильтрующей среды для процесса каталитического обезжелезивания – катализаторов обезжелезивания.
Не следует забывать, что активный хлор оказывает негативное влияние на мембранные процессы, в частности он вызывает деструкцию мембран обратного осмоса (об этом мы рассказывали в нашей статье «Обратный осмос. Теория и практика применения.»), а при высоком содержании (более 1 мг/л) отрицательно влияет на процессы ионного обмена.
Что касается материалов, из которых следует изготавливать собственно систему дозирования ГПХН, то здесь надо ориентироваться на концентрации активного хлора в рабочих растворах ГПХН, которые, естественно, существенно выше концентраций в обрабатываемой воде. Об этом мы поговорим немного позже.
Скорость коррозии некоторых материалов при воздействии на них растворов ГПХН
| Материал | Концентрация NaClO, % масс. | Температура, °C | Скорость коррозии, мм/год | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алюминий | 10 при pH > 7 | 25 | > 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Медь | 2 | 20 | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сталь Ст.3 | 0,1 при pH > 10 | 20 | 0,1 | 25 | > 10,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сталь 12Х17, 12Х18Н10Т | 5 | 20 | > 10,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сталь 10Х17Н13М2Т | 7 | 25 | 0,1 | 25 | > 10,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
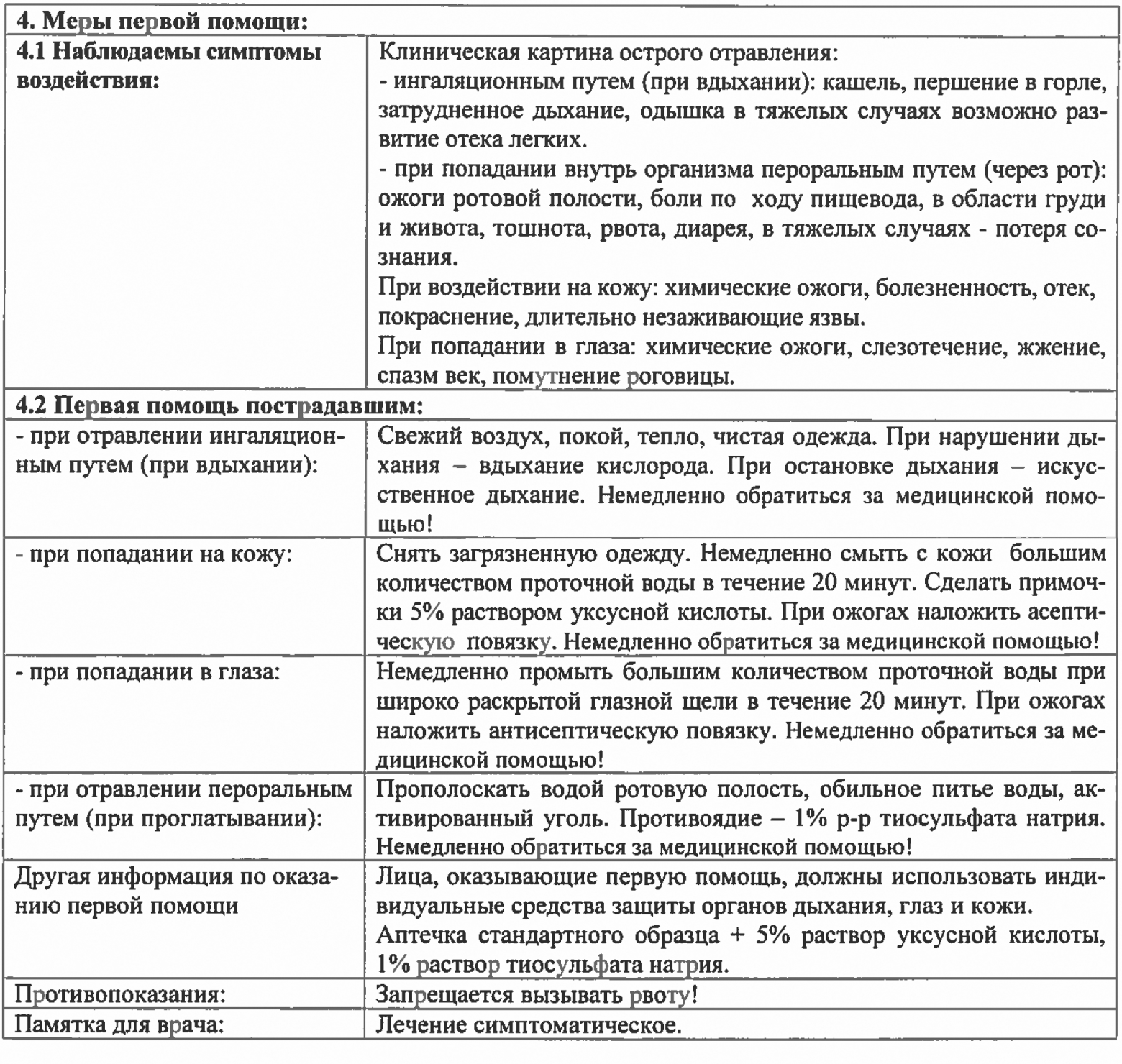
| Чугун СЧ15, СЧ17 | о С); И вот в этих «адских» для ГПХН условиях от него нужно добиться максимальной отдачи. Ну а теперь опишем алгоритм выполнения операций при эксплуатации бассейна:
Как мы убедились, процесс дезинфекции воды в бассейне достаточно сложен и включает в себя несколько стадий. Поэтому для полной автоматизации этого процесса и исключения из него «человеческого» фактора были разработаны системы дозирования, состоящие из одного, двух или даже трех насосов-дозаторов, контроллеров, датчиков, электрохимических ячеек и т.д. Их описание можно найти на этой страничке. 3.2. Обработка бытовых и промышленных сточных водОчистка сточных вод заключается в их обезвреживании и обеззараживании. Хлорирование сточных вод. 3.3. Использование гипохлорита натрия в пищевой промышленностиВысокий риск для здоровья потребителя всегда вызывается испорченными пищевыми продуктами, что ни в коей мере нельзя недооценивать. Чаще всего порча пищевых продуктов вызывается микроорганизмами, которые во время технологического процесса изготовления пищевого продукта попадают на него с плохо очищенных и некачественно продезинфицированных поверхностей технологического оборудования, из плохо подготовленных воды, воздуха, из некачественного сырья, из некорректно отведенных промывных вод, и, наконец, от производственного персонала.
Помимо своих специфических критериев и соответствующего случаю применения дезинфектанта необходимой эффективности и селективности, химические дезинфицирующие средства в пищевой промышленности выбираются исходя из того, как будут они применяться «открытым» или «закрытым» способом.
Принятые в таблице обозначения: С – силикаты; П – поверхностно-активные вещества, О – отдушки; Ф – фосфаты; А – альдегиды; И – ингибиторы коррозии; СЖ – стабилизаторы жесткости; К – комплексообразователи. Нам хорошо известно, что решающим фактором при приобретении какого-либо пищевого продукта являются его вкусовые характеристики. Поэтому технологи пищевой промышленности неохотно используют средства дезинфекции с хлорсодержащими агентами, поскольку активный хлор уж очень «активно влияет» на вкус и запах продукции. Исключение составляет наружная дезинфекция технологического оборудования, ввиду того, что хлор обладает замечательным пролонгирующим действием. Гипохлорит натрия относится к числу таких средств. Обычно для дезинфекции технологического оборудования применяют раствор ГПХН, содержащий 30-40 мг/л активного хлора. Бактерицидное действие гипохлорита натрия проявляется после нанесения раствора при 20-25оС и его экспозиции в течение 3-5 минут. Правда, в этом случае надо учитывать коррозионную активность растворов ГПХН, поэтому для снижения коррозирующего действия используют смесь гипохлорита натрия, каустической соды и метасиликата натрия (препарат «Гипохлор»). Коррозионная активность этого препарата в 10-15 раз меньше, чем обычного гипохлорита натрия. 3.4. Использование гипохлорита в рыбоводствеРыбоводные пруды, орудия лова, живорыбная тара, рыбоводный инвентарь, а также спецодежда и обувь лиц, участвующих в проведении рыбоводных и ветеринарно-санитарных мероприятий, подлежат периодической очистке и дезинфекции (дезинвазии). Чаще всего для этого используется хлорная известь. Однако в последнее время для этой цели стали использовать гипохлорит натрия в виде разбавленных растворов. 3.5. Использование гипохлорита в здравоохраненииУже первой мировой войне гипохлорит натрия как антисептик с успехом применяли для перевязок при лечении ран и ожогов. Однако в то время чисто технические трудности массового производства, да и не очень хорошее качество препарата способствовали подписанию ему чуть ли не обвинительного приговора. Кроме того «подоспели» новые, как тогда казалось, более эффективные лекарства, и вскоре о гипохлорите забыли. и вспомнили в 60-е годы ХХ века во время войны во Вьетнаме. Там в обстановке, когда требовалось использовать наиболее действенные средства борьбы с инфекцией, отдавали предпочтение гипохлориту натрия, а не новейшим антибиотикам. Такая симпатия объяснялась не только высокой эффективностью ГПХН, но и универсальностью препарата. Ведь во фронтовых условиях вместо дюжины упаковок лучше иметь под рукой один флакон с раствором, которым можно и рану промыть, и кожу перед операцией продезинфицировать, и инструменты обработать. 3.6. Использование ГПХН для отбеливания белья в фабриках-прачечныхСчитается, что отбеливание белья при промышленной стирке – самая потенциально опасная операция из всех операций, применяемых в стирке белья, а отбеливатель, соответственно, – самое опасное вещество для ткани. Большинство отбеливателей, применяемых при промышленной стирке, являются сильными окислителями, под воздействием которых большинство окрашенных веществ после их окисления становятся или бесцветными, или растворимыми в воде. И как любой окислитель, отбеливатель одновременно «атакует» как пятна, так и волокна ткани. Поэтому всегда при отбеливании побочным процессом будет разрушение волокна ткани. Отбеливатели, применяемые при промышленной стирке, бывают трех типов: пероксидные (перекисные или кислородосодержащие), хлорные и серосодержащие. В рамках данной публикации мы остановимся только на одном из хлорсодержащих отбеливателей тканей – гипохлорите натрия. NaOCl → NaCl + [O]. Поэтому без гипохлорита натрия не обойтись при отбелке больничного белья или белья, пораженного плесенью. 40°С). При повышении температуры (вплоть до 60°С) активность отбеливателя на основе ГПНХ растет линейно, а при более высокой температуре наблюдается экспоненциальная зависимость роста активности отбеливателя.
Как утверждают специалисты BLRA, если следовать этим рекомендациям, то в процессе отбеливания при использовании ГПХН удаляется большинство обычных пятен, а ткань получает минимальные повреждения. 3.7. Дезинфекция питьевой водыДозу хлора устанавливают технологическим анализом из расчета, чтобы в 1 л воды, поступающей к потребителю, оставалось 0,3…0,5 мг хлора, не вступившего в реакцию (остаточного хлора), который является показателем достаточности принятой дозы хлора. За расчетную следует принимать ту дозу хлора, которая обеспечивает указанное количество остаточного хлора. Расчетная доза назначается в результате пробного хлорирования. Для осветленной речной воды доза хлора обычно колеблется в пределах 1,5 – 3 мг/л; при хлорировании подземных вод доза хлора чаще всего не превышает 1– 1,5 мг/л; в отдельных случаях может потребоваться увеличение дозы хлора из-за наличия в воде закисного железа. При повышенном содержании в воде гуминовых веществ требуемая доза хлора возрастает. Обеззараживание хлором. Итак, налицо основные преимущества применения хлора для хлорирования воды:
Именно поэтому в течение многих десятилетий сжиженный хлор являлся наиболее надежным и универсальным средством обеззараживания воды в системах централизованного водоснабжения населенных мест. Казалось бы – почему же не продолжать использовать хлор для обеззараживания воды? Давайте разберемся вместе…
Не оставляет сомнения, что оборудование, необходимое для дозирования столь смертоносного реагента (об этом почти регулярно свидетельствует статистика) должно обладать целым рядом степеней безопасности.
а при потреблении газообразного хлора из баллонов более 2 кг/час или более 7 кг/час при потреблении хлора из контейнера – испарители хлора, к которым предъявляются особые требования. Они должны быть оснащены автоматическими системами, предотвращающими:
Испаритель должен быть снабжен специальным отсекающим электромагнитным вентилем на входе, манометром и термометром. То есть степень опасности хлора минимизируется наличием целого комплекса мер по организации его хранения и использования, в том числе за счет организации санитарно-защитных зон (СЗЗ) складов реагента, радиус которых достигает 1000 м для наиболее крупных сооружений. Обеззараживание гипохлоритом натрия
Таким образом, в отличие от хлора растворы ГПХН имеют щелочной характер и могут применяться для повышения уровня рН обрабатываемой воды.
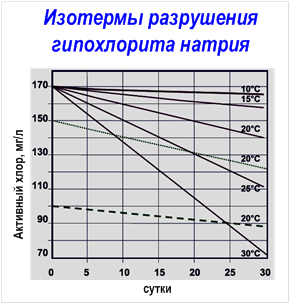
Потерю активности растворов ГПХН со временем наглядно иллюстрирует следующая таблица:
Ввод рабочего раствора ГПХН в обрабатываемую воду осуществляют методом пропорционального дозирования с помощью насосов-дозаторов. При этом пропорциональное дозирование ( управление насосом-дозатором ) может производиться как с использованием импульсных счетчиков воды, так и по сигналу датчика хлора, установленного либо непосредственно в трубопроводе, либо после контактной емкости. После узла ввода ГПХН или на входе в контактную емкость обычно устанавливают динамический смеситель для тщательного перемешивания обрабатываемой воды с рабочим раствором ГПХН. Таким образом, казалось бы, преимущества применения гипохлорита натрия перед хлором при хлорировании воды, достаточно явные: он значительно безопаснее – не горюч и не взрывоопасен; нет необходимости в дополнительном оборудовании, обеспечивающего безопасность процесса хлорирования, кроме наличия: 6-кратной вентиляции, резервуара для сбора вытекшего гипохлорита натрия и емкости с нейтрализующим раствором (тиосульфат натрия). Применяемое при использовании ГПХН оборудование для обеспечения процесса обеззараживания на станциях водоподготовки не относится к категории промышленно опасного и не поднадзорно Федеральной службе по экологическому, технологическому и атомному надзору. Это облегчает жизнь эксплуатационникам. Мы уже неоднократно говорили о том, что растворы ГПХН неустойчивы и подвержены разложению. Так вот по данным Мосводоканала выяснено, что гипохлорит натрия марки «А» теряет до 30% от первоначального содержания активной части в результате хранения по истечении 10 суток. К этому добавляется и то обстоятельство, что он замерзает в зимнее время при температуре -25°С, а в летнее время наблюдается выпадение осадка, что приводит к необходимости использования железнодорожных цистерн с термоизоляцией для перевозки реагента. Вывод: 3.8. Обеззараживание ГПХН оборудования для очистки водыПри обеспечении населения питьевой водой безупречно чистой в микробиологическом отношении не только сама вода должна быть очищена от патогенных бактерий, вирусов и паразитов, но и оборудование, используемое для водоснабжения: трубопроводы, емкости (резервуары), арматура, фильтры и насосы, которые используются при обработке воды и находятся в непосредственном контакте с ней.
Во избежание повышенного расхода дезинфектанта в емкость устанавливают специальные моющие головки (форсунки), которые позволяют при распылении дезинфицирующего раствора обработать всю поверхность емкости. При этом резко снижается расход дезинфектанта, и появляется возможность работы в режиме рециркуляции дезраствора через систему CIP (от англ. Clean In Place – очистка на месте) – безразборной автоматической мойки. При этом содержание активного хлора в растворе может составлять от 50 до 200 мг/л. ПОСЛЕДНИЕ НОВОСТИ: 08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины. 08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины. Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)Не передать, насколько мне приятно это писать. Данная статья полностью профинансирована подписчиками канала LAB66. Ни один производитель описанных в тексте средств — своего участия не проявил, так что никакой скрытой рекламы, чиcтый альтруизм и потребительский интерес 🙂 Сегодня читаем о самом простом, самом доступном и самом действенном антисептике — про гипохлорит натрия (он же «Белизна»). Совместимость с различными материалами, техника безопасности, свойства и эффективность не только против коронавируса, но и против страшной плесени и ее микотоксинов. В качестве «вишенки» — контрольная закупка магазинных отбеливателей и оценка их состава. Чтобы узнать как в эпоху пандемии нас дурят производители бытовой химии и прочий «менеджерский брат» — идем под кат. И обязательно закидываем в закладки. Эта информация пригодится еще не раз 😉 Важно! Информацию, предложенную в данной статье, вы не найдете больше ни на одном русскоязычном ресурсе. Поэтому публикую на хабре, на портале высшего пользовательского доверия. Просьба ко всем ресурсам сомнительного качества — давайте ссылку на первоисточник. Не переписывайте без понимания — не плодите бесполезный информационный шум, от которого в последнее время уже и так некуда деться. Разномастному «ученому люду» тоже рекомендую не стесняться писать в своих «методических указаниях» ссылку на Хабр. Я то вижу откуда вы все копируете, книгами 50-60 годов вечно прикрываться не получится 😉 Так что настоятельно рекомендую меня уведомлять об использовании материалов, а в свой список литературы писать можно что-то вроде:
Предисловие от автора. Смотрю колонку «сейчас читают» на хабре и с сожалением вижу, что принцип «пока гром не грянет — мужик не перекрестится» работает даже здесь. Один сплошной коронавирус. И вспоминается сразу мне моя статья, опубликованная в конце января (Коронавирус 2019-nCoV. FAQ по защите органов дыхания и дезинфекции) у которой 30% минусов были с пометкой «не соответствует тематике Хабра». Соответствовать, видимо, начинает лишь тогда, когда указание сверху поступит… Ладно, чего о грустном говорить. Если пару тысяч читателей еще тогда, в январе, без паники и спешки, смогли купить себе СИЗ и нужные антисептики — можно считать, что цель моя достигнута. А сейчас просто вольюсь в тренд и расскажу об самом простом, доступном и очень эффективном антисептике. Не думаю, что он когда-то сможет исчезнуть так же, как исчез этанол. Сырья хватает, гипохлорит натрия можно производить до тех пор, пока существует электричество… Есть такая интересная (интересная не только для химика, но и для других специалистов, владеющих английским языком) книга — 100 самых важных химических соединений: Cправочное руководство (The 100 Most Important Chemical Compounds: A Reference Guide). В этом руководстве в разделе солей натрия находятся рядом пищевая сода, карбонат натрия, поваренная соль, гидроксид натрия (средство «Крот») и гипохлорит натрия. В принципе, понятно чем многие из этих солей заслужили такое право. А вот на гипохлорите натрия я остановлюсь сегодня подробнее. Первым делом, конечно же определение:
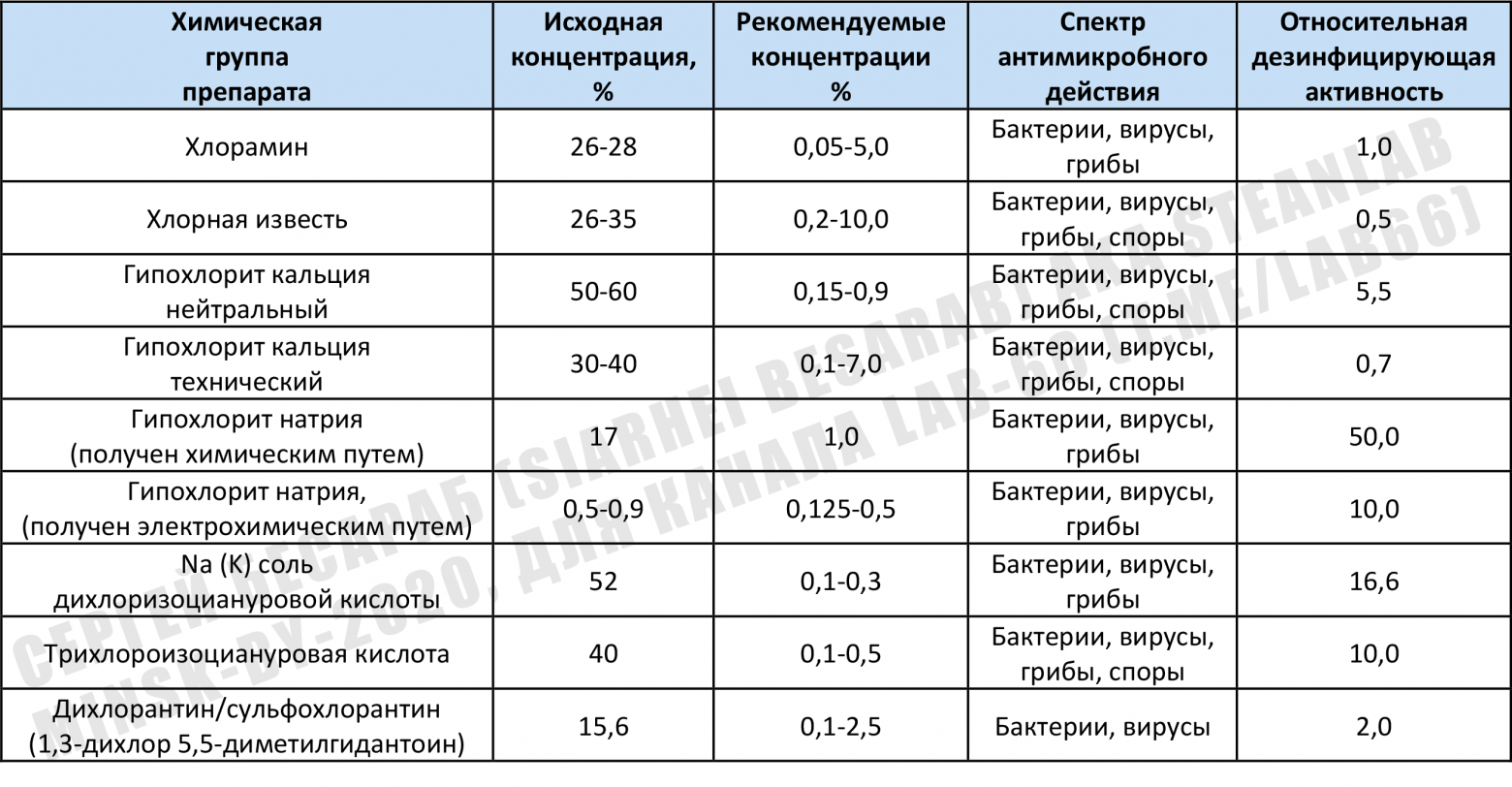
С момента своего открытия в 1787 году химиком Клодом Луи Бертолле (тем самым, которому мы должны быть благодарны за хлопушки, спичечные головки, салюты и проч. изобретения, где используется т.н. бертолетова соль) гипохлорит натрия достаточно долго выступал сугубо как отбеливающий агент и только примерно с середины 19 века началось его шествие как дезинфектанта. Поэтому пройдусь немного по химическим свойствам, сохраняя «историческую хронологию». Хлорочка как отбеливательНу а атомарный кислород — очень ядреная штука, один из мощнейших окислителей на нашей планете. Кстати, именно благодаря атомарному кислороду озон проявляет свои бактерицидные свойства. Так что, в некотором роде, озон и гипохлорит натрия — «кислородные братья» 🙂 Отбеливающая способность гипохлорита натрия (и подобных ему химикатов) обусловлена их способностью разрушать светопоглощающие структуры (т.н. хромофоры) в органических молекулах. Притом это могут быть не только хромофоры на тканях. Гипохлорит неплохо отбеливает пятна плесени на плитке, зубные пятна, вызванные флюорозом и удаляет пятна от танинов чая на кружках (т.н. «чайный камень»). Справедливости ради, стоит отметить, что хлорноватистая кислота образует соли не только с натрием, но и, например, с кальцием. Примером может служить та самая хлорная известь, широко используемая из-за своей дешевизны для дезинфекции складских помещений, животноводческих ферм, туалетов и т.д и т.п. На долю гипохлорита натрия приходится около 83% мирового потребления (в роли отбеливателя/дезинфектанта), на хлорную известь — остается 17%. В 2005 году в мире было использовано около 1 миллиона тонн гипохлорита натрия, причем около 53% этого количества использовалось в домашних хозяйствах для дезинфекции и отбеливания белья (+ мытья, т.к. щелочная среда раствора гипохлорита неплохо омыляет жиры и делает их водорастворимыми). Оставшиеся 47% приходились на очистку сточных вод и подготовку питьевой воды (а также очистку бассейнов и градирен ГЭС от биообрастания/водорослей/моллюсков, отбеливание целлюлозы/бумаги/тканей, и использование в роли реактива для химических синтезов). Водоочистной эффект, кстати, это не только дезинфекция. Это и удаление запахов (NaOCl нейтрализует сероводород и аммиак) и даже обезвреживание цианидов в сточных водах (например, после золотодобычи или гальванических ванн). Хлорочка, как дезинфектантЛюбое несчастье как индикатор проявляет самые лучшие и самые худшие черты человека. Так и с пандемией коронавируса. Для меня удивительно, что многие трезвомыслящие, прекрасные специалисты, поддавшись панике начали терять голову и выдавать что-то вроде «гипохлорит не убьет коронавирус» (или еще лучше «коронавирус — это ГМО бактерия»). Меня мало волнует мнение многочисленных youtube-блогеров и диванных аналитиков и т.п. с их дилетантскими «рассуждениями о рыбалке» (в канале LAB-66 уже приходится у особо рьяных кликуш и «одержимых мировым заговором» даже требовать диплом о наличии профильного образования). А вот к информации от WHO, CDC, EPA я стараюсь четко прислушиваться. Ожидаемо, что в мартовском бюллетене выпущенном одной из упомянутых организаций (EPA’s Registered Antimicrobial Products for Use Against Novel Coronavirus SARS-CoV-2, the Cause of COVID-19) в списке эффективных «коронавирусных» дезсредств оказалось достаточно много гипохлорита. Удивляться здесь нечему, ведь NaOCl — это одно из оптимальнейших дезсредств (из-за комбинации широкого спектра активности, доступности и отсуствия долгосрочного вреда для окружающей среды). По поводу дезинфицирующего эффекта смотрим картинку (кликабельна): На всякий случай напоминаю, COVID-19 — это болезнь, вызванная оболочечным вирусом SARS-CoV-2, который содержит внутри своего «конвертика» одноцепочную РНК. В принципе, любые дезинфицирующие средства на основе хлора, так или иначе действуют через образование HOCl (та самая хлорноватистая кислота). Но сильный бактерицидный эффект гипохлорита связан не только со способностью продуцировать атомарный кислород, но и с действием гидроксильных ионов. Щелочная среда нарушает целостность цитоплазматической мембраны и приводит к необратимому ферментативному ингибированию, изменению клеточного метаболизма и деградации фосфолипидов (как при гипероксидировании липидов). Гипохлорит натрия воздействует на ферментативный аппарат бактерий, способствуя необратимой инактивации, вызванной щелочной средой и хлораминированию вызванному хлором. Т.е. можно сказать, что при обработке гипохлоритом зараженного объекта одновременно происходят реакции омыления липидов, нейтрализации аминокислот и хлораминирования. Таким образом не только дезактивируются многие микроорганизмы, но и происходит деградация липидов и жирных кислот, с образованием ПАВ (=мыла) и глицерина, т.е. уже упомянутая реакция омыления. Гипохлорит не только дезинфицирует, но еще и моет 🙂 Логично, что при таком действии выработать резистентность (как к антибиотикам) практически не реально. При обработке живых тканей важна еще и такая вещь, как биосовместимость. Это способность химического реагента вообще не реагировать с биологическими тканями на протяжении какого-то периода времени (и иметь умеренную реакционную способность в течение недели, постепенно снижающуюся к 0). Высокие концентрации гипохлорита достаточно агрессивны (см. раздел про технику безопасности), но вот в концентрациях 0,5-1% это очень даже биосовместимый препарат. Поэтому гипохлорит натрия высоких концентраций используется для хлорирования воды на некоторых (!) станциях водоподготовки — 12% раствор — некоторых, потому что чаще всего используют хлор в баллонах. 15% раствор используют для обеззараживания сточных вод на очистных сооружениях. Растворы с концентрацией не менее 10% используются для очистки воды в бассейнах и удаления биопленок. Кстати, именно гипохлорит натрия может быть прекрасным средством для уничтожения возбудителей легионеллёза. Эти микроорганизмы, кстати, очень часто в тех самых биопленках и обитают. Ну а в дезинфицирующих спреях и салфетках, используемых на твердых поверхностях, чаще всего используются концентрации до 1,5%. Кстати, про то, как сделать самодельные салфетки с гипохлоритом я достаточно давно писал на Patreon в своей статье «Реверс-инжиниринг влажной салфетки или Гипохлорита вам в ленту». Кстати, пользуясь случаем выражаю благодарность всем моим «патронам». Вас мало, но вы поддерживаете серьезно! Традиционно считается, что для обработки больниц и помещений, загрязненных жидкостями организма (кровью и т.п.) необходимо использовать 0,5% раствор. Такой концентрации достаточно, чтобы дезактивировать клостридиум диффициле в фекалиях или уничтожить какие-нибудь папилломавирусы человека. Для обработки/мытья рук чаще всего используется 0,05% раствор гипохлорита, который готовят из гранул (на картинке — выдержка из инструкции по обеззараживанию в условиях эпидемии лихорадки Эбола): На Западе также активно используется т.н. «раствор Дакина» ( Замечание 1. о других «хлорных дезинфектантах»Помимо упомянутых уже мной гипохлорита натрия и гипохлорита кальция, существуют и другие вещества, способные активно продуцировать хлор (ну а хлор с водой = «малостабильная хлорноватистая кислота HOCl» и далее опять см. п. «Хлорочка, как дезинфектант»). Притом там могут быть и вещества органической природы. На просторах интернета я нашел информацию (скорее всего выдранную из какой-то советской книги по гражданского обороне — потому что многие наименования, да и сами препараты давно перестали существовать). Эта таблица дает примерное представление о спектре препаратов и их сравнительной «дезмощности по хлору». Почистил авторски и предлагаю на ваш суд. Можно, по крайней мере, примерно прикинуть/сравнить активность разных дезсредств (если захочется что-то отличное от старого доброго NaOCl): Возможно, читателю может встретится такой дезинфектант, как хлорцин (это НЕ украинская мазь с одноименным названием). Это Na-ДХЦК (натриевая соль дихлоризоциануровой кислоты — хлорцин Н) — 30,0% (или К-ДХЦК — 20,0% — хлорцин К), триполифосфат натрия — 6%, ПАВ (сульфонол) -3%, сульфат натрия — до 100%. Хлорцин содержит 11 — 15% активного хлора. Может встречатся и т.н. препарат ДП-2. Зашифрованного названия не стоит пугаться, по сути — обычная трихлороизоциануровая кислота с добавками ПАВ. Сюда ж внесу и замечание от eteh: «… электролизный ГПХН возможен и 5-7%. При получении, соответственно, не проточным электролизом, а мембранным — из соли и воды без добавления дополнительных реагентов. Ну а выше, да, там только отдельно готовить концентрированный щелочной раствор для насыщения хлором». Замечание 2. «хлорка которая лечит»Все яд и все лекарство. Не стали исключением и гипохлорит, который может не только уничтожать все живое, но и лечить, например, поражения кожи. Сразу хочется вспомнить ванны с разбавленным гипохлоритом, которые на Западе ( В «медразделе» не грешно упомянуть и про применение гипохлорита натрия в стоматологии (ибо именно стоматологи у меня чаще всего интересовались вопросами концентрации, разведения в и т.п.). Гипохлорит натрия является препаратом выбора в эндодонтии и очистке корневых каналов. Чаще всего стоматологами используются концентрации от 0,5% до 5,25% (стандартный — 2%). Здесь работает правило — низкие концентрации гипохлорита удаляют преимущественно некротические ткани и некоторые виды бактерий, высокие концентрации — повреждают живые ткани, но наиболее полно уничтожают микробы. Кстати, вместо повышения концентрации можно подогреть раствор (50-60 °C), что даст сравнимую с более концентрированным раствором эффективность в удалении мягких тканей и дезинфицировании корневого канала. Замечание 3. Об очистке воды в полевых условияхТема очистки воды достаточно обширна и вполне достойна отдельной статьи. Я же кратко упомяну об очистке воды в полевых условиях. Ведь бывают ситуации, когда ни то что озонатор или уф-лампу использовать, а даже и закипятить воду тяжело. Поэтому у химических обеззараживателей, на мой взгляд, пока особой альтернативы не видно. Хлорное обеззараживание может считаться старейшим вариантом полевой дезинфекции воды. Американские военные еще во время Второй мировой войны в составе сухпайка имели таблетки «Halazone», с натриевой солью 4-[(дихлорамино)сульфонил]бензойной кислоты. Потом постепенно это вещество вытеснил дихлоризоцианурат натрия (тот самых ДХЦК), именно он был в составе широко известных в узких кругах таблеток «Пантоцид». Американский вариант — это ДХЦК спрессованый с адипиновой кислотой и содой, быстрорастворимые таблетки. Стоит отметить, что для полевой дезинфекции могут использоваться и таблетки для обеззараживания бассейнов (двухкомпонентные, содержащие смесь хлорит+хлорат+карбонат натрия и гидросульфат натрия), продуцирующие диоксид хлора. В целом, такой вариант подходит и для обеззараживания питьевой воды. Причем этот вариант, например, эффективен против лямблий больше чем обычный хлор. Все описанные варианты — удобны in situ (туристы, военные, МЧС и т.п.). Для вариантов вроде стихийного бедствия или какой-нибудь техногенной катастрофы таблетки могут быть недоступны, а то и слишком дороги. Для этой цели вполне можно использовать и Белизну (желательно без всяких ПАВ-ов и отдушек). Необходимо всего пару капель 5% гипохлорита натрия на литр воды с выдержкой в емкости с закрытой крышкой в течение 30-60 минут. Перед непосредственным употреблением желательно крышку открыть и «дать проветриться». Не стоит сразу лить в себя, как бы там ни хотелось пить. CDC в рамках своей стратегии «Безопасная система водоснабжения» (SWS) для развивающихся стран рекомендует для обеззараживания воды использовать 0,5–1,5% раствор гипохлорита натрия (две-три капли на литр и экспозиция 30 минут). EPA, кстати, советует использовать 8,25% раствор гипохлорита натрия (две капли на литр и экспозиция 30 минут), важное замечание «удвойте количество отбеливателя, если вода мутная, окрашенная или очень холодная. после обработки вода должна иметь слабый запах хлора. Если нет, повторите дозировку и дайте постоять еще 15 минут перед использованием«. Стоит отметить, что на крайний случай, для дезинфекции воды можно использовать и гипохлорит кальция («хлорную известь»). Замечание 4. «Хлорка» vs плесень, грибки и микотоксины
Существует в немногочисленном мире «химиков, которые в теме» такой «Грааль» как микотоксины. Обыватель чаще всего ничего про это не слышал, или слышал краем уха (типа «Джонни Мнемоника отравили таким веществом. »). По сути ж, это тема отдельной и очень интересной статьи. Пока же просто скажу, что микотоксины в простейшем применении = плесень, плесневые грибы различных разновидностей, которые могут встречаться на овощах, фруктах, крупах и т.д. и т.п. Микотоксины — невозможно смыть водой или мылом, невозможно удалить срезав подгнившую кожицу. Микотоксины — могут равномерно распределятся по всему объему картошки/яблока и т.д. и т.п. И, к сожалению, многие микотоксины в человеческом организме вызывают множественные симптомы поражения органов (при попадании на кожу, в лёгкие или в желудок). Из-за того, что концентрации их достаточно малы (сомневаюсь, что кто-то постоянно ест гнилые фрукты или плесневелые орехи) — воздействие это растянуто по времени и кажется чем-то привычным (= «заболел от генетической предрасположенности/пьянства/плохого воздуха», а не потому что отравлен микотоксинами из некачественных круп). Про это можно говорить долго, но герой моей статьи гипохлорит, а значит надо бы свести тему к нему. А сводится все к тому, что гипохлорит натрия в определенных концентрациях может использоваться не только для уничтожения микробов и плесневых грибов (см. таблицу в начале раздела «Хлорочка, как дезинфектант«), но и для дезактивации того, что после них осталось, в т.ч. плесневых, растительных токсинов и токсинов животного происхождения.. Более подробно — смотрите таблицу (30-минутная экспозиция). Плюсик — токсин дезактивируется, минус — нет.
И уже привычно не отмахнешся, не успокоишь себя фразой «да где тот микотоксин и Fusarium, а где я» и водочкой, привычно, не полечишь… Потому что они — много где. На клубнике например: Так что, вполне себе вариант снижения количества микотоксинов в подозрительных фруктах и овощах — это купание их в щелочном гипохлорите натрия с последующим обычным мытьем. При таком варианте обработки убиваются практически все возможные «поверхностные зайцы». Стабильность и сроки хранения (=есть ли смысл закупать впрок?)Если химия и медицина для рядового технаря не особо интересны (достаточно знать работает или нет), то вопросы стабильности при хранении — наоборот, первостепенны. Ведь гипохлорит натрия — вещество малостабильное. При комнатной температуре распадается примерно 0,75 г активного хлора в сутки, т.е. раствор с содержанием 250 г/л гипохлорита натрия теряет примерно половину активного хлора за 5 мес, с содержанием 100 г/л — за 7 мес, 50 г/л — за 2 года, а 25 г/л — за 5–6 лет. Его устойчивость зависит от ряда факторов:
В большинстве случаев распад протекает по таким вот основным механизмам: Пройдусь по каждому пункту отдельно: Концентрация: чем более концентрированный раствор, тем быстрее он разлагается, соответственно самые слабые растворы — самые стабильные. Литературные данные указывают на то, что при снижении концентрации гипохлорита натрия в два раза, скорость разложения уменьшается в 5 раз. Это связано с уменьшением общей концентрации ионов и со снижением ионной силы раствора. Разбавление снижает как концентрацию NaOCl, так и концентрацию других ионов (равновесных хлоридов, хлоратов, гидроксидов и т.д. — см. картинку «равновесия рН» ниже). Температура: распад гипохлорита с повышением температуры в 90% случаев проходит по уравнению (B). Можно держать в уме следующее правило — скорость разложения возрастает в 3–4 раза, для каждых 10 °C для растворов с концентрациями гипохлорита натрия от 5 до 16%. А если напрячься и снизить температуру хранения хлорки до 5 °C (при условии полного отсутствия примесей металлов и других факторов ускоряющих разложение), то хранить в темной бутылке можно будет практически вечно. Щелочность и рН раствора: для стабильного хранения раствор гипохлорита должен иметь pH от 11,5 до 12,5. В случае разбавленных растворов NaOCl при pH ниже 10,8 скорость разложения начинает значительно увеличиваться, достигая максимального значения в диапазоне 5-9. Но здесь есть нюанс. Когда рН раствора уменьшается, содержание HOCl увеличивается и растет окислительно-восстановительный потенциал (см. картинку с изменением форм активного хлора в растворе гипохлорита натрия в зависимости от рН раствора, Сl2 — молекулярный хлор, ClO – -гипохлорит-ион, HClO-хлорноватистая кислота). Т.е. для хранения оптимальнее высокощелочные растворы, а для экстренной дезинфекции — растворы с низким рН. Хотя, говоря начистоту, повышать рН тоже необходимо до разумного предела. Если pH превышает значение 13 — скорость разложения опять скачкообразно увеличивается. Это происходит из-за увеличения ионной силы раствора, вызванного присутствием сильного избытка щелочи (NaOH). В целом можно использовать за правило — для хлор-содержащих дезсредств используем только щелочную среду. Для пероксидных дезсредств — наиболее эффективна кислая среда. ЧАС-ы несовместимы с кислотами и резко теряют в их присутствии свои дезинфицирующие свойства. Альдегиды (вроде формалина и глутаральдегида) — работают и в кислой, и в щелочной среде) Примеси: алюминий, медь, никель, железо, кобальт, марганец и т.д. являются катализаторами разложения NaOCl. Металлы в основном катализируют разложение по реакции (A) с образованием газообразного кислорода. Твердые суспензии, такие как, например, частицы графита в гипохлорите натрия, получаемом электрохимическим методом, также вызывают разложение NaOCl, в частности, по реакции (B) с образованием хлората натрия. Кстати, как говорят некоторые производители дезсредств, добавки сульфата магния, силиката натрия, борной кислоты — замедляют распад. Воздействие света: воздействие света ускоряет процесс разложения NaOCl в растворе. Современные методы упаковки и использование непрозрачных полиэтиленовых бутылок практически исключают влияние света на стабильность растворов. Янтарные или зеленые стеклянные бутылки также имеют такой же результат. Если важны конкретные цифры — получится вот так:
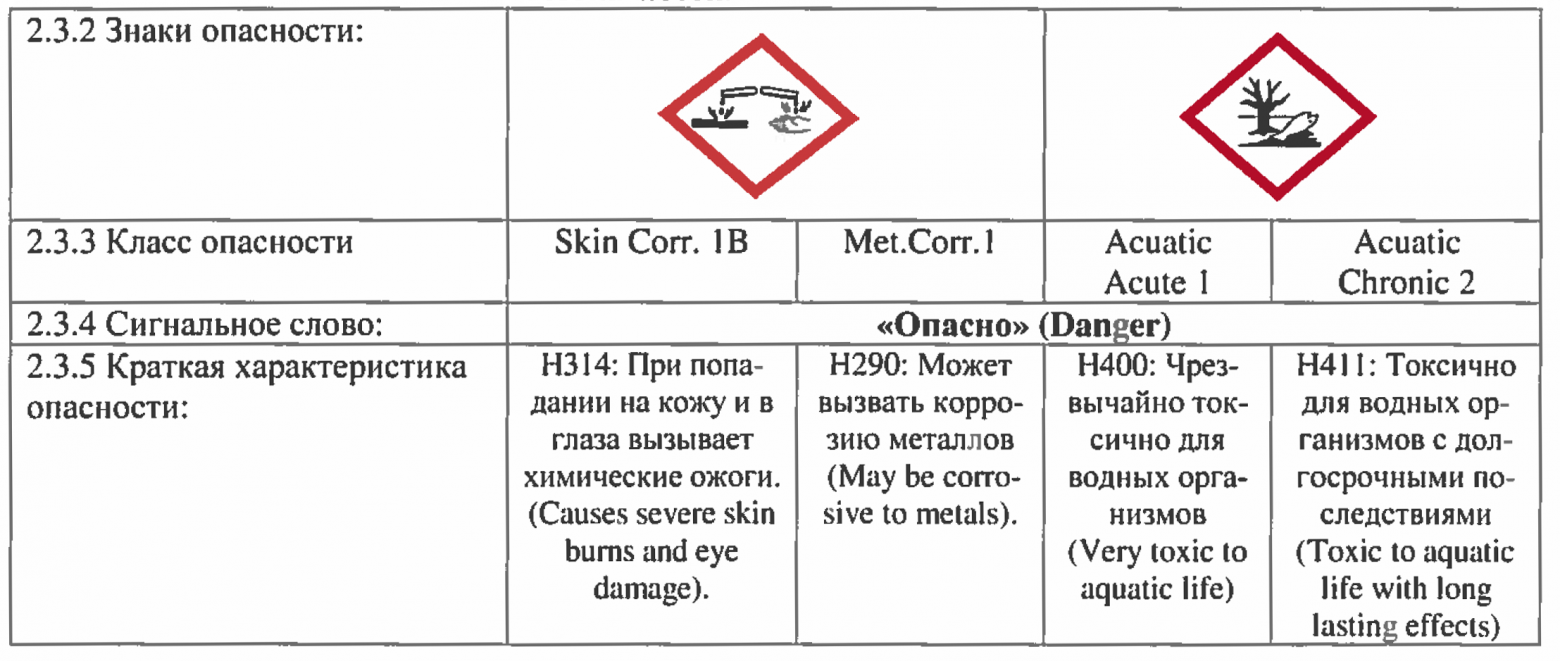
Подводя итог, можно сказать следующее. Самым долгоиграющим будет препарат, который:
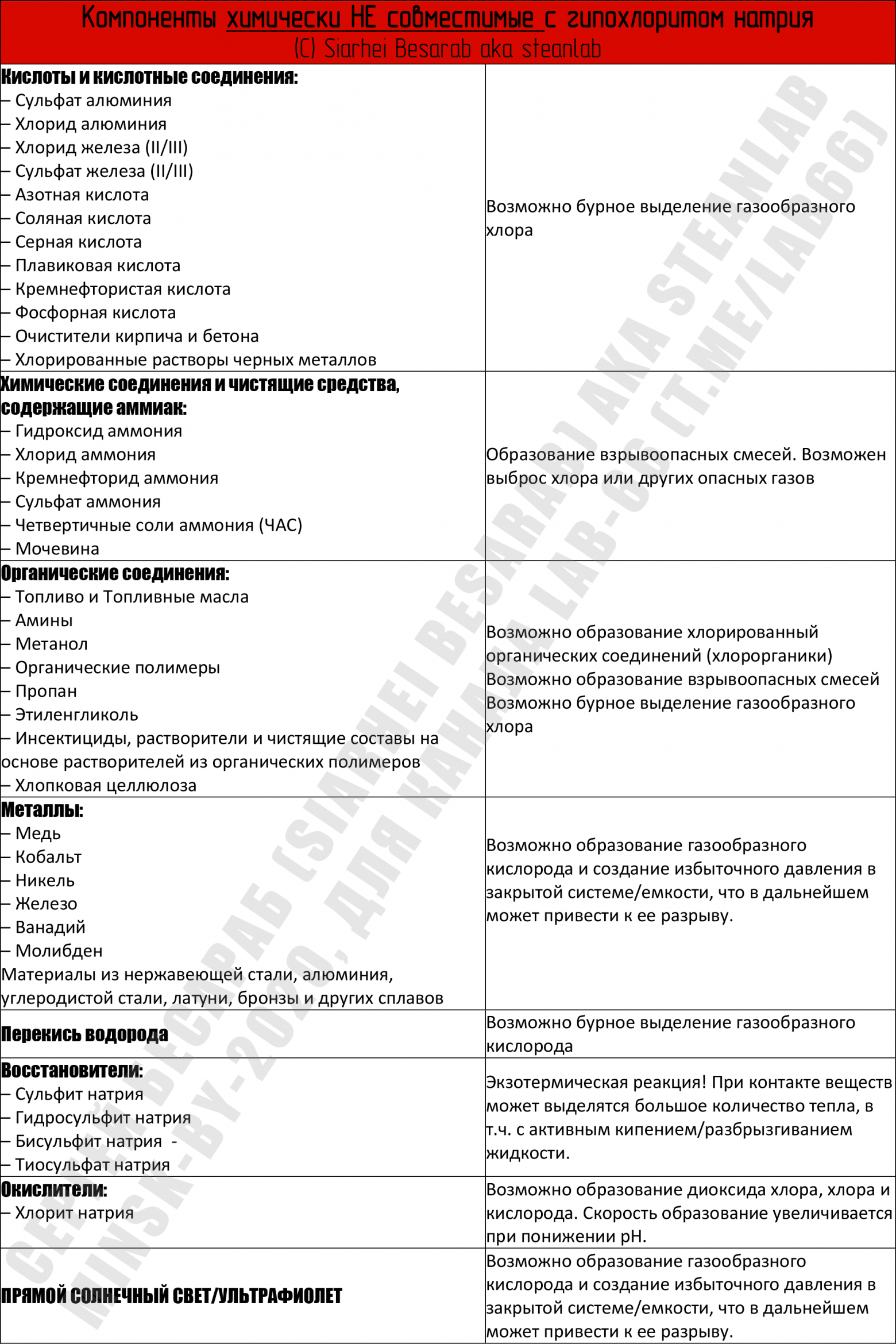
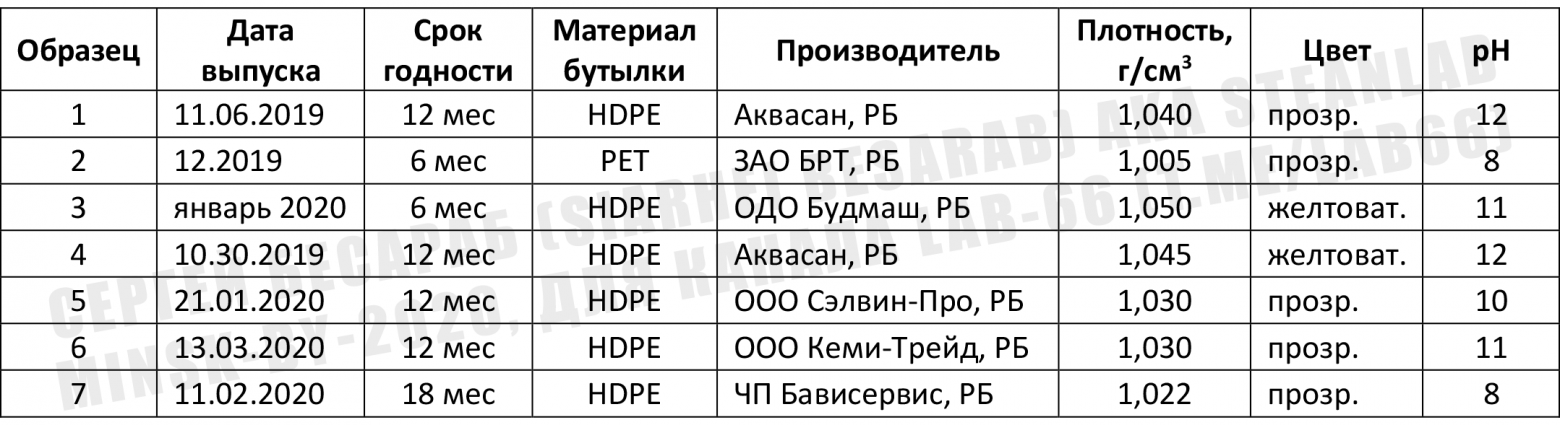
Взято отсюда, буква S = совместимость удовлетворительная (satisfactory), буква U = совместимость неудовлетворительная (unsatisfactory). Табличка кликабельна. Техника безопасности при работе с гипохлоритомВ целом, типичный (=разбавленный) бытовой отбеливатель вроде белизны не опаснее воды (если с ним уважительно обращаться, бутылочку там подписывать, от детей прятать и т.п.). По статистике, в 2002 году в Великобритании было зафиксировано около 3300 несчастных случаев, связанных с гипохлоритом натрия. И абсолютное большинство из них — употребление дезинфектанта внутрь… Думаю, комментарии излишни. Что касается гипохлорита натрия «промышленной концентрации», т.е. такого которым очищают сточные воды, то он уже относится к суровому первому классу опасности (класс 1B-поражение кожи + класс 1-поражение глаз). Если расшифровать — при попадании на кожу и в глаза вызывает химические ожоги. Будет вызывать раздражение и при попадании на слизистые оболочки верхних дыхательных путей (при вдыхании). Отдельного упоминания заслуживает и такой камень преткновения, как «хлорка в воде бассейна». Как правило, концентрация гипохлорита натрия, присутствующая в плавательных бассейнах абсолютно не вредна для людей. Но! Но дело меняется, если в воде присутствует большое количество мочевины (смесь мочи и пота), и тут уж хлорноватистая кислота и мочевина вступают в реакцию с образованием ядреных хлораминов (о механизме образования — ниже). Именно хлорамины раздражают слизистые оболочки и дают т.н. «запах хлора». В нормальных бассейнах этого быть не должно (нормальный = тот, в котором меняют воду и работает вентиляция). Если же этого не происходит, то постоянное воздействие летучих хлораминов может даже привести к развитию атопической астмы (см. статью). Лечение при отравлении: Учитывая все выше сказанное, решил я прикрепить и небольшую «памятку для врача», чтобы случись что — все было под рукой. Описание действий на случай отравления гипохлоритом натрия. Оно, кстати, примерно такое же, как и в случае отравления щелочью (cкользкое ощущение отбеливателя на коже связано с омылением кожных масел и разрушением тканей). НО! Но это только для чистого гипохлорита натрия. В случае его комбинация с различными бытовыми химикатами — лечить возможно придется от отравления продуктами реакции (см. следующий пункт). Замечание про «запах хлора»: часто можно услышать от читателей вопрос «чем убрать этот неприятный запах хлора с рук/полумаски/предметов». В таком случае поможет тиосульфат натрия, притом для активного удаления запаха хватит и раствора с концентрацией около 5 мг/л (0,005%). Промываем этим раствором руки или __ (вписать нужное), а затем промываем водой с мылом. Если же тиосульфата найти не удалось, то остается только проверенный способ — «выветривание запаха со временем». Кстати, для нейтрализации разливов концентрированного гипохлорита натрия (будем считать что 5% и выше) можно также использоваться сульфит натрия, он работает по реакции: А можно, в случае очень небольшого количества гипохлорита, использовать и перекись водорода, но с осторожностью (!) ибо там выделяется кислород. Опасное соседство — НЕсовместимая бытовая химияПри контакте белизны с некоторыми бытовыми моющими средствами, содержащими ПАВы и различные отдушки могут образовываться летучие (!) хлорорганические соединения, вроде четыреххлористого углерода (CCl4) и хлороформа (CHCl3). Классы их опасности каждый может посмотреть сам. Например в статье исследователи показали, что при работе с некоторыми «хитрыми» средствами бытовой химии концентрации этих растворителей повышаются в 8–52 раза для хлороформа и в 1–1170 раз для четыреххлористого углерода выше допустимых соответственно. Самый низкий «выхлоп» летучей хлорорганики дает самый простой отбеливатель (читай «белизна»), а вот самый высокий — средства в форме «густой жидкости и геля» (типа всяких там Доместосов и иже с ними, которые и развести толком нельзя). Поэтому, на будущее, а) стоит всячески избегать «суперэффективных средств с новой формулой» (= дерьма, которое разработал менеджер, а не инженер) и придерживаться классической формулы «лучшая белизна = гипохлорит да вода». И б) использовать при уборке квартиры респираторы с угольным фильтром (=«для задерживания паров растворителей»). С перекисью водорода гипохлорит натрия реагирует достаточно бурно, с образованием хлорида натрия ( Гетерогенные реакции гипохлорита с металлами протекают достаточно медленно и дают в результате оксид металла (ну или гидроксид). На примере цинка: С различными комплексами металлов белизна реагирует не в пример быстрее. Как уже упоминалось, гипохлорит натрия не любит высокую температуру (выше 30°C), и при нагревании распадается на хлорат натрия и кислород (для 5% раствора температура разложения 40°C), если удастся нагреть до 70°С разложение может протекать со взрывом. В целом, гипохлорит высоких концентраций негорюч и взрывобезопасен. Но при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызывать возгорание. Вообще, такая реакционная способность — это одновременно и благо, т.к. вещество не может долго находится в неизменном состоянии в окружающей среде и быстро дезактивируется (=можно просто смыть в сточные воды). В качестве выводов — все написанное выше сведено в единую таблицу несовместимых компонентов (кликабельна). Некоторые из этих соединений можно найти в бытовых, автомобильных и промышленных химикалиях и смесях химикалий = средства для чистки окон, унитазов и поверхностей, обезжиривающие средства, антифризы, средства для очистки воды, химия для бань и бассейнов. Поэтому чаще смотрите на этикетку. Требуйте, чтобы на этикетке писали состав! Покупайте только то средство, где на этикетке есть максимальная информация о составе. Пора уже голосовать рублем за адекватное отношение к покупателю. Практикум или Вся Белизна МинскаПолностью разобравшись с теорией, теперь мы подходим к самому интересному. К лабораторным занятиям. Как и обещал читателям, я проехался по Минску и собрал все доступные варианты жидкого отбеливателя (именно жидкого, на гели и т.п. я даже не смотрел). Теперь же я хочу рассказать как я их сравнивал и «проверял на вшивость» (= подходят ли они для целей дезинфекции). Кстати, отмечу, что все описанные в статье методы вполне себе работоспособны в мирное время, для проверки качества воды в бассейнах или кранах. Если вдруг у кого-то возникнет желание сказать «вода плохая — воняет хлоркой» , то после прочтения статьи, надеюсь, это можно будет сделать без проблем. А нынче, нынче вода с хлоркой это благо во время пандемии… В общем, первым делом подбираем себе необходимые СИЗ (по желанию). Как я уже упоминал выше, для большинства задач (и прямых рук) достаточно перчаток. Не зная что в бутылках за смеси, я решил перестраховаться и использовать полный комплект защиты (только со своей полумаски 3М 7502 «коронавирусные» противоаэрозольники 6035 я заменил на угольные патроны класса «газы/пары» — типа ABE1, как в моем случае, или лучше ABEK1. Пойдут и отечественные противогазные коробки и респираторы для работы с парами растворителей. С предварительными приготовлениями разобрались, и теперь я представляю вашему вниманию всю Белизну Минска! Встречайте беларуских красавиц! Это, кстати, все что удалось найти в гипермаркетах города-героя. Первым делом я оценил внешний вид, т.е. цвет и консистенцию предлагаемых растворов. Хотя ожидать здесь чего-то экстраординарного не приходится (т.к. по условиям задачи — никаких гелей и прочего «химо-фарша», максимальная простота). Потом измерил их плотность (кликабельно) + рН, он же водородный показатель. Плотность измеряем вот такими советскими ареометрами да стеклянным цилиндриком А рН, рН — уж чем бог пошлет (вплоть до индикаторных бумажек, но учитывайте что краситель в бумажках будет моментально «выгорать» и обесцвечиваться). В моем же дорожном чемоданчике случайно завалялись рН-метры Hanna: В результате получилась вот такая сводная таблица с данными (кое-что пришлось переписать с этикеток): Отдельно напишу состав (т.е. то, что там есть еще КРОМЕ гипохлорита натрия, это важно, особенно учитывая всякие хлорамины и летучую хлорорганику, о которых я писал выше). Стиль написания сохранен, чтобы читатель понимал, кто пишет инструкции. образец 1. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь В отечественном методе используется серная кислота и реакция: В американском методе используется уксусная кислота и реакция: В принципе, разницы по которой работать я лично не вижу, здесь играет роль доступность реагентов, я использовал ГОСТ-скую, т.к. серная кислота не так воняет как уксусная. Метода ГОСТ Р 57568-2017 (упрощенная): Для работы нам нужны следующие компоненты: 1)Серная кислота 1н. Отмеряем 28,6 мл концентрированной серной кислоты (плотность = 1, 84 г/см3) и доводим до литра дистиллированной водой. 2)10 % раствор иодида калия Взвешиваем 10 грамм иодида калия и растворяем в 90 мл дистиллированной воды. Раствор применяется свежеприготовленный 3)Раствор тиосульфата натрия 0.1н Взвешиваем 25 г тиосульфата натрия (пентагидрата) и доводим дистиллированной водой до 1 л. Хранить в темной бутылке. 4)Раствор крахмала 1% Взвешиваем 1 г крахмала (кукурузного, картофельного и т.п., хоть картошку натирайте и заваривайте, но! но не забудьте профильтровать 🙂 ) и размешиваем с 10 мл дистиллированной воды. Затем кипятим в стакане 90 мл дистиллированной воды и когда закипела — вливаем наши 10 мл с крахмалом. Варим, перемешивая 2-3 минуты. Используем свежеприготовленным. Сама процедура проверки следующая. Отбираем образец гипохлорита объемом 10 мл, и доводим водой до 250 мл. Отбираем из этого объема 10 мл и переносим в стакан, в этот же стакан добавляем 10 мл раствора иодида калия и 20 мл серной кислоты. Хорошо перемешиваем и ставим в темноту на 5 минут. По прошествии 5 минут капаем по каплям (из калиброванной капельницы, а еще лучше бюретки) раствор тиосульфата натрия пока раствор красного цвета (из-за выделившегося иода) не станет прозрачным. Когда жидкость приобретет соломенный (светло-желтый) цвет — доливаем в стакан 2-3 мл крахмала, раствор синеет. Теперь потихоньку добавляем тиосульфат пока синий цвет не исчезнет. Какие могут быть нюансы, влияющие на результат определения? А вот следующие (советую их держать в уме).
Во время нашего титрования подсчитываем количество капель, которое пошло на нейтрализацию гипохлорита и рассчитываем массовую концентрацию активного хлора по формуле: Все реактивы, за исключением уксусной кислоты — готовятся по идентичному ГОСТ-овскому методу (п.2-п.4 основной методики). Уксусная кислота (=замена серной кислоты из п.1) для «титрования по американски» готовится растворением 500 мл ледяной уксусной кислоты в 500 мл воды.
В результате титрования моих образцов получилось следующее (в скобках концентрация гипохлорита, которая считается по формуле: концентрация гипохлорита (NaOCl) = концентрация хлора*1,05: образец 1. хлор 19.32 г/л = (NaOCl 20, 29 г/л) = 2,029 % раствор Т.е. если считать что крайняя «короноубойная» концентрация гипохлорита натрия = 0,5%, то выходит что растворы нужно разбавлять в: 4 раза (средство 1, средство 6), 4,4 раза (средство 5) 4,5 раза (средство 4), в 7 раз нужно разбавлять средство 3. Средство 7 разбавляем в 3 раза, а средство 2 — вообще разбавлять не нужно (вот вам и прозрачная тара). Напоследок — фото с победителем:
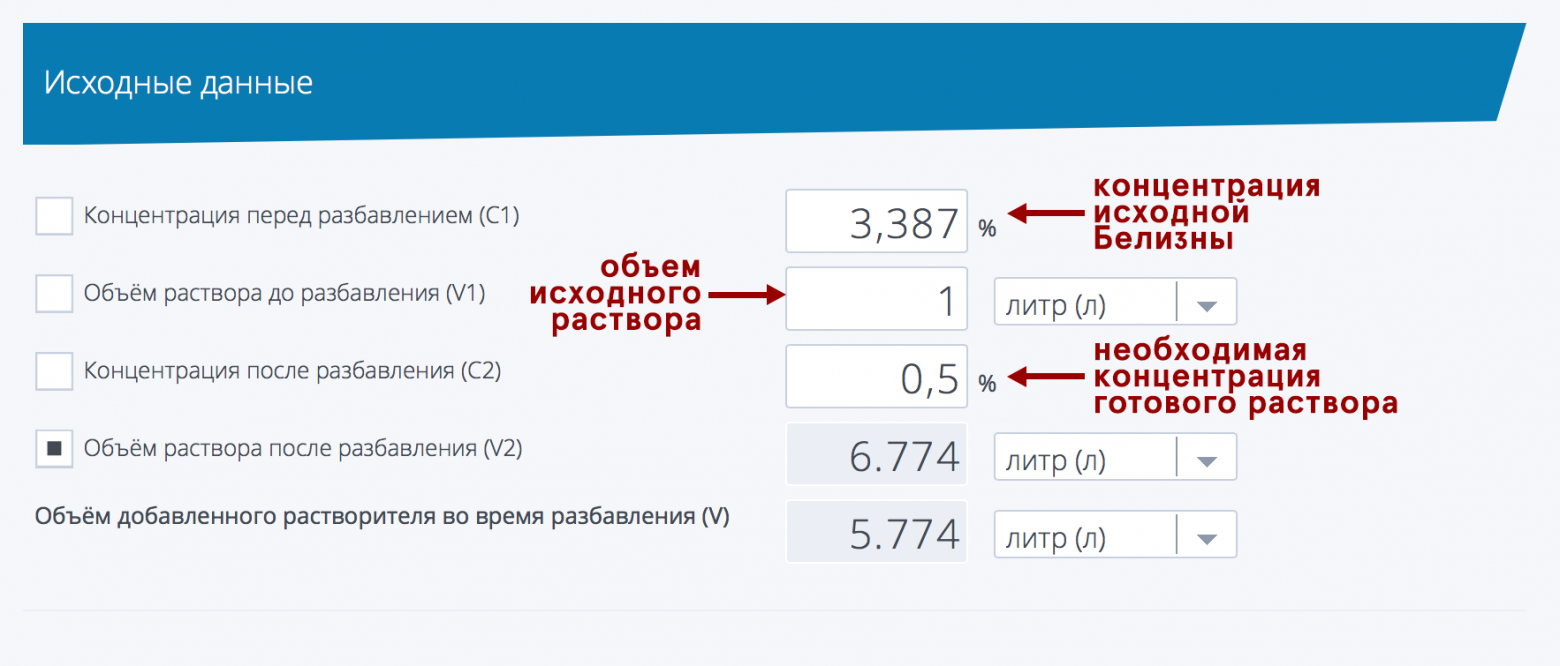
На закуску покажу как полученные экспериментальные данные коррелируют с писаниной на этикетке: образец 1. «гипохлорит натрия – 30% и более» = 2,029 % Кстати, допустим вы определились с необходимой для дезинфекции концентрацией, и с концентрацией купленной белизны, но… Но внезапно не знаете как развести ваше средство (фантастический, имхо, сценарий, но мало ли что, мы рождены ж чтоб сказку сделать былью). Для решения такой задачи вам понадобится пойти по ссылке «калькулятор разбавления растворов» и вписать туда нужные цифры. В качестве примера, возьмем нашего победителя, 1 литр белизны с концентрацией гипохлорита натрия 3,387 % от гомельского Будмаш и разведем до 0,5%, чтобы «помыть полы от коронавируса». Калькулятор нам пишет — нужно добавить 5,774 литра воды («растворителя»). Как видите, ничего сложного. Обеззараживайтесь! 🙂 Краткие выводы
Disclaimer: вся информация, изложенная в статье, предоставлена сугубо с информационными целями и не является прямым призывом к действию. Все манипуляции с химическими реактивами и оборудованием вы проводите на свой страх и риск. Автор не несет никакой ответственности за небрежное обращение с агрессивными растворами, безграмотность, отсутствие базовых школьных знаний и т.п. Если не чувствуете в себе уверенности понять написанное — попросите проконтролировать ваши действия родственника/друга/знакомого который имеет хотя бы какое-то техническое образование (=«в школе неплохо учился»). Постарайтесь использовать СИЗ и максимально соблюдать технику безопасности. И да, обязательно убирайте домашних животных во время обработки! И если сами не моете свои руки 0,5% гипохлоритом натрия, то не делайте это и для лап своей собаки! На этом все! Традиционно, предлагаю подписаться на мой научно-технический канал и подключаться к обсуждению! Фактически, в роли «научного грантодателя» для этой статьи выступают мои «меценаты» с Patreon. Благодаря им все и пишется. Поэтому и ответ они могут получить раньше всех других, и черновики увидеть, и даже предложить свою тему статьи. Так что, если интересно то, о чем я пишу и/или есть что сказать — поспешите стать моим «патроном» (картинка кликабельна):
Благодарю всех администраторов своего канала, которые провели (и проводят даже сейчас) огромную разьяснительную работу, с невероятной выдержкой, раз за разом объясняя людям какие СИЗ можно использовать, чем дезинфицировать, какой нужен спирт, даже какого размера вирион коронавируса. Ребята — S Sh, Воля, O! Пусть мы не заметны в этом информационном шуме — низкий вам поклон от steanlab. Хотя бы со страниц хабра! В это тяжелое время —Vivat комьюнити LAB-66! Благодарю всех читателей, которые поддерживают наш канал своими донатами! Без вас ничего бы не вышло. Надеюсь я не слишком затянул с написанием, и правильную Белизну еще можно будет найти в магазинах. Важно! Если информация из статьи пригодилась вам в жизни, то еще не поздно:
источники: http://2018.wwtec.ru/index.php?id=410 http://habr.com/ru/post/494512/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||