Глутаминовая кислота окисление кислородом уравнение
Глутаминовая кислота (глютаминовая кислота, глутамат) – заменимая аминокислота, в плазме крови вместе со своим амидом (глутамином) составляет около 1/3 всех свободных аминокислот.
Глутаминовая кислота входит в состав белков и ряда важных низкомолекулярных соединений. Она является составной частью фолиевой кислоты.
Название кислоты произошло от сырья, из которого она была впервые выделена – клейковина пшеницы.
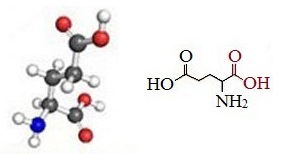
Глутаминовая кислота — 2-аминопентандиовая или α-аминоглутаровая кислота.
Глутаминовая кислота (Глу, Glu, E) является одной из важнейших аминокислот растительных и животных белков, молекулярная формула — C5H9NO4.
Глутаминовая кислота впервые была выделена из эндосперма пшеницы в 1866 г. Ритгаузеном, а в 1890 г. синтезирована Вольфом.
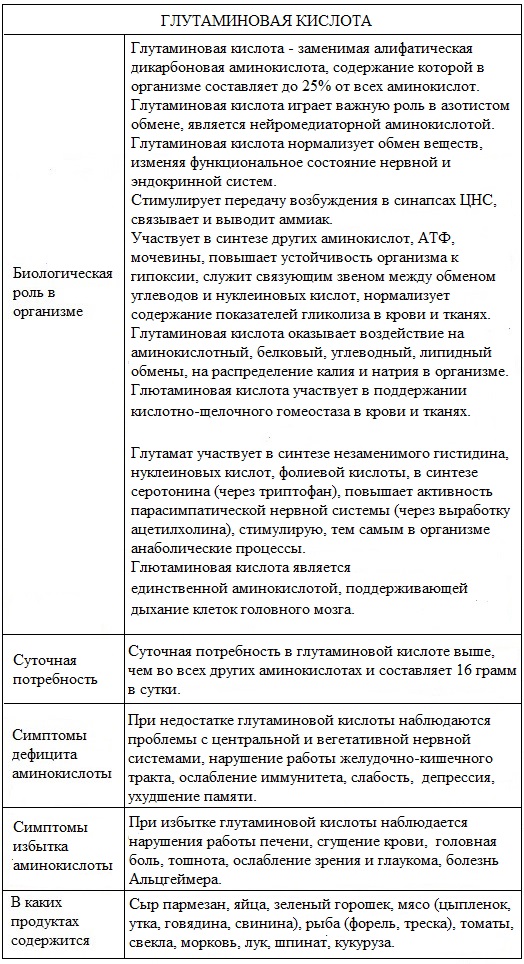
Суточная потребность в глутаминовой кислоте выше, чем во всех других аминокислотах и составляет 16 грамм в сутки.
Физические свойства
Глутаминовая кислота представляет собой растворимые в воде кристаллы с температурой плавления 202 0 С. Это кристаллическая масса коричневого цвета со специфическим кислым вкусом и специфическим запахом.
Глутаминовая кислота растворяется в разбавленных кислотах, щелочах и горячей воде, трудно растворяется в холодной воде и концентрированной соляной кислоте, практически не растворима в этиловом спирте, эфире и ацетоне.
Биологическая роль
Глутаминовая кислота играет важную роль в обмене веществ.
В значительном количестве эта кислота и ее амид содержатся в белках.
Глутаминовая кислота стимулирует окислительно-восстановительные процессы в головном мозге. Глутамат и аспартат содержится в мозге в высоких концентрациях.
Глутаминовая кислота нормализует обмен веществ, изменяя функциональное состояние нервной и эндокринной систем.
Стимулирует передачу возбуждения в синапсах ЦНС, связывает и выводит аммиак.
Находясь в центре азотистого обмена, глутаминовая кислота тесно связана с углеводным, энергетическим, жировым, минеральным и другими видами обмена веществ живого организма.
Участвует в синтезе других аминокислот, АТФ, мочевины, способствует переносу и поддержанию необходимой концентрации K + в мозге, повышает устойчивость организма к гипоксии, служит связующим звеном между обменом углеводов и нуклеиновых кислот, нормализует содержание показателей гликолиза в крови и тканях.
Глутаминовая кислота оказывает положительное влияние на дыхательную функцию крови, на транспорт кислорода и его использование в тканях.
Она регулирует липидный и холестериновый обмены.
Глутаминовая кислота играет важную роль не только в образовании вкусовых и ароматических свойств хлеба, но и оказывает влияние на деятельность основных представителей бродильной микрофлоры ржаных заквасок и теста – дрожжей и молочнокислых бактерий.
Обмен глутаминовой кислоты в организме
Свободная глутаминовая кислота содержится в различных органах и тканях в большом количестве по сравнению с другими аминокислотами.
Глутаминовая кислота участвует в пластическом обмене. Более 20% белкового азота представлено глутаминовой кислотой и ее амидом.
Она входит в состав фолиевой кислоты и глутатиона, участвует в обмене более 50% азота белковой молекулы.
При синтезе аспарагиновой кислоты, аланина, пролина, треонина, лизина и др. аминокислот используется не только азот глутамата, но и его углеродный скелет.
До 60% углерода глутаминовой кислоты может включаться в гликоген, 20-30% — в жирные кислоты.
Глутаминовая кислота и ее амид (глутамин) играют основную роль в обеспечении азотом метаболических превращений — синтеза заменимых аминокислот.
Участие глутаминовой кислоты в пластическом обмене тесно связано с ее детоксикационной функцией – она принимает на себя токсичный аммиак.
Участие глутаминовой кислоты в азотистом обмене может быть охарактеризовано как высокоактивная утилизация и обезвреживание аммиака.
Велика роль глутамата и глутамина в синтезе мочевины, так как оба ее азота могут быть поставлены этими соединениями.
Превращения глутаминовой кислоты регулируют состояние энергетического обмена митохондрий.
Влияние глутаминовой кислоты на обмен веществ
Глутаминовая кислота при введении ее в организм оказывает воздействие на процессы азотистого обмена. После инъекций глутамата натрия возрастает содержание аланина, глутамина, аспарагиновой кислоты в почках, мозгу, сердечной и скелетных мышцах.
Глутаминовая кислота обезвреживает аммиак, образующийся в организме в результате распада. Аммиак связывается с глутаминовой кислотой с образованием глутамина. Синтезированный в тканях глутамин поступает в кровь и переносится ее в печень, где используется для образования мочевины.
Обезвреживающее действие глутаминовой кислоты особенно выражено при повышенном содержании аммиака в крови тканях (при воздействии холода, перегреве, гипоксии, гипероксии, аммиачном отравлении).
Глутаминовая кислота способна связывать аммиак и стимулировать обмен веществ в печени, что дает возможность применять ее при печеночной недостаточности.
Глутаминовая кислота способна увеличивать синтез белка и РНК в печеночной ткани, стимулировать синтез белков и пептидов.
Глутаминовая кислота и ее амид играют существенную роль в синтезе белка:
— значительное содержание глутаминовой кислоты в белке;
— «сберегающий эффект» — предотвращение использования незаменимого азота для синтеза заменимых аминокислот;
— глутаминовая кислота легко превращается в заменимые аминокислоты, обеспечивает достаточный набор всех аминокислот, необходимых для биосинтеза белка.
Кроме анаболического действия глутаминовая кислота тесно связана с процессами метаболизма углеводов: до 60% углерода введеной глутаминовой кислоты обнаруживается в составе гликогена.
Глутаминовая кислота понижает уровень сахара в крови при гипергликемии.
Глутаминовая кислота препятствует накоплению в крови молочной и пировиноградной кислот, сохраняет на более высоком уровне содержание гликогена в печени и мышцах.
Под влиянием глутаминовой кислоты при гипоксии наблюдается нормализация содержания АТФ в клетках.
Углеродный скелет глутаминовой кислоты легко образует углеводы. Глутаминовая кислота не только сама включается в углеводные ресурсы тканей, но и значительно стимулирует окисление углеводов.
Наряду с метионином глутаминовая кислота способна предупреждать жировое перерождение печени, вызванное введением четыреххлористого углерода.
Глутаминовая кислота участвует в минеральном обмене, являясь регулятором обмена калия и связанного с ним метаболизма натрия
Из солей глутаминовой кислоты на распределение калия и натрия в крови и в тканях наибольшее влияние оказывает глутамат натрия. Он увеличивает содержание натрия в скелетных мышцах, сердце, почках, а также калия в сердце, печени и почках при одновременном снижении его уровня в плазме.
Глутаминовая кислота, легко и быстро проникая, через тканевые барьеры с большой скоростью подвергается окислению. Она оказывает воздействие на аминокислотный, белковый, углеводный, липидный обмены, на рапределение калия и натрия в организме.
Эффект воздействия глутаминовой кислоты более выражен при измененном состоянии организма, когда наблюдается дефицит самой кислоты или связанных с ней продуктов обмена веществ.
Влияние глутаминовой кислоты на энергетический обмен митохондрий
Введение глутамата стимулирует дыхание животных, улучшает дыхательную функцию крови, увеличивает напряжение кислорода в тканях.
В условиях кислородного голодания глутамат предотвращает уменьшение содержания гликогена и богатых энергией соединений в печени, мышцах, головном мозге и сердце животных и вызывает снижение уровня недоокисленных продуктов и молочной кислоты в крови и скелетных мышцах.
Влияние глутаминовой кислоты на функциональное состояние нейроэндокринной системы
Глутаминовая кислота может влиять на обмен веществ, функции органов и систем, не только включаясь в тканевые обменные процессы, но и через изменение функционального состояния нервной и эндокринной систем.
Участие нервной системы в механизме действия глутаминовой кислоты определяется особой ролью аминокислоты в обмене веществ головного мозга, так как именно в нервной ткани она наиболее широко вовлекается в разнообразные процессы.
В энергетическом обмене нервной системы глутаминовая кислота занимает центральное место, т.к. не только способна окисляться в мозге наравне с глюкозой, но также и введенная глюкоза в значительной мере превращается в глутаминовую кислоту и ее метаболиты.
Концентрация глутаминовой кислоты в мозге в 80 раз превышает ее концетрацию в крови. В функционально активных участках мозга по сравнению с другими концентрация глутаминовой кислоты в 3 раза больше.
Из всех отделов мозга наибольшее количество глутаминовой кислоты приходится на область двигательного анализатора. Так, уже через несколько минут после перорального или внутреннего введения глутаминовая кислота обнаруживается во всех отделах мозга и гипофизе.
Функцию центрального метаболита глутаминовая кислота выполняет не только в мозге, но и в переферических нервах.
Важное значение глутаминовой кислоты в деятельности нервной системы связано с ее способностью обезвреживать аммиак и образовывать глутамин.
Глутаминовая кислота способна увеличивать артериальное давление, повышать уровень сахара в крови, обеспечивать мобилизацию гликогена в печени и выводить больных из состояния гипогликемической комы.
При длительном приеме глутаминовая кислота стимулирует функции щитовидной железы, что проявляется на фоне дефицита йода и белка в питании.
Подобно нервной системе мышцы относятся к возбудимой ткани с большими нагрузками и резкими переходами от покоя к активности. Глутаминовая кислота увеличивает сократительную способность миокарда, матки. В связи с этим, глутаминовая кислота применяется как биостимулятор при слабости родовой деятельности.
Природные источники
Сыр пармезан, яйца, зеленый горошек, мясо (цыпленок, утка, говядина, свинина), рыба (форель, треска), томаты, свекла, морковь, лук, шпинат, кукуруза.
Области применения
Глутаминовая кислота и глутамин применяются в качестве кормовых и пищевых добавок, приправ, сырья для фармацевтической и парфюмерной промышленности.
В пищевой промышленности глутаминовая кислота и ее соли находят широкое применение в качестве вкусовой приправы, придающей продуктам и концентратам «мясной» запах и вкус, а также как источник легко усвояемого азота.
Мононатриевая соль глутаминовой кислоты – глутамат натрия – один из важнейших носителей вкусовых качеств, применяемых в пищевой промышленности.
В условиях стрессового энергетического дефицита показано дополнительное введение в организм глутаминовой кислоты, так как это нормализует азотистый обмен в организме и мобилизует все органы, ткани и организм в целом.
Применение глутаминовой кислоты как пищевой добавки
Еще с начала XX века на Востоке глутаминовая кислота используется как вкусовая добавка к пище и источника легко усвояемого азота. В Японии глутамат натрия – обязательная принадлежность стола.
Широкая популярность глутаминовой кислоты как пищевой добавки связана с ее способностью улучшать вкус продуктов. Глутамат натрия улучшает вкус мясной, рыбной или овощной пищи и восстанавливает ее натуральные вкусовые качества («глутаминовый эффект»).
Глутамат натрия усиливает вкус многих пищевых продуктов, а также способствует длительному сохранению вкусовых качеств консервированных продуктов. Это свойство позволяет его широко используют в консервной промышленности, особенно при консервировании овощей, рыбы, мясных продуктов.
Во многих зарубежных странах глутамат натрия добавляют практически во все продукты при консервировании, замораживании или просто при хранении. В Японии, СЩА и других странах глутамат натрия является такой же обязательной принадлежностью стола, как соль, перец, горчица и другие приправы.
Он повышает не только вкусовую ценность пищевых продуктов, но и стимулирует деятельность пищеварительных желез.
Глутамат натрия рекомендуется добавлять в продукты со слабовыраженным вкусом и ароматом: макароннеы изделия, соусы, мясные и рыбные блюда. Так, слабый мясной бульон после добавления в него 1,5-2.0 г глутамата натрия на порцию приобретает вкус крепкого бульона.
Глутамат натрия значительно улучшает также вкус отварной рыбы и рыбных бульонов.
Картофельное пюре становится ароматнее и вкуснее при добавлении в него глутамата натрия в количестве 3-4 г на 1 кг продукта.
При добавлении в офощные изделия глутамат натрия не придает им какого-либо нового вкуса, запаха или цвета, но зато резко усиливает собственный вкус и аромат продуктов, из которых приготавливают блюда, что отличает его от обычных приправ.
С фруктами, некоторыми молочными и зерновыми продуктами, а также очень жирными продуктами глутамат натрия не гармонирует.
В кислой среде действие глутамата натрия на вкус продуктов снижается, т.е. в кислые продукты или кулинарные изделия его необходимо прибавлять больше.
Применение глутаминовой кислоты как кормовой добавки сельскохозяйственных животных
Некоторые заменимые аминокислоты становятся незаменимыми, если они не поступают с пищей, а клетки не справляются с их быстрым синтезом.
Использование глутаминовой кислоты как кормовой добавки особенно эффективно на фоне малобелковой диеты и у растущих организмов, когда потребность в источниках азота возрастает. Под действием глутаминовой кислоты компенсируется дефицит азота.
По эффекту обогащения пищи белковым азотом к глутаминовой кислоте близок ее амид – глутамин.
Эффективность глутаминовой кислоты зависит от ее дозировки. Применение больших количеств глутаминовой кислоты оказывает токсическое действие на организм.
Применение глутаминовой кислоты в медицине
Глутамитновую кислоту широко используют в медицине.
Глутаминовая кислота способствует снижению содержания аммиака в крови и тканях при различных заболеваниях. Она стимулирует окислительные процессы при гипоксических состояниях, поэтому успешно применяют при сердечнососудистой и легочной недостаточности, недостаточности мозгового кровообращения и как профилактическое средство асфиксии плода при патологических родах.
Также глутаминовую кислоту используют при болезни Боткина, печеночной коме, циррозе печени.
В клинической практике применение этой кислоты вызывает улучшение состояния больных при инсулиновой гипокгликемии, судорогах, астенических состояниях.
В детской практике глутаминовую кислоту применяют при задержке психического развития, церебральных параличах, болезни Дауна, полиолимите.
Важной особенностью глутаминовой кислоты является ее защитное действие при различных отравлениях печени и почек, усиление фармакологического действия одних и ослабление токсичности других лекарственных средств.
Антитоксическое действие глутаминовой кислоты обнаружено при отравлении метиловым спиртом, сероуглеродом, окисью углерода, гидразином, четыреххлористым углеродом, нефтегазами, хлористым марганцем, фторидом натрия.
Глутаминовая кислота оказывает влияние на состояние нервных процессов, в связи с этим она широко применяется при лечении эпилепсии, психозов, при истощении, депрессии, олигофрении, черепно-мозговых травм новорожденных, нарушениях мозгового кровообращения, туберкулезном менингите, параличах, а также при заболеваниях мышц.
Глутамат повышает работоспособность и улучшает биохимические показатели при интенсивной мышечной работе и утомлении.
Глутаминовая кислота может быть использована при патологии щитовидной железы, в частности, при эндемическом зобе.
Глутаминовая кислота используется в сочетании с глицином для больных с прогрессирующей мышечной дистрофией, миопатией.
Глутаминовая кислота используется при лечении пневмоний у детей раннего возраста.
Глутаминовая кислота противопоказана при лихорадочных состояниях, повышенной возбудимости и бурно протекающих психотических реакциях.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Глутаминовая кислота окисление кислородом уравнениеПомимо общих путей обмена аминокислот, характерных для всех аминокислот, в настоящее время в животных тканях выяснены довольно подробно индивидуальные пути превращения почти всех аминокислот белковой молекулы. Некоторые из этих превращений, хотя и имеют в количественном отношении второстепенное значение, но образующиеся продукты реакции могут играть важную, а иногда и решающую роль в обмене веществ и в физиологических процессах организма. Ниже будет рассмотрен выборочно обмен тех аминокислот, специфические, так называемые частные пути превращения которых в организме человека и животных определяют во многих отношениях физиологическое состояние. Обмен глицина и серинаГлицин является уникальной аминокислотой белковой молекулы благодаря отсутствию асимметрического атома углерода. Тем не менее метаболически он связан с химическими компонентами организма в большей степени, чем любая другая аминокислота. Из схемы видно, что глицин в ряде синтезов выполняет уникальные функции, в частности в образовании белков, пуриновых нуклеотидов, гема гемоглобина, парных желчных кислот, креатина, глутатиона и т. д. Оксидаза L-аминокислот глицин не дезаминирует; в тканях открыт специфический флавопротеид — глициноксидаза, которая осуществляет эту реакцию: Глиоксиловая кислота, которая может образоваться также путем трансаминирования (обратимая реакция) с глутаминовой кислотой или глутамином, далее в тканях окисляется до щавелевой кислоты или муравьиной кислоты и СO2 по уравнению: СОН-СООН -> НСООН + СO2 Образовавшаяся муравьиная кислота подвергается далее восстановлению при участии НАДФН2 и тетрагидрофолиевой кислоты (ТГФ) в формильное производное ТГФ (N 5 , N 10 -СН2-ОН-ТГФ), которая служит донатором оксиметильной группы в реакциях взаимопревращения глицина и серина: Эту реакцию катализирует пиридоксалевый фермент -сериноксиметилаза. Показано также взаимопревращение глицина и треонина благодаря треонинальдолазной реакции: Ряд других уникальных функций глицина в образовании о-аминолевулиновой кислоты при синтезе порфиринов (гема) и пуриновых нуклеотидов будет освещен ниже (см. Обмен сложных белков). Поскольку серин легко превращается в пируват (см. выше) под действием сериндегидратазы, в тканях имеются условия для превращения глицина (через серин) в пируват и этим путем для участия глицина в углеводном обмена. Исключительна роль серина в биосинтезе сложных белков — фосфопротеидов, а также фосфолипидов. Помимо фосфатидилсерина, углеродный скелет и азот серина используются для образования фосфатидилэтаноламина и фосфатидилхолина (см. Обмен липидов). Обмен серосодержащих аминокислотВ белковой молекуле обнаружены три серосодержащие аминокислоты (метионин, цистеин и цистин), метаболически тесно связанные друг с другом. Благодаря наличию высокореактивной SH-группы в составе цистеина в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином: Дисульфидная связь часто образуется между двумя остатками цистеина внутри одной полипептидной цепи или между двумя полипептидами, способствуя тем самым стабилизации белковой молекулы. Цистеин является, кроме того, составной частью трипептида глутатиона (см. Химия белков), сокращенно обозначаемой SH-глутатион (или Г-SH), что подчеркивает функциональную значимость его тиогруппы и возможность образования дисульфидной связи: Как известно, некоторые ферменты содержат в активном центре SH-группы, абсолютно необходимые для каталитической реакции. При их окислении ферменты теряют свою активность. Предполагается, что одной из главных функций глутатиона является сохранение этих ферментов в активной восстановленной форме. Окисленный глутатион может вновь восстанавливаться под действием глутатионредуктазы, используя НАДФН2 и служить донатором водорода. С другой стороны, глутатион может оказывать ингибирующее действие на некоторые белки: в частности, известна реакция инактивации инсулина под действием глутатионинсулинтрансдегидрогеназы, в которой SH-глутатион является донатором водородных атомов, разрывающих дисульфидные связи между двумя полипептидными цепями молекулы инсулина. Показана коферментная функция глутатиона для дегидрогеназы фосфоглицериновой кислоты и глиоксалазы. Поскольку в процессе катаболизма сера метионина в тканях в основном переходит в серу цистеина и взаимопревращение цистина в цистеин легко осуществляется, проблема окисления серы всех аминокислот практически сводится к окислению цистеина. Главным путем оказался окислительный, включающий окисление цистеина в цистеинсульфиновую кислоту, трансаминирование последней с α-кетоглутаратом и образование пирувата и сульфита по схеме: Сульфит затем быстро окисляется в тканях и выводится с мочой в виде нетоксичных сульфатов и эфиросерных кислот. Об использовании цистеина и продуктов его окисления — цистеинсульфиновой и цистеиновой кислот — в образовании таурина было указано выше (см. Декарбоксилирование аминокислот ). Метионин вступает в печени в реакцию трансаминирования с α-кетоглутаратом и превращается в α-кето-β-метилтиомасляную кислоту. Однако этот путь обмена не является главным, а, как было указано выше, лежит через цистеин, поскольку меченая сера метионина включается в цистеин. Превращение метионина в цистеин оказалось необратимым процессом. Выяснилось также, что углеродный скелет цистеина имеет своим источником другую аминокислоту, а именно серин. Эти фактические данные, а также уникальное свойство донатора лабильных метильных групп подтвердили незаменимость метионина для животных и человека. Как оказалось позже, фактическим донатором метальных групп в реакциях трансметилирования является не свободный метионин, а так называемый активный метионин, точнее S-аденозилметионин, который образуется в процессе АТФ зависимой реакции: Своеобразие данной ферментативной реакции заключается з том, что все три фосфатных остатка АТФ соединяются в комплекс с ферментом в виде триметафосфата, который затем распадается на неорганический фосфат и пирофосфат и свободный фермент. Образовавшийся S-аденозилметионин используется далее в реакциях трансметилирования: при синтезе адреналина, тимина, креатина, N-метилникотинамида, фосфатидилхолина и др. В простейшем виде все эти реакции можно представить следующим общим уравнением: S-Аденозилметионин + Субстрат —> Аденозилгомоцистеин + Метилcубстрат В качестве примера ниже приводится биосинтез креатина. В образовании креатина принимают участие три аминокислоты: аргинин, глицин и метионин. Реакция синтеза протекает в две стадии. Первая стадия — образование гуанидинуксусной кислоты (гликоциамина) — осуществляется в почках при участии глицинтрансамидинaзы: Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы: Креатин подвергается фосфорилированию с образованием фосфокреатина, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой. Что касается судьбы гомоцистеина (деметилированного продукта метионина), то он может вновь превратиться в метионин путем метилирования. При этом донатором метильной группы служит N 5 -метил-ТГФ. Однако основной путь дальнейшего превращения гомоцистеина связан с его использованием в синтезе цистеина, который может быть представлен в виде двух последовательных ферментативных реакций: Ферменты, катализирующие синтез и распад цистатионина (цистатионинсинтаза и цистатионаза), оказались протеидами пиридоксальфосфата. Укажем также, что цистеин далее подвергается окислению по описанному выше пути, а гомосерин после трансаминирования с α-кетоглутаратом превращается в α-кетомасляную кислоту; последняя образуется, очевидно, из цистатионина непосредственно, минуя стадию гомосерина. Обмен фенилаланина и тирозинаФенилаланин относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтеза бензольного кольца его. В то же время тирозин полностью заменим при достаточном поступлении фенилаланина с пищей. Объясняется это тем, что основной путь превращения фенилаланина начинается с его окисления (точнее, гидроксилирования) в тирозин. Эта реакция гидроксилирования катализируется специфической фенилаланингидроксилазой, которая в качестве кофермента содержит, как все другие гидроксилазы, тетрагидробиоптерин. Блокирование этой реакции, наблюдаемое при нарушении синтеза фенилаланингидроксилазы в печени, приводит к развитию тяжелой наследственной болезни — фенилкетонурии. В процессе трансаминирования тирозин превращается в n-оксифенилпировиноградную кислоту, которая под действием специфической оксидазы подвергается окислению, декарбоксилированию, гидроксилированию и внутримолекулярному перемещению боковой цепи с образованием гомогентизиновой кислоты; эта реакция требует присутствия аскорбиновой кислоты, роль которой пока не ясна. Дальнейшее превращение гомогентизиновой кислоты в малеилацетоуксусную кислоту катализируется оксидазой гомогентизиновой кислоты. Малеилацетат под действием специфической изомеразы, требующей наличия глутатиона, превращается в фумарилацетоуксусную кислоту, подвергающуюся гидролизу с образованием фумаровой и ацетоуксусной кислот, дальнейшие превращения которых уже известны. Об использовании молекулы тирозина в биосинтезе гормонов щитовидной железы и катехоламинов было указано выше. Фенилаланин и тирозин являются предшественниками меланинов. В этом важном биологическом процессе, обеспечивающем пигментацию кожи, глаз, волос, активное участие принимает фермент тирозиназа. Обмен триптофанаТриптофан считается незаменимой для человека и животных аминокислотой, поскольку он является предшественником ряда важных биологически активных веществ, в частности серотонина (см. выше) и никотиновой кислоты; кроме того, углеродный скелет его не синтезируется в тканях животных. Показано, что один из его метаболитов, в частности индолилуксусная кислота, обладет ростстимулнрующей активностью в отношении растений (ростовой фактор). В нормальных физиологических условиях более 95% триптофана окисляется по кинурениновому пути и не более 1% — по серотониновому. Серотонин в организме подвергается окислительному дезаминированию с образованием индолилуксусной кислоты, которая выделяется с мочой; содержание ее в моче резко повышено при поражении организма человека злокачественными карциномами, когда около 60% триптофана окисляется по серотониновому пути. Основной же путь обмена триптофана приводит к синтезу никотинамида, точнее НАД. Этот путь обеспечивает организм определенным, хотя и недостаточным, количеством витамина PP. Триптофан под действием гемсодержашего фермента триптофанпирролазы в присутствии молекулярного кислорода превращается в формилкинуренин, который распадается при участии формамидазы на муравьиную кислоту и кинуренин; последний окисляется в 3-оксикинуренин. Дальнейшие превращения 3-оксикинуренина связаны с пиридоксалевым ферментом — кинурениназой, которая гидролизует его на аланин и 3-оксиантраниловую кислоту. Последняя через ряд промежуточных продуктов, механизм образования которых до конца не раскрыт, превращается в хинолиновую кислоту, т. е. в непосредственный предшественник амида никотиновой кислоты. Обмен дикарбоновых аминокислотКлассическими работами советских ученых А. Е. Браунштейна и С. Р. Мардашева и американского биохимика Майстера доказана выдающаяся роль дикарбоновых аминокислот (глутаминовой и аспарагиновой кислоты и их амидов — глутамина и аспарагина) в интеграции азотистого обмена в организме. Система дикарбоновых аминокислот, к которой относят также соответствующие α-кетокислоты, теснейшим образом связана не только с азотистым метаболизмом в целом, но и с обменом липидов и углеводов (см. ниже). Выше было указано на особую роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, в дезаминировании и синтезе природных аминокислот (реакции трансдезаминирования и трансреаминирования) и в образовании конечных продуктов белкового обмена — синтезе мочевины. Аспарагиновая кислота принимает непосредственное участие в орнитиновом цикле мочевинообразования, в реакции трансаминирования, в биосинтезе углеводов (глюкогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. Обмен нуклеиновых кислот), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль N-ацетил-аспартата, содержащегося в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена. Глутаминовая кислота, являющаяся глюкогенной и, соответственно, заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо своей роли в связывании и транспорте аммиака, участвуя тем самым в обезвреживании аммиака и в регуляции кислотно-щелочного состояния, глутамин выполняет уникальные функции в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, аминосахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетилглутамина) у человека и человекообразных обезьян, а также в синтезе витамина фолиевой кислоты (птероилглутаминовая кислота). На схеме суммированы реакции синтеза ряда веществ, в которых амидный азот глутамина выполняет специфическую роль, незаменимую азотом других аминокислот. Глутамин, как и аспарагин, оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; глутамин и аспарагин не могли быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре ткани теряется способность клеток синтезировать эти амиды синтетазным или трансаминазным путем. Для глутамина (обнаруженного впервые в животных тканях Д. Л. Фердманом) и аспарагина (открытого в белках тканей животных С.Р. Мардашевым) были уже известны пути синтеза в растениях благодаря классическим исследованиям Д.Н. Прянишникова. Однако ферментные системы, катализирующие синтез этих амидов, были выделены из животных тканей и механизм их образования детально рассмотрен выше. Здесь же укажем, что глутамин и аспарагин в животных тканях подвергаются сочетанному трансаминированию и дезаминированию под влиянием специфических трансаминаз амидов (глутаминтрансаминазы и аспарагин-трансаминазы) и неспецифеской ω-амидазы (Майстер) в соответствии с уравнениями реакций: Видно, что в реакции переноса участвует α-аминогруппа аспарагина (а не амидная группа, как предполагалось раньше), в то время как амидная группа промежуточного соединения α-кетосукцинамовой кислоты освобождается в процессе гидролиза в виде аммиака. Поскольку трансаминирование — обратимый процесс, лимитирующими в синтезе аспарагина (и глутамина) факторами являются ω-амиды щавелевоуксусной и α-кетоглутаровой кислот, синтез которых в животных тканях не доказан. Глутаминовая кислота является одним из немногих соединений в дополнение к глюкозе, которые служат энергетическим материалом для ткани мозга. Выше было указано на высокую активность в ткани мозга глутаматдекарбоксилазы, которая превращает глутамат в γ-аминомасляную кислоту (ГАМК). Дальнейшее окисление ее включает трансаминирование с образованием полуальдегида янтарной кислоты, окисление в янтарную кислоту и, наконец, окисление через ЦТК. В обеих реакциях (декарбоксилировании глутамата и трансаминировании ГАМК) участвует пиридоксальфосфат, который оказался более прочно связанным с ГАМК-трансаминазой. Поскольку ГАМК оказывает тормозящий эффект на синаптическую передачу в ЦНС, судорожные явления, наблюдаемые при недостаточности витамина В6, могут быть связаны со снижением образования ГАМК в глутаматдекарбоксилазной реакции. У животных судороги могут быть вызваны также введением гидразида, который связывает альдегидную группу кофермента, или антивитаминов В6, в частности метоксипиридоксина. Так как ГАМК служит естественно встречающимся «транквилизатором», одним из путей повышения ее концентрации в ЦНС является введение веществ, оказывающих тормозящее действие на ГАМК-трансаминазу, которая устраняет ГАМК эффективно. В последние годы у бактерий и растений (но не в животных тканях) открыт совершенно новый путь синтеза глутаминовой кислоты из α-кетоглутаровой кислоты и глутамина, который является донатором аминогруппй. Реакцию катализирует глутаматсинтаза, требующая доставки энергии АТФ. Предполагается, что при синтезе глутаминовой кислоты главным является этот путь, а не путь синтеза через глутаматдегидрогеназу. В свете этих данных, очевидно, следует внести некоторые коррективы в наши представления о механизме синтеза аминокислот посредством трансреаминирования. С глутаминовой кислотой метаболически связаны также пролин и аргинин через полуальдегид глутаминовой кислоты, хотя следует указать, что аргинин относится к незаменимым аминокислотам, в особенности в молодом возрасте, когда его синтез из глутамата не может обеспечить потребности быстрого роста организма. Кроме того, основным путем метаболизма аргинина является путь синтеза мочевины. Более специфичен и необратим путь превращения гистидина (также частично заменимая для животных аминокислота) в глутаминовую кислоту. В этом превращении участвуют два хорошо изученных фермента — гистидинаммиаклиаза (гистидаза), катализирующая внутримолекулярное дезаминирование гистидина, и уроканиназа, которая катализирует разрыв имизадольного кольца уроканиновой кислоты с образованием имидазолилпропионовой кислоты; последняя через формиминоглутаминовую кислоту превращается в глутаминовую кислоту. О других путях гистидина (образование гистамина и окисление его под действием диаминоксидазы) и об использовании гистамина в синтезе карнозина и ансерина было сказано выше. источники: http://acetyl.ru/o/a51k2w5k.php http://bono-esse.ru/blizzard/A/Chimia/Bio_chinija/specputi_obmena_ak.html |