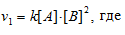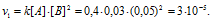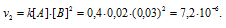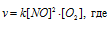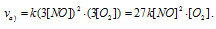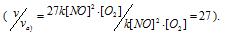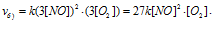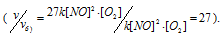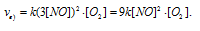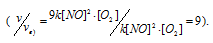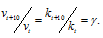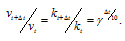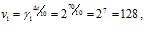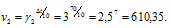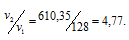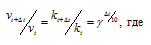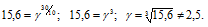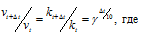Расчеты изменения скорости реакции
Задача 331.
Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,03 моль/л, [В]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v — скорость реакции, k — константа скорости реакции, [А] и [В] – концентрации исходных веществ.
Для нахождения скорости реакции по истечении некоторого времени учтём, что на образование 1 моля вещества С затрачивается 1 моль вещества А и 2 моля вещества В, поэтому при уменьшении концентрации вещества А на 0,01 моль/л, концентрация вещества В уменьшится соответственно на 0,02 моль/л (2 . 0.01 = 0,02). Тогда оставшиеся концентрации веществ будут равны [A]ост. = 0.03 – 0,01 = 0,02 моль/л, [B]ост. = 0,05 – 0,02 = 0,03моль/л. Тогда скорость реакции по истечении некоторого времени будет составлять:
Ответ: v1 = 3 . 10 -5 ; v2 = 7,2 . 10 -6 .
Задача 332.
Как изменится скорость реакции 2NO (г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию в 3 раза?
Решение:
До изменения объёма, давления и концентрации скорость реакции можно выразить уравнением:
а) Вследствие увеличения давления в системе в 3 раза, соответственно концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vа) , находим, что скорость реакции возрастает в 27 раз
б) при уменьшении объёма в 3 раза в системе концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vб), находим, что скорость реакции возрастает в 27 раз
в) При увеличении концентрации NO в 3 раза скорость реакции будет равна:
Cравнивая выражения v и vв), находим, что скорость реакции возрастает в 9 раз
Ответ: а) возрастёт в 27 раз; б) возрастёт в 27 раз; в) возрастёт в 9 раз.
Задача 333.
Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй 2,5. Найти отношение скоростей этих реакций при 95°С.
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 
Поскольку 
Скорость второй реакции равна:
Найдём отношение этих скоростей:
Ответ:
Задача 334.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 

Ответ: 2,5.
Задача 335.
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 

Повышенный уровень сложности. 18.Температурный коэффициент скорости реакции равен 3
18.Температурный коэффициент скорости реакции равен 3. При повышении температуры на 30˚С скорость реакции возрастет в _________ раз.
19.Температурный коэффициент скорости реакции равен 2. При повышении температуры на 40˚С скорость реакции возрастет в _________ раз.
20.Температурный коэффициент скорости реакции равен 4. При понижении температуры на 20˚С скорость реакции уменьшится в _________ раз.
21.Температурный коэффициент скорости реакции равен 3. При понижении температуры на 40˚С скорость реакции уменьшится в _________ раз.
22.Температурный коэффициент реакции равен 2. Для возрастания скорости реакции в 8 раз температуру необходимо повысить на _________˚С.
23.Температурный коэффициент реакции равен 3. Для возрастания скорости реакции в 81 раз температуру необходимо повысить на _________˚С.
24.Температурный коэффициент реакции равен 4. Для уменьшения скорости реакции в 64 раза температуру необходимо понизить на _________˚С.
25.При температуре 40˚С реакция протекает за 25 сек, а при температуре 60˚С – за 4 сек. Температурный коэффициент реакции равен _________.(Запишите число с точностью до десятых.)
26.При температуре 40˚С реакция протекает за 4мин, а при температуре 20˚С – за 49 мин. Температурный коэффициент реакции равен _________.(Запишите число с точностью до десятых.)
27.Гомогенная реакция протекает по уравнению А + 2Б = АБ2. При одновременном увеличении концентрации веществ А и Б в 3 раза скорость реакции возрастет в _________ раз. (Запишите число с точностью до целых.)
28.Гетерогенная реакция протекает по уравнению А(тв) + 2Б(г) = АБ2(тв). При увеличении давления в 3 раза скорость реакции возрастет в _________ раз. (Запишите число с точностью до целых.)
Химическое равновесие
Базовый уровень сложности
1.Обратимой реакции соответствует уравнение
| 1) | FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl |
| 2) | 2K + 2H2O = 2KOH + H2↑ |
| 3) | 2Na + Cl2 = 2NaCl |
| 4) | Н2 + I2 = 2HI |
2.Обратимой реакции соответствует уравнение
| 1) | KOH + HBr = KBr + H2O |
| 2) | CO2 + C = 2CO |
| 3) | 2Mg + O2 = 2MgO |
| 4) | Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3 |
3.В системе
N2(г) + 3H2(г) 
смещению химического равновесия в сторону продуктов реакции будет способствовать
| 1) | введение катализатора |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации аммиака |
| 4) | повышение температуры |
4.В системе
2CO(г) 
смещению химического равновесия в сторону исходного вещества будет способствовать
| 1) | увеличение концентрации CO |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации СО2 |
| 4) | повышение температуры |
5.На смещение химического равновесия в системе
2SO2(г) + O2(г) 
не оказывает влияния
| 1) | введение катализатора |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации кислорода |
| 4) | повышение температуры |
6.На смещение химического равновесия в системе
СO(г) + Н2O(г) 
не оказывает влияния
| 1) | повышение концентрации СО2 |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации водорода |
| 4) | повышение температуры |
7.На смещение химического равновесия в системе
С2Н5ОН(ж) + СН3СООН(ж) 
не оказывает влияния
| 1) | увеличение концентрации этилацетата |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации этанола |
| 4) | повышение температуры |
8.Химическое равновесие в системе
Fe2O3(тв) + 3Н2(г) 
можно сместить в сторону продуктов реакции при
| 1) | добавлении Fe2O3 |
| 2) | уменьшении температуры |
| 3) | увеличении давления |
| 4) | увеличении температуры |
9.Химическое равновесие в системе
CO2(г) + C(тв) 
можно сместить в сторону продукта реакции при
| 1) | добавлении угля |
| 2) | увеличении концентрации СО |
| 3) | увеличении концентрации СО2 |
| 4) | увеличении давления |
10.Изменение давления не оказывает влияния на смещение равновесия в системе
| 1) | H2(г) + С2Н4(г)  С2H6(г) С2H6(г) |
| 2) | 2HCl(г)  H2(г) + Cl2(г) H2(г) + Cl2(г) |
| 3) | 2NH3(г)  N2(г) + 3H2(г) N2(г) + 3H2(г) |
| 4) | 2SO2(г) + O2(г)  2SO3(г) 2SO3(г) |
11.При одновременном увеличении температуры и понижении давления равновесие сместится вправо в cистеме
| 1) | H2(г) + S(г)  H2S(г) + Q H2S(г) + Q |
| 2) | H2(г) + Cl2(г)  2HCl(г) + Q 2HCl(г) + Q |
| 3) | 2NH3(г)  N2(г) + 3H2(г) – Q N2(г) + 3H2(г) – Q |
| 4) | N2(г) + O2(г)  2NO(г) – Q 2NO(г) – Q |
12.При одновременном увеличении температуры и увеличении давления равновесие сместится вправо в cистеме
| 1) | PCl5(г)  PCl3(г) + Cl2(г) – Q PCl3(г) + Cl2(г) – Q |
| 2) | СаO(тв) + СО2(г)  СаСО3(тв) + Q СаСО3(тв) + Q |
| 3) | 3О2(г)  2О3(г) – Q 2О3(г) – Q |
| 4) | 2СO(г)  CO2(г) + C(тв) + Q CO2(г) + C(тв) + Q |
13.Химическое равновесие в системе
2Н2О(г) 
можно сместить в сторону продуктов реакции при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
14.Химическое равновесие в системе
СаO(тв) + СО2(г) 
можно сместить в сторону продукта реакции при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
15.Химическое равновесие в системе
СО2(г) + Н2О(ж) 
можно сместить в сторону исходных веществ при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
16.Химическое равновесие в системе
С4Н8(г) + Н2 (г) 
можно сместить в сторону образования бутана при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
17.Химическое равновесие в системе
N2О4(г) 
можно сместить в сторону исходного вещества при одновременном
| 1) | увеличении температуры и уменьшении давления |
| 2) | уменьшении температуры и уменьшении давления |
| 3) | увеличении температуры и увеличении давления |
| 4) | уменьшении температуры и увеличении давления |
18.Для смещения равновесия в сторону продукта реакции в системе
СО(г) + 2Н2(г) 
| 1) | увеличить температуру и уменьшить концентрацию исходных веществ |
| 2) | уменьшить температуру и уменьшить давление |
| 3) | увеличить температуру и уменьшить концентрацию метанола |
| 4) | уменьшить температуру и увеличить давления |
19.Какие из приведенных утверждений верны?
А. В состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции.
Б. Введение катализатора влияет на смещение химического равновесия.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
20.Какие из приведенных утверждений верны?
А. В состоянии химического равновесия концентрация исходных веществ равна концентрации продуктов реакции.
Б. Введение катализатора не влияет на смещение химического равновесия.
Урок №75. Скорость химической реакции. Закон действующих масс
Образцы решений задач по теме «Скорость химической реакции»
Задача №1
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Задача №2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
По правилу Вант-Гоффа
υ=υ 0 ·γ (t2-t1)/10
По условию задачи требуется определить υ/υ 0 :
υ/υ 0 =2 (70-30)/10 = 2 4 = 16
Задача №3
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O 2 (г) = SO 2 (г)
Б) 2SO 2 (г) + O 2 (г) = 2SO 3 (ж)
Согласно закону действующих масс, который действует для газов и жидкостей:
υ = к 2 C 2 (SO 2 )·C (O 2 )
Задача №4
Как изменится скорость реакции:
S (тв) + O 2 (г) = SO 2 (г)
при увеличении давления в системе в 4 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О 2 ) = а, концентрация серы — твёрдого вещества не учитывается.
При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 4а / к 1 а = 4
Следовательно, при повышении давления в 4 раза, скорость данной реакции увеличится в 4 раза.
Задача №5
Как изменится скорость реакции:
2SО 2 (г) + O 2 (г) = 2SO 3 (г)
при увеличении давления в системе в 2 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO 2
С(SО 2 ) = а, концентрация кислорода C(O 2 ) = b.
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO 2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ ‘ = к 1 (2а) 2 ·2b = к 1 4а 2 ·2b= к 1 8а 2 ·b
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 8а 2 ·b / к 1 а 2 ·b =8
Следовательно, при повышении давления в 2 раза, скорость данной реакции увеличится в 8 раз.
Задача №6
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ 0 =∆C/∆τ 0 ,
При температуре 30 ºС скорость реакции равна υ=∆C/∆τ,
υ=∆C/60, ∆C= 60υ. Следовательно, 300υ 0 =60υ, а υ/υ 0 =300/60=5.
2) По правилу Вант Гоффа: υ = υ 0 γ ∆t/10 , υ/υ 0 = γ ∆t/10
3) Согласно рассуждениям (1) и (2), получим γ (20-10)/10 = γ=5
http://lektsii.org/9-49411.html
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/11-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D1%87%D0%B5%D1%82%D0%B2%D1%91%D1%80%D1%82%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-75-%D1%81%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD-%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D1%85-%D0%BC%D0%B0%D1%81%D1%81