Структура четыреххлористого углерода (CCl4), свойства, применение, токсичность
четыреххлористый углерод Это бесцветная жидкость со слегка сладковатым запахом, похожая на запах эфира и хлороформа. Его химическая формула является CCl4, и он представляет собой ковалентное и летучее соединение, пар которого имеет большую плотность, чем воздух; Это не способствует электричеству и не является легковоспламеняющимся.
Это найдено в атмосфере, воде рек, моря и отложений морской поверхности. Считается, что четыреххлористый углерод, присутствующий в красных водорослях, синтезируется тем же организмом.
В атмосфере это произведено реакцией хлора и метана. Промышленно произведенный четыреххлористый углерод поступает в океан, главным образом, через поверхность раздела море-воздух. Было подсчитано, что его атмосферный поток => океанический составляет 1,4 х 10 10 г / год, что эквивалентно 30% от общего количества четыреххлористого углерода в атмосфере.
- 1 Основные характеристики
- 2 Структура
- 3 Физические и химические свойства
- 4 использования
- 4.1 Химическое производство
- 4.2 Производство хладагентов
- 4.3 Подавление огня
- 4.4 Очистка
- 4.5 Химический анализ
- 4.6 Инфракрасная спектроскопия и ядерный магнитный резонанс
- 4.7 Растворитель
- 4.8 Другое использование
- 5 Токсичность
- 5.1 Гепатотоксические механизмы
- 5.2 Токсическое воздействие на почечную систему и центральную нервную систему
- 5.3 Влияние воздействия на человека
- 5.4 Токсичные взаимодействия
- 6 Межмолекулярные взаимодействия
- 7 ссылок
Основные характеристики
Четыреххлористый углерод получают в промышленности путем термического хлорирования метана, причем метан реагирует с газообразным хлором при температуре от 400 до 430 ° С. Во время реакции образуется сырой продукт с побочным продуктом соляной кислоты..
Это также произведено в промышленности методом сероуглерода. Хлор и сероуглерод реагируют при температуре от 90 до 100 ° С с использованием железа в качестве катализатора. Затем сырой продукт подвергают фракционированию, нейтрализации и перегонке.
ККл4 имел многократное использование, среди прочего: растворитель жиров, масел, лаков и т.д .; химчистка одежды; пестицид, в сельскохозяйственной и фунгицидной фумигации и производстве нейлона. Однако, несмотря на большую полезность, его использование было частично исключено из-за высокой токсичности.
У людей он оказывает токсическое воздействие на кожу, глаза и дыхательные пути. Но его наиболее вредные последствия проявляются в функционировании центральной нервной системы, печени и почек. Повреждение почек, возможно, является основной причиной смертности, связанной с токсическим действием четыреххлористого углерода..
структура
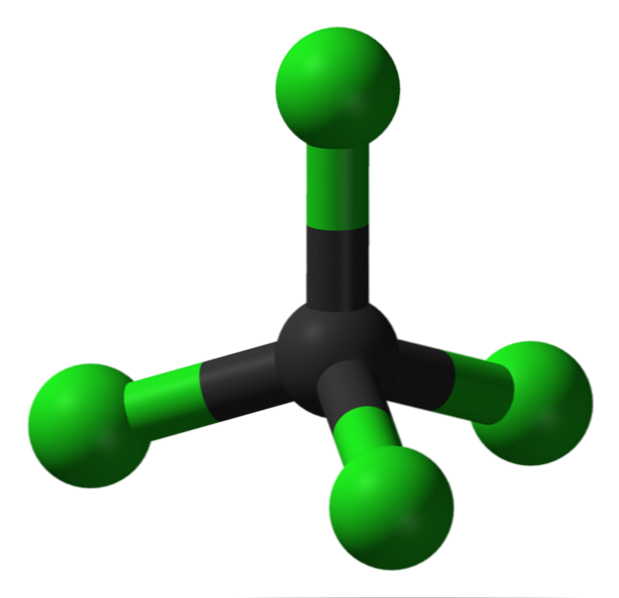
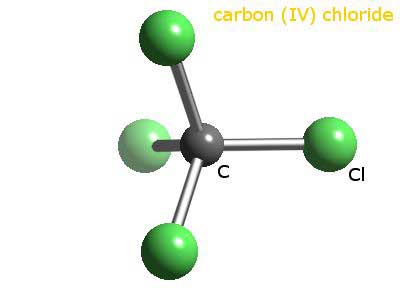
На изображении вы можете увидеть структуру четыреххлористого углерода, которая имеет тетраэдрическую геометрию. Обратите внимание, что атомы Cl (зеленые сферы) ориентированы в пространстве вокруг углерода (черная сфера) путем рисования тетраэдра.
Кроме того, стоит отметить, что, поскольку все вершины тетраэдра идентичны, структура является симметричной; то есть не имеет значения, как вращается молекула CCl4, Это всегда будет одним и тем же. Тогда, так как зеленый тетраэдр CCl4 симметричен, как следствие отсутствие постоянного дипольного момента.
Почему? Поскольку, хотя связи C-Cl являются полярными из-за большей электроотрицательности Cl по отношению к C, эти моменты отменяются векторно. Следовательно, это неполярное хлорированное органическое соединение.
Углерод полностью хлорируется в CCl4, что равно высокому окислению (углерод может образовывать максимум четыре связи с хлором). Этот растворитель не склонен терять электроны, он апротонный (в нем нет водорода) и представляет собой средство транспорта и небольшое хранение хлора..
Физико-химические свойства
формула
Молекулярный вес
Внешний вид
Это бесцветная жидкость. Кристаллизуется в виде моноклинных кристаллов.
запах
Представляет характерный запах, присутствующий в других хлорированных растворителях. Запах ароматный и несколько сладкий, похож на запах тетрахлорэтилена и хлороформа.
Точка кипения
От 170,1 ºF (76,8 ºC) до 760 мм рт..
Точка плавления
Растворимость в воде
Он плохо растворим в воде: 1,16 мг / мл при 25ºC и 0,8 мг / мл при 20ºC. Почему? Поскольку вода, высокополярная молекула, не «чувствует» сродство к четыреххлористому углероду, который является неполярным.
Растворимость в органических растворителях
Из-за симметрии своей молекулярной структуры четыреххлористый углерод является неполярным соединением. Поэтому он смешивается со спиртом, бензолом, хлороформом, эфиром, сероуглеродом, петролейным эфиром и нафтой. Кроме того, он растворим в этаноле и ацетоне.
плотность
В жидком состоянии: 1,59 г / мл при 68 ° F и 1,559 г / мл при 20 ° C.
В твердом состоянии: 1,831 г / мл при -186 ºC и 1,809 г / мл при -80 ºC.
стабильность
Коррозионное действие
Агрессивно в отношении некоторых форм пластмасс, каучуков и покрытий.
Точка зажигания
Считается, что он не очень легко воспламеняется, указывая на точку воспламенения менее 982 ºC..
Автоматическое зажигание
982 ° C (1800 ° F; 1255 К).
Плотность пара
5,32 по отношению к воздуху, взятых за эталонное значение, равное 1.
Давление пара
91 мм рт.ст. при 68 ° F; 113 мм рт.ст. при 77 ºF и 115 мм рт.ст. при 25 ºC.
разложение
При наличии огня образует хлорид и фосген, сильно токсичное соединение. Аналогично, в тех же условиях он разлагается на хлористый водород и окись углерода. В присутствии воды при высоких температурах это может вызвать соляную кислоту.
вязкость
2,03 х 10 -3 Па · с
Порог запаха
Показатель преломления (ηD)
приложений
Химическое производство
-Он действует как хлорирующий агент и / или растворитель при производстве органического хлора. Кроме того, он вмешивается в качестве мономера при производстве нейлона.
-Действует как растворитель при производстве резинового цемента, мыла и инсектицидов.
-Используется при производстве хлорфторуглеродного пропеллента.
-Не имея связей С-Н, четыреххлористый углерод не подвергается свободнорадикальным реакциям, поэтому он является полезным растворителем для галогенирования либо элементным галогеном, либо галогенирующим реагентом, таким как N-бромсукцинимид..
Производство хладагентов
Его использовали в производстве хлорфторуглерода, хладагента Р-11 и трихлорфторметана, хладагента Р-12. Эти хладагенты разрушают озоновый слой, поэтому они рекомендовали прекратить их использование в соответствии с рекомендациями Монреальского протокола..
Подавление огня
В начале 20-го века четыреххлористый углерод начал использоваться в качестве огнетушителя, основываясь на ряде свойств соединения: оно является летучим; его пары тяжелее воздуха; Это не электрический проводник, и он не очень огнеопасен.
При нагревании четыреххлористый углерод становится тяжелым паром, который покрывает продукты сгорания, изолируя их от кислорода, присутствующего в воздухе, и вызывая тушение пожара. Подходит для тушения нефтяных пожаров и техники.
Тем не менее, при температуре выше 500 ° C четыреххлористый углерод может вступать в реакцию с водой, вызывая фосген, токсичное соединение, поэтому следует обратить внимание на вентиляцию во время использования. Кроме того, он может вступать во взрывоопасную реакцию с металлическим натрием, избегая его использования при пожаре в присутствии этого металла..
уборка
Четыреххлористый углерод использовался для химической чистки одежды и других материалов для домашнего использования. Кроме того, он используется в качестве промышленного обезжиривателя металлов, отлично подходит для растворения жира и масла..
Химический анализ
Он используется для обнаружения бора, брома, хлорида, молибдена, вольфрама, ванадия, фосфора и серебра.
Инфракрасная спектроскопия и ядерный магнитный резонанс
-Он используется в качестве растворителя в инфракрасной спектроскопии, поскольку четыреххлористый углерод не обладает значительным поглощением в полосах> 1600 см. -1 .
-Он использовался в качестве растворителя в ядерном магнитном резонансе, поскольку он не мешал технике, потому что он не обладал водородом (он апротонный). Но из-за его токсичности и из-за низкой способности растворителя тетрахлорметан был заменен дейтерированными растворителями..
разбавитель
Характеристика неполярного соединения позволяет использовать четыреххлористый углерод в качестве растворителя для масел, жиров, лаков, лаков, резиновых восков и смол. Это также может растворить йод.
Другое использование
-Это важный компонент в лавовых лампах, так как из-за его плотности четыреххлористый углерод добавляет вес воску.
-Используется коллекционерами марок, так как выявляет водяные знаки на марках, не причиняя ущерба.
-Он использовался в качестве пестицида, фунгицида и при опрыскивании зерна для уничтожения насекомых..
-В процессе резки металла он используется в качестве смазки.
-Он использовался в ветеринарной медицине как антигельминт при лечении фасциолеза, вызванного Fasciola hepatica у овец..
токсичность
-Четыреххлористый углерод может всасываться через дыхательные, пищеварительные, глазные и кожные пути. Проглатывание и вдыхание очень опасны, потому что они могут вызвать долговременное серьезное повреждение мозга, печени и почек..
-Контакт с кожей вызывает раздражение и в долгосрочной перспективе может вызвать дерматит. При попадании в глаза вызывает раздражение.
Гепатотоксические механизмы
Основными механизмами, которые вызывают повреждение печени, являются окислительный стресс и нарушение гомеостаза кальция..
Окислительный стресс — это дисбаланс между выработкой активных форм кислорода и способностью организма генерировать в своих клетках восстановительную среду, которая контролирует окислительные процессы..
Дисбаланс в нормальном окислительно-восстановительном состоянии может вызвать токсические эффекты при производстве пероксидов и свободных радикалов, которые повреждают все компоненты клеток.
Четыреххлористый углерод метаболизируется с образованием свободных радикалов: Cl3С . (радикал трихлорметил) и Cl3COO . (радикал трихлорметилпероксид). Эти свободные радикалы вызывают липопероксидацию, которая вызывает повреждение печени, а также легких..
Свободные радикалы также вызывают разрыв плазматической мембраны клеток печени. Это приводит к увеличению цитозольной концентрации кальция и снижению внутриклеточного механизма секвестрации кальция..
Внутриклеточное увеличение кальция активирует фермент фосфолипазу А2 который действует на фосфолипиды мембраны, усугубляя ее воздействие. Кроме того, наблюдается инфильтрация нейтрофилов и гепатоцеллюлярная травма. Наблюдается снижение концентрации АТФ и глутатиона в клетках, что вызывает ферментативную инактивацию и гибель клеток..
Токсические эффекты в почечной системе и центральной нервной системе
Токсическое воздействие четыреххлористого углерода проявляется в почечной системе с уменьшением выработки мочи и накоплением воды в организме. Особенно в легких и увеличение концентрации метаболических отходов в крови. Это может привести к смерти.
На уровне центральной нервной системы происходит вовлечение аксональной проводимости нервных импульсов.
Эффекты воздействия на человека
Короткая продолжительность
Раздражение глаз; воздействие на печень, почки и центральную нервную систему, может привести к потере сознания.
Большая продолжительность
Дерматит и возможное канцерогенное действие.
Токсичные взаимодействия
Существует связь между многими случаями интоксикации четыреххлористым углеродом и употреблением алкоголя. Чрезмерное употребление алкоголя вызывает повреждение печени, в некоторых случаях вызывая цирроз печени..
Было замечено, что токсичность четыреххлористого углерода увеличивается с барбитуратами, поскольку они имеют некоторые сходные токсические эффекты.
Например, на почечном уровне барбитураты уменьшают экскрецию мочи, это действие барбитуратов похоже на токсическое воздействие четыреххлористого углерода на функцию почек..
Межмолекулярные взаимодействия
ККл4 Это можно рассматривать как зеленый тетраэдр. Как это взаимодействует с другими?
Будучи неполярной молекулой, без постоянного дипольного момента, она не может взаимодействовать диполь-дипольными силами. Чтобы удерживать свои молекулы вместе в жидкости, атомы хлора (вершины тетраэдров) должны каким-то образом взаимодействовать друг с другом; и им это удается благодаря рассеивающим силам Лондона.
Электронные облака атомов Cl движутся и на короткие моменты генерируют богатые и бедные участки электронов; то есть они генерируют мгновенные диполи.
Обширная область электронов δ- вызывает поляризацию атома Cl соседней молекулы: Cl δ- δ+ Cl. Таким образом, два атома Cl могут удерживаться вместе в течение ограниченного времени.
Но, имея миллионы молекул CCl4, взаимодействия становятся достаточно эффективными для образования жидкости в нормальных условиях.
Кроме того, четыре Cl, ковалентно связанные с каждым C, значительно увеличивают количество этих взаимодействий; настолько, что он кипит при 76,8 ° С, высокой точке кипения.
Точка кипения CCl4 оно не может быть выше, потому что тетраэдры относительно малы по сравнению с другими неполярными соединениями (такими как ксилол, который кипит при 144ºC).
Углерод четыреххлористый
(Тетрахлорметан, Перхлорметан, Фреон-10,
Хладон-10, Техническая «тетра»)
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .CCl4
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 153,82
· Основной продукт, %. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 99,8
· Примеси (с идентификацией), % :
-массовая доля воды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,005
-массовая доля кислот в пересчете на хлорную кислоту . . . . . . . . . . . . . 0,002
-массовая доля хлорорганических примесей . . . . . . . . . . . . . . . . . . . . . . . . . 0,1
-массовая доля хлороформа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,04
· Агрегатное состояние. . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . жидкое
· Внешний вид.. . .. . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .бесцветная жидкость.
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . специфический
· Применение: в качестве хладоагентов, как невоспламеняющийся и негорючий растворитель смол, лаков, жиров, восков; как растворитель при проведении многих реакций.
· Плотность при 20 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . . .1595
· Температура кипения при давлении 101,3 кПа, °С. . . . . . . . . . . . . . . . . . . 76,7
· Температура плавления при давлении 101,3 кПа, °С. . . . . . . . . . минус 22,87
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 283,1
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4,56
· Теплота образования, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 100,4
· Коэффициент диффузии пара в воздухе, см 2 /с . . . . . . . . . . . . . . . . . . . . . 0,0754
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | минус 50,0т | минус 30,0т | минус 19,6 | минус 8,2 | 4,3 | 12,3 | 23,0 | 38,3 | 57,8 | 76,7 |
| Р, атм | |||||||||
| t | 76,7 | 102,0 | 141,7 | 178,0 | 222,0 | 251,2 | 276,0 | — | — |
· Растворимость в воде :. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . растворим.
· Реакционная способность:с водой, муравьиной кислотой, метанолом и др. жидкостями образует азеотропы. Растворяет разнообразные органические соединения. В обычных условиях химически инертен. Устойчив к действию света, воздуха, концентрированной серной кислоты и других реактивов. Выше 250°С на поверхности металлов разлагается, образуя фосген. В присутствии железа, алюминия реагирует с водой при обычной температуре. Трехфтористая сурьма и фтористая кислота превращают во фреон (хладон). Со спиртами в присутствии щелочей образует ортоугольные эфиры. При контакте с открытым пламенем или раскаленными поверхностями разлагается с выделением фосгена, оксида углерода и хлористого водорода.
· Регистрационный номер по CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .56-23-5
· Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
· ПДКм.р./с.с. в воздухе рабочей зоны, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . .20/10
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . .0906
· Класс опасности в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
· ПДКм.р./с.с. в атмосферном воздухе, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4/0,7
· Воздействие на людей:обладает наркотическим действием, поражает центральную нервную систему, печень, почки, оказывает местное раздражающее действие на кожу рук, слизистые оболочки глаз, верхние дыхательные пути, обладает кумулятивными свойствами. В организм человека может поступать ингаляционным путем, через кожу, через органы пищеварения.
· Меры первой помощи пострадавшим от воздействия вещества:при остром ингаляционном отравлении – свежий воздух, покой. Длительное вдыхание увлажненного кислорода с использованием носовых катетеров. Сердечные средства. При приеме внутрь – тщательное промывание желудка через зонд. Для предупреждения поражения печени – покой, диета, введение глюкозы и витаминов. При развитии нефрозонефрита – горизонтальное положение, ограничение питья и белков. Эффективное обменное переливание крови.
· Меры предосторожности: производственные помещения должны быть оборудованы общей приточной и местной вытяжной вентиляцией. Оборудование и коммуникации должны быть герметизированы.
· Средства защиты:индивидуальные средства защиты (спецодежда, резиновые сапоги, перчатки, защитные очки, промышленный фильтр, противогаз).
· Методы перевода вещества в безвредное состояние:газовые выбросы на месте производства должны отсутствовать. Отходы утилизируют и обезвреживают: абгазные хлор и хлористый водород используют в производстве хлорированных углеводородов; жидкие хлорорганические продукты подвергают термическому обезвреживанию; технологические сточные воды отпаривают от органических примесей и направляют в коллектор щелочных стоков предприятий.
· Группа горючести. . . . . . . . . . . . . . . .негорючая, пожаробезопасная жидкость
· Средства пожаротушения:пары оказывают флегматизирующее действие на горение многих органических веществ. При термическом распаде в присутствии паров воды может образоваться фосген, поэтому как огнетушащее средство не применяют.
Углерода оксид
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . СО
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..28,01
· Агрегатное состояние. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . газообразное
· Внешний вид. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .бесцветный газ
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . без запаха.
· Применение: как одно из исходных соединений, лежащих в основе современной промышленности органического синтеза. Используют для восстановления металлов из окислов, для получения карбонилов металлов, фосгена, сероокиси углерода, хлористого алюминия, метилового спирта, формамида, ароматических альдегидов, муравьиной кислоты и др.
· Плотность при 0 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . . . 1,250
· Плотность при 20 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . . 1,165
· Температура кипения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 192
· Температура плавления при давлении 101,3 кПа, °С . . . . . . . . . . . .минус 205
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 138,7
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3,5
· Теплота сгорания, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 283
· Удельная теплота сгорания, кДж/моль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10107
· Теплота образования, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 110,5
· Теплоемкость газа при 0°С и
постоянном давлении, кДж/(кг×град) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1,0416
· Теплоемкость газа при 0°С и постоянном объеме, кДж/(кг×град) . . . .0,7434
· Динамическая вязкость, Н×с/м 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 166,04×10 7
· Кинематическая вязкость, м 2 /с . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13,55×10 6
· Коэффициент теплопроводности газа
при 0°С и давлении 101,3 кПа, Вт/(м×К) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,0233
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | минус 222,0т* | минус 217,2т | минус 215,0т | минус 212,8т | минус 210,0т | минус 208,1т | минус 205,7т | минус 201,3 | минус 196,3 | минус 191,3 |
| Р, атм | |||||||||
| t | минус 191,3 | минус 183,5 | минус 170,7 | минус 161,0 | минус 149,7 | минус 141,9 | — | — | — |
*т — твердое вещество;
· Растворимость в воде: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . растворим
· Реакционная способность:сравнительно хорошо растворяется, особенно под давлением, в растворах дихлорметана (СН2Cl2), гидрооксида аммония, соляной кислоте. При низких температурах оксид углерода достаточно инертен; при высоких – легко вступает в различные реакции, в особенности, в реакции присоединения. Обладает восстановительными свойствами. Окисляется в СО2 при комнатной температуре.
· Регистрационный номер по CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 630-08-0
· ПДКм.р. в воздухе рабочей зоны, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20*
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . .0337
· Класс опасности в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
· ПДКм.р./с.с. в атмосферном воздухе, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5/3
* —При длительности работы в атмосфере, содержащей оксид углерода не более 1ч ПДК оксида углерода может быть повышена до 50 мг/м 3 , при длительности работы не более 30 мин. – до 100 мг/м 3 , при длительности работ не более 15 мин. – 200 мг/м 3 . Повторные работы при условиях повышенного содержания оксида углерода в воздухе рабочей зоны могут проводиться с перерывом не менее, чем в 2ч.
· Воздействие на людей: ядовитое вещество, относится к веществам с остронаправленным механизмом действия, требующим автоматического контроля за его содержанием в воздухе. Токсическое действие на центральную нервную систему.
· Меры первой помощи пострадавшим от воздействия вещества:свежий воздух, освободить от стесняющей дыхание одежды, покой, согревание. Отравления тяжелой и средней степени лечат в стационаре.
· Меры предосторожности: обязательны местные вытяжные устройства и общая вентиляция помещений. Герметизация аппаратуры и коммуникаций. Постоянный контроль за концентрацией в воздухе рабочей зоны, использование автоматических приборов и сигнализационных устройств.
· Средства защиты:. . . . . . . . . . . . . . . . . . . . . . . . . . . фильтрующий противогаз.
· Группа горючести. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . горючий газ (ГГ)
· Температура самовоспламенения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 605
· Концентрационные пределы распространения пламени, % (об.) . . 12,5-74
· Минимальное взрывоопасное содержание кислорода, % (об.)
при разбавлении:
азотом . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5,6
диоксидом углерода . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5,9
· Максимальное давление взрыва, кПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 730
· Безопасный экспериментальный максимальный зазор, мм . . . . . . . . . . 0,84
· Группа взрывоопасной смеси по ГОСТ Р 51330.5 . . . . . . . . . . . . . . . . . . . . . . . Т1
· Категория взрывоопасности смеси по ГОСТ Р 51330.11 . . . . . . . . . . . . . . . . .IIВ
· Средства пожаротушения: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . инертные газы.
Фенол
(гидроксибензол, карболовая кислота)
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . С6Н6О
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 94,11
· Агрегатное состояние. . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . твердое
· Внешний вид.. белое кристаллическое вещество (для марки В допускается розоватый или желтоватый оттенок).
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . характерный
· Примеси (с идентификацией), % :
| Марка А | Марка Б | Марка В | |
| Массовая доля нелетучего остатка, не более | 0,001 | 0,008 | 0,01 |
| Вода, не более | 0,03 | Не нормируют | |
| Сумма органических примесей, не более | 0,01 | Не нормируют | |
| Оксид мезетила, не более | 0,0015 | 0,004 | Не нормируют |
| Сумма a-метилстирола и изопропилбензола (кумола), не более | Не нормируют | 0,01 | Не нормируют |
· Применение: применяется в производстве капролактама, дифенилолпропана, медицинских препаратов, фенолоформальдегидных смол, ортокрезола, присадок к маслам, для селективной очистки масел.
· Плотность при 20°С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . .1057,6
· Плотность пара по воздуху . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3,2
· Температура кипения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 181,75
· Температура (кристаллизации) плавления, °С. . . . . . . . . . . . . . . . . . . . . . . . 43
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 419
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6,13
· Теплота сгорания, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 2992,3
· Удельная теплота сгорания, кДж/кг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32550
· Теплота образования, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 94,2
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | 40,1т* | 62,5 | 73,8 | 86,0 | 100,1 | 108,4 | 121,4 | 139,0 | 160,0 | 181,9 |
| Р, атм | |||||||||
| t | 181,9 | 208,0 | 248,2 | 283,8 | 328,7 | 358,0 | 382,0 | 400,0 | 418,7 |
*т – твердое вещество.
· Растворимость в воде при 15°С , % (масс.): . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8,2
· Реакционная способность: хорошо растворим в спирте, эфире, ацетоне, хлороформе. При действии щелочей образуются феноляты. При взаимодействии с бромом получается 2,4,6-трибромфенол, азотной кислотой – пикриновая кислота, серной кислотой – смесь о и n- фенолсульфокислот, реакцией с алкилгалогенидами, олефинами – алкилфенолы.
· Регистрационный номер по CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 108-95-2
· Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2
· ПДКм.р./с.с. в воздухе рабочей зоны, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . 1/0,3
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . 1071
· Класс опасности в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
· ПДКм.р./с.с.. в атмосферном воздухе, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . 0,01/0,003
· Воздействие на людей: при превышении ПДК возможны отравления, раздражение слизистых оболочек и ожог кожи. Острые отравления фенолом происходят главным образом при попадании его на кожу. При общем отравлении наблюдается повышение температуры, нарушение функций нервной системы и дыхания. При хроническом отравлении – раздражение дыхательных путей, расстройство пищеварения, тошнота, слабость, кожный зуд, конъюнктивит.
· Меры предосторожности: производственные помещения, в которых производятся работы с фенолом, должны быть оборудованы приточно-вытяжной вентиляцией; лаборатории – вытяжными шкафами.
При производстве фенола и работе с ним необходимо соблюдать требования пожарной безопасности и электростатической искробезопасности.
При изготовлении, использовании и хранении продукта применяют знак «Запрещается пользоваться открытым огнем».
· Средства защиты: следует применять средства индивидуальной защиты от попадания продукта на кожные покровы и слизистые оболочки. В аварийных случаях для защиты органов дыхания необходимо применять фильтрующий противогаз.
При очистке аппаратов, а также при работе в емкостях применяют шланговый противогаз и специальный защитный костюм.
· Меры первой помощи: при смачивании одежды фенолом – немедленное удаление пострадавшего из зоны поражения. Немедленная смена одежды. Обтирание пораженных мест 10-40 % этиловым спиртом или растительными маслами. Обмывание всего тела водой с мылом (теплый душ). По показаниям: покой, согревание, ингаляции кислорода, искусственное дыхание, кофеин, камфара, кордиамин, внутривенно глюкоза (40% на физиологическом растворе), 30% раствор тиосульфата натрия (8-10 мл). В случае раздражения слизистых оболочек верхних дыхательных путей щелочные ингаляции. При отравлении через рот дать выпить несколько стаканов теплой воды или взвеси жженой магнезии в воде (20:200), вызвать рвоту (можно ввести под кожу 0,5-0,8 мл 1% раствора апоморфина). При необходимости – промывание желудка либо теплой водой с активированным углем, либо взвесью жженой магнезии, либо раствором сернокислого натрия до исчезновения запаха фенола. Позже принимать касторовое масло, яичный белок, слизистые отвары; глотать кусочки чистого льда.
· Методы перевода вещества в безвредное состояние: фенол, разлитый на небольшой пощади, необходимо засыпать песком. Загрязненный песок собрать совком, изготовленным из материала, исключающего искрообразование, в плотно закрывающуюся емкость и транспортировать в специально отведенное место для прокаливания.
Фенол, разлитый на значительной площади, необходимо собрать в плотнозакрывающуюся емкость и направить в специально отведенное место для уничтожения путем сжигания после разбавления его легковоспламеняющейся жидкостью.
Для сжигания продукта и прокаливания песка использовать печь любой марки для сжигания химических отходов, снабженную устройством для очистки дымовых газов.
· Группа горючести. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . горючее вещество
· Температура вспышки, °С
закрытый тигель . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 79
открытый тигель. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85
· Температура самовоспламенения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 595
· Концентрационные пределы распространения пламени, % (об.). . 1,5-8,8
· Температурные пределы распространения пламени, °С . . . . . . . . . . . . 48-83
· Группа взрывоопасной смеси по ГОСТ Р 51330.5 . . . . . . . . . . . . . . . . . . . . . . . Т1
· Категория взрывоопасности смеси по ГОСТ Р 51330.11 . . . . . . . . . . . . . . . . IIA
· Средства пожаротушения: вода в виде компактных или распыленных струй.
Формальдегид
(метаналь, муравьиный альдегид, оксометан)
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . СН2О
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30,03
· Агрегатное состояние. . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . газообразное
· Внешний вид.. . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . бесцветный газ
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . резкий, раздражающий
· Применение: для получения изопрена, для синтеза пропаргилового спирта; для синтеза лекарственных веществ и красителей, для дубления кожи, как дезинфицирующее, антисептическое средство (35-40% водный раствор формальдегида называется формалином или формолем).
· Плотность, отнесенная к плотности воды при 4°
при температуре минус 20°С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,8153
при температуре минус 80°С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,9151
· Плотность газа по воздуху . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1,03
· Температура кипения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 19,5
· Температура плавления, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 118
· Теплота сгорания, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 570,78
· Удельная теплота сгорания, кДж/кг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19007
· Теплота образования, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 115,9
· Теплоемкость, ккал/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10,49
· Константы уравнения Антуана в температурном интервале
Минус 19 – 60 °С
А . . . . . . . . . . . . . . . . . . . . . . 5,40973
В . . . . . . . . . . . . . . . . . . . . . . 607,399
С . . . . . . . . . . . . . . . . . . . . . . 197,626
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | т* | т | минус 88,0 | минус 79,6 | минус 70,6 | минус 65,0 | минус 57,9 | минус 46,0 | минус 33,0 | минус 19,5 |
*т– твердое вещество;
· Растворимость в воде: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .растворим.
· Реакционная способность: хорошо растворим в спиртах, умеренно – в бензоле, эфире, ацетоне, хлороформе, не растворим в петролейном эфире. Склонен к полимеризации. Очень реакционноспособен.; он сильный восстановитель: из растворов солей осаждает многие металлы, окисляясь при этом в муравьиную кислоту. С мочевиной в щелочной среде образует моно- и ди-метилольные производные. Из формальдегида и казеина производят галалит. С фенолами в присутствии кислот или оснований формальдегид конденсируется с конечным продуктом- фенолоформальдегидные смолы.
· Регистрационный номер по CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50-00-0
· Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
· ПДКм.р. в воздухе рабочей зоны, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,5
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . 1325
· Класс опасности в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
· ПДКм.р./с.с. в атмосферном воздухе, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . 0,035/0,003
· Воздействие на людей: вызывает раздражение слизистых оболочек глаз и верхних дыхательных путей. Токсичен.
· Средства защиты: фильтрующий промышленный противогаз, герметичные защитные очки. В условиях очень высоких концентраций – изолирующий шланговый или другие противогазы. Средство защиты рук.
· Меры первой помощи пострадавшим: при отравлении путем вдыхания вынести пострадавшего на свежий воздух. Затем вдыхание водяных паров с добавлением нескольких капель нашатырного спирта. По показаниям: ингаляция кислородом, сердечные стимуляторы, стимуляторы дыхания. При раздражении слизистых оболочек дыхательных путей – щелочные или масляные ингаляции. При болезненном кашле – кодеин, горчичники, банки. При раздражении глаз – обильное промывание водой или физиологическим раствором, холодные примочки, закапывание 1-2 капель 0,5% раствора новокаина. При отравление через рот – незамедлительное промывание желудка раствором бикарбоната натрия. При попадании на кожу – немедленное обмывание водой, лучше – 5% раствором нашатырного спирта.
· Меры предосторожности: герметизация процессов. Дистанционное управление в производстве. Механизация налива. Вентиляция помещений.
· Группа горючести. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . горючий газ (ГГ)
· Температура самовоспламенения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 430
· Концентрационные пределы распространения пламени, % (об.) . . . . . 7-73
· Безопасный экспериментальный максимальный зазор, мм . . . . . . . . . . 0,57
· Группа взрывоопасной смеси по ГОСТ Р 51330.5 . . . . . . . . . . . . . . . . . . . . . . . Т2
· Категория взрывоопасности смеси по ГОСТ Р 51330.11 . . . . . . . . . . . . . . . . .IIВ
· Средства пожаротушения:. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . инертные газы.
Хлороформ
(трихлорметан, хладон 20)
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . СНСl3
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 119,38
· Агрегатное состояние. . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . жидкое
· Внешний вид.. . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .бесцветная жидкость
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . характерный сладковатый запах
· Применение: как исходное вещество для синтеза фреонов (хладонов), как растворитель в лабораторной практике и технике.
· Плотность при 20°С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . . 1483
· Температура кипения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61,2
· Температура плавления, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 63,5
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 262
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5,53
· Теплота образования, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 131,8
· Теплоемкость, Дж/(моль×град). . . . . . . . . . . . . . . . . .. . . . . . . . . . . . . . . . . . . .116,3
· Теплоемкость, кал/ (моль × град) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .27,96
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | минус 58,0 | минус 39,1 | минус 29,7 | минус 19,0 | минус 7,1 | 0,5 | 10,4 | 25,9 | 42,7 | 61,3 |
| Р, атм | |||||||||
| t | 61,3 | 83,9 | 120,0 | 152,3 | 191,8 | 216,5 | 237,5 | 254,0 | — |
· Растворимость в воде: . . . . . . . . . . . . . . . . . . . . . . . . практически не растворим.
· Реакционная способность: растворим в большинстве органических растворителях. На свету медленно окисляется кислородом воздуха. Растворяет жиры, каучук, смолы, фосфор, йод. Разбавленной щелочью гидролизуется. Реагируя с основаниями, промежуточно образует дихлоркарбен. С алкоголятами дает ортомуравьиные эфиры.
· Регистрационный номер по CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67-66-3
· Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2
· ПДКм.р./с.с. в воздухе рабочей зоны, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10/5
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . 0898
· Класс опасности в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2
· ПДКм.р./с.с. в атмосферном воздухе, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . 0,1/0,03
· Воздействие на людей: обладает сильным наркотическим и анестезирующим действием; из-за значительной токсичности для хирургического наркоза не применяется. Действует токсически на обмен веществ и внутренние органы, в особенности на печень.
· Меры предосторожности: герметизация аппаратуры и коммуникаций, вентиляция помещений.
· Средства защиты: фильтрующий промышленный противогаз, шланговый противогаз с принудительной подачей воздуха. Специальная защита кожи и глаз.
· Группа горючести. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . негорючая жидкость
Церезин
· Эмпирическая формула (смесь высших углеводородов) . . . . . . . . . . . . . С34Н70
· Агрегатное состояние . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . аморфное
· Внешний вид . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . однородная масса без заметных посторонних включений от светло-желтого до темно-желтого цвета
· Применение: предназначен для получения смазок, восковых сплавов, изоляционных материалов и других целей.
· Плотность при 20°С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . . . . 910
· Температура кипения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 324
· Температура плавления, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64-77
· Удельная теплота сгорания (расч.), кДж/кг. . . . . . . . . . . . . . . . . . . . . . . . . .44066
· Растворимость в воде:. . . . . . . . . . . не смачивается водой, водонепроницаем.
· Реакционная способность:не растворим в холодном этаноле, хорошо растворим в бензине, хлороформе, бензоле и диэтиловом эфире. При нагревании выделяет пары углеводородов и диокид углерода.
· Воздействие на людей:отравления возможны углеводородами, выделяющимися при переработке. При больших выделениях паров отравления развиваются быстро и выражаются сначала в раздражении слизистых оболочек глаз, носа и горла; затем развивается «опьянение» со слуховыми и зрительными галлюцинациями, с психомоторным возбуждением и эйфорией. Иногда склонность к агрессии, например, при выводе из опасных мест, или полная пассивность. При длительном воздействии паров возможна потеря
сознания, продолжающаяся несколько часов. Легкие случаи «опьянения» быстро проходят на свежем воздухе.
· Меры первой помощи пострадавшим от воздействия вещества:пострадавшего необходимо вывести не свежий воздух.
· Меры предосторожности: помещения, в которых проводят работы с церезином, должны быть снабжены приточно-вытяжной вентиляцией. Не допускается непосредственный контакт церезина с открытым огнем.
· Средства защиты: при работе с церезином необходимо применять индивидуальные средства защиты в соответствии с типовыми отраслевыми нормами.
· Группа горючести . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . горючее вещество
· Температура вспышки, °С (открытый тигель). . . . . . . . . . . . . . . . . . . . . . . . . .285
· Температура воспламенения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 295
· Средства пожаротушения: распыленная вода, воздушно-механическая пена.
Эмаль ПФ — 115
· Агрегатное состояние. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . жидкое
· Внешний вид. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .суспензия (цвет различный)
· Основной продукт,%(масс.):пигменты и наполнители в алкидном лаке с введением органических растворителей, сиккатива и других добавок, пигмент – 55, ксилол – 22,5, уайт — спирит – 22,5.
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . характерный сильный запах
· Применение: для окрашивания металлических и деревянных поверхностей, подвергающихся воздействию атмосферных осадков.
· Плотность при 20 °С, кг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1500 – 1600
· Растворимость в воде. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .не растворима
· Реакционная способность:разбавляется сольвентом, ксилолом с уайт-спиритом, растворителем РЭ-4В.
· Воздействие на людей:при попадании на кожу действует раздражающе и может вызвать экзему. При попадании в воздух в производственных помещений оказывает действие на кровь, слизистую оболочку глаз и верхние дыхательные пути.
· Меры предосторожности: помещения должно быть оборудованы приточно-вытяжной вентиляцией.
· Средства защиты:средства индивидуальной защиты.
· Методы перевода вещества в безвредное состояние:разложение отходов осуществляется в шлаковой ванне (t=1400-1600°С), в которой они интенсивно перемешиваются кислородсодержащим дутьем. Горючие компоненты отходов окисляются кислородом дутья до оксида углерода (СО). Минеральная часть отходов растворяется в шлаке. Некоторые металлы (железо), расплавляясь (или восстанавливаясь из шлака), образуют слой металла на подине печи. Выделившиеся из ванны газы дожигаются (t=1500-1700°С) над поверхностью расплава и направляются в котел и газоочистку. Окончательное дожигание осуществляется в котле. Процесс обеспечивает полное разложение органических соединений до диоксида углерода (СО2) и Н2О. Практически нет вторичных отходов. Содержание оксидов азота (до очистки) в газах — 50-70 мг/нм 3 .
· Группа горючести. . . . . . . . . . . . . . легковоспламеняющаяся жидкость (ЛВЖ)
· Температура вспышки, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32 – 33
· Температура самовоспламенения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . .370 – 440
· Температурные пределы распространения пламени (в зависимости от входящего в состав эмали пигмента), °С
— нижний . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 – 33
— верхний . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60 – 73
· Средства пожаротушения:распыленная вода, воздушно-механическая пена.
Этан
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .С2Н6
· Структурная формула. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Н3С-СН3
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30,07
· Агрегатное состояние. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . газообразное
· Внешний вид. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . бесцветный газ
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . без запаха.
· Применение: в составе природного газа используется как топливо. Входит в состав сжиженных газов: незначительное количество этана в пропан-бутановой смеси повышает общее давление насыщенных паров газовой смеси, что обеспечивает в зимнее время избыточное давление, необходимое для нормального газоснабжения.
· Плотность газа при 20 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . 1,263
· Плотность газа при 0 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . 1,356
· Плотность газа по воздуху . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1,0488
· Плотность жидкой фазы при 0 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . 546
· Плотность жидкого этана при минус 90 о С, кг/м 3 . . . . . . . . . . . . . . . . . . . . 548,2
· Температура кипения при давлении 101,3 кПа, °С . . . . . . . . . . . . минус 88,63
· Температура кристаллизации (плавления)
при давлении 101,3 кПа, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .минус 183,3
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32,3
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4,82
· Теплота сгорания, кДж/моль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .1576
· Удельная теплота сгорания, кДж/кг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52413
кДж/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .63650
· Теплота образования, кДж/кг . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 84,68
· Теплоемкость газа при 0°С и постоянном давлении, кДж/(кг×град) . .1,6506
· Теплоемкость газа при 0°С и постоянном объеме, кДж/(кг×град). . . . 1,3734
· Теплоемкость жидкой фазы при 0°С и давлении 101,3 кПа . . . . . . . . . . . 3,01
· Объем паров с 1 кг сжиженных газов при нормальных условиях, м 3 .0,745
· Объем паров с 1 л сжиженных газов при нормальных условиях, м 3 . . 0,31
· Динамическая вязкость газа, Н×с/м 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 84,57×10 7
· Динамическая вязкость жидкой фазы, Н×с/м 2 . . . . . . . . . . . . . . . . . . . . 162,7×10 6
· Кинематическая вязкость, м 2 /с . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6,45×10 6
· Коэффициент диффузии газа в воздухе, см 2 /с. . . . . . . . . . . . . . . . . . . . . . 0,121
· Коэффициент теплопроводности газа
при 0°С и давлении 101,3 кПа, Вт/(м×К) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,019
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | минус 159,5 | минус 148,5 | минус 142,9 | минус 136,7 | минус 129,8 | минус 125,4 | минус 119,3 | минус 110,2 | минус 90,7 | минус 88,6 |
| Р, атм | |||||||||
| t | минус 88,6 | минус 75,0 | минус 52,8 | минус 32,0 | минус 6,4 | 10,0 | 23,6 | — | — |
· Растворимость в воде : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . не растворим
· Реакционная способность:растворим в органических растворителях. При обычных температурах химически инертен. При высоких — полностью сгорает, образуя диоксид углерода и воду.
· Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
· ПДКм.р./с.с. в воздухе рабочей зоны
(для алифатических предельных углеводородов С1-С10), мг/м 3 . . . .900/300
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . .0415
· ОБУВ в атмосферном воздухе
(для смеси предельных углеводородов С1-С5), мг/м 3 . . . . . . . . . . . . . . . . . . . . 50
· Воздействие на людей: малоопасное вещество. Является довольно сильным наркотиком, однако сила его действия ослабляется из-за очень малой растворимости в крови. Следовательно, при обычных условиях он физиологически индеферентен. Может вызывать раздражение слизистых оболочек глаза, конъюнктивиты. При сильных отравлениях — пневмония, потеря сознания.
· Меры первой помощи пострадавшим от воздействия вещества:удалить пострадавшего из вредной атмосферы. При нарушении дыхания – кислород. При тяжелом отравлении – госпитализация. Противопоказаны морфин и адреналин!
· Меры предосторожности: герметизация аппаратуры и коммуникаций, вентиляция помещений. Одновременное присутствие в воздухе сероводорода и повышенные температуры усиливают токсический эффект.
· Средства защиты:при невысоких концентрациях пригоден фильтрующий промышленный противогаз. При высоких концентрациях и нормальном содержании кислорода – изолирующие шланговые противогазы. При недостатке кислорода – кислородные респираторы.
· Методы перевода вещества в безвредное состояние: . . . . . . . . . . сжигание
· Группа горючести. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . горючий газ (ГГ)
· Температура самовоспламенения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .515
· Концентрационные пределы распространения пламени, % (об.):
воздуха . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2,9-15
кислорода . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3-66
· Минимальная энергия зажигания при 25°С , мДж. . . . . . . . . . . . . . . . . . . . 0,24
· Нормальная скорость распространения пламени при 25 °С, м/с. . . . . . .0,476
· Минимальное взрывоопасное содержание кислорода % (об.):
— при разбавлении диоксидом углерода . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13,8
— при разбавлении азотом . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11,3
· Максимальное давление взрыва, кПа. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .675
· Средняя скорость нарастания давления взрыва, МПа/с. . . . . . . . . . . . . . 14,5
· Максимальная скорость нарастания давления взрыва, МПа/с. . . . . . . . 17,2
· Минимальная флегматизирующая концентрация флегматизатора, % (об.)
— диоксида углерода . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .34
· Безопасный экспериментальный максимальный зазор, мм . . . . . . . . . . 0,91
· Группа взрывоопасной смеси по ГОСТ Р 51330.5 . . . . . . . . . . . . . . . . . . . . . . . Т1
· Категория взрывоопасности смеси по ГОСТ Р 51330.11 . . . . . . . . . . . . . . . . .IIA
· Средства пожаротушения:инертные газы.
Этантиол (одорант)
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . С2Н6S
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .62,13
· Агрегатное состояние. . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . жидкое
· Внешний вид.. . .. . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . бесцветная жидкость.
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . резкий, неприятный специфический запах.
· Применение: добавляют в горючие углеводородные газы или воздух для придания им характерного, предупреждающего запаха.
· Плотность при 20 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . . . . 840
· Плотность пара по воздуху . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2,11
· Температура кипения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .37
· Температура плавления при давлении 101,3 кПа, °С. . . . . . . . . . минус 147,3
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 225,5
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5,49
· Теплота сгорания, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 2173
· Удельная теплота сгорания, кДж/кг . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34975,1
· Теплота образования, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 73,3
· Температуры в °С, соответствующие давлению насыщенного пара:
| Р, мм рт.ст. | ||||||||||
| t | минус 76,7 | минус 59,1 | минус 50,2 | минус 40,7 | минус 29,8 | минус 22,4 | минус 13,0 | 1,5 | 17,7 | 35,0 |
| Р, атм | |||||||||
| t | 35,0 | 56,6 | 90,7 | 121,9 | 159,5 | 184,3 | 201,7 | 220,0 | — |
· Растворимость в воде: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .мало растворим.
· Реакционная способность:.мало растворим в эфире, растворим в этаноле.
· Регистрационный номер по CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75-08-1
· Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
· ПДКм.р. в воздухе рабочей зоны, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1
· Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . .1728
· Класс опасности в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
· ПДКм.р. в атмосферном воздухе, мг/м 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .5×10 -5
· Воздействие на людей:при концентрации 0,001 – 0,002 мг/л и вдыхании в течение 5 мин работоспособность нарушается, но при многодневном повторении воздействия восстанавливается. В ничтожных концентрациях пары вызывают рефлекторную тошноту и головную боль вследствие отвратительного запаха. В более высоких концентрациях влияют на центральную нервную систему. Обладает наркотическим эффектом, характеризующимся особой мышечной скованностью.
· Меры первой помощи пострадавшим от воздействия вещества:при легких отравлениях – свежий воздух, покой, крепкий чай или кофе. При сильной тошноте – аминазин (0,025 г), трифтазин (0,001 г) или седативные средства, а также витамины В6 (10 мг), РР (25 мг), С (100 мг). При упорной рвоте – внутримышечно 1 – 2 мг 2,5% раствора аминазина. При раздражении слизистой глаз, полости рта и носа – обильно промыть 2% раствором соды, в нос закапать несколько капель раствора 0,05% нафтизина. При попадании на кожу тщательно обмыть теплой водой с мылом.
· Меры предосторожности: тщательная герметизация всех процессов. Местная и общая вентиляция помещений. Контроль за содержанием в воздухе рабочей зоны.
· Средства защиты:фильтрующий промышленный противогаз. При высоких концентрациях – изолирующие шланговые противогазы с принудительной подачей воздуха. Защитные герметичные очки, защита кожи, спецодежда.
· Группа горючести. . . . . . . . . . . . . . легковоспламеняющаяся жидкость (ЛВЖ)
· Температура вспышки, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 20
· Температура самовоспламенения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 295
· Концентрационные пределы распространения
пламени, % (об.).. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2,8 – 18,0
· Безопасный экспериментальный максимальный зазор, мм . . . . . . . . . . 0,90
· Группа взрывоопасной смеси по ГОСТ Р 51330.5 . . . . . . . . . . . . . . . . . . . . . . . Т3
· Категория взрывоопасности смеси по ГОСТ Р 51330.11 . . . . . . . . . . . . . . . . IIВ
· Средства пожаротушения:распыленная вода, порошки, аэрозольные составы.
Этилен
· Эмпирическая формула . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . С2Н4
· Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28,05
· Агрегатное состояние. . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . газообразное
· Внешний вид.. . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . бесцветный газ
· Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . слабый
· Применение: используется для производства полиэтилена, поливинилхлорида, оксида этилена, этилового спирта, этилбензола, хлористого этила, уксусного альдегида и других органических продуктов, а также в качестве хладоагента.
· Плотность газа при 20 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . 1,174
· Плотность газа при 0 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . . . . . . . . . . . 1,26
· Плотность газа по воздуху . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,974
· Плотность жидкой фазы при 0 °С и давлении 101,3 кПа, кг/м 3 . . . . . . . . 566
· Температура кипения, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 103,7
· Температура плавления, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 169,5
· Критическая температура, °С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9,6
· Критическое давление, МПа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5,033
· Теплота сгорания, кДж/моль . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 1318
· Удельная теплота сгорания, кДж/кг . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46988
· Коэффициент диффузии газа в воздухе, см 2 /с . . . . . . . . . . . . . . . . . . . . . . . 0,13
· Плотность при температуре минус 103,8,
отнесенная к плотности воды при 4°С . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 0,5699
· Теплоемкость газа при 0°С и постоянном давлении, кДж/(кг×град). . 1,4658
· Теплоемкость газа при 0°С и постоянном объеме, кДж/(кг×град) . . . . 1,1634
· Теплоемкость жидкой фазы при 0°С
и давлении 101,3 кПа кДж/(кг×град). . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2,415
· Объем паров с 1 кг сжиженных газов при нормальных условиях, м 3 . . 0,8
· Объем паров с 1 л сжиженных газов при нормальных условиях, м 3
Дата добавления: 2017-08-01 ; просмотров: 4330 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Горение четыреххлористого углерода уравнение реакции
В статье сделан обзор различных методов переработки четыреххлористого углерода: сжигание, гидролиз, пиролиз, взаимодействие с метанолом, метаном, водородом или другими веществами. Рассмотрены подходы к процессу сжигания четыреххлористого углерода.
Поскольку четыреххлористый углерод (ЧХУ) в соответствии с Монреальским протоколом является запрещенным озоноразрушающим веществом, но неизбежно образуется в качестве побочного продукта в производстве хлорметанов, выбор наиболее эффективного метода переработки ЧХУ является актуальной задачей.
Различные превращения ЧХУ особенно интенсивно исследовались в последнее время, имеется большое количество экспериментальных данных. Ниже будет сделана оценка различных вариантов превращения ЧХУ на основании собственных исследований и данных других авторов.
В работах [1, 2] рассмотрена проблема переработки ЧХУ в экологически безопасные продукты, однако в них не полно освещены возможные варианты переработки, а также, на наш взгляд, недостаточно объективно отражены преимущества и недостатки отдельных методов утилизации ЧХУ.
Можно отметить и некоторые противоречия в статьях [1, 2]. Так, темой статей является переработка ЧХУ в экологически безопасные продукты, в тексте и выводах в качестве перспективных методов рекомендуется превращение ЧХУ в хлорметаны, а во введении хлорметаны называются основными химическими загрязнителями окружающей среды. В действительности хлорметаны не включены в Стокгольмскую конвенцию по стойким органическим загрязнителям, а по токсичности, объему выпуска хлорметаны не являются основными загрязнителями даже среди других хлорорганических соединений [3].
В статьях [1, 2] говорится о высокой персистентности хлорметанов. В то же время известно, что все хлорметаны, кроме хлористого метила, являются неустойчивыми продуктами и для сохранения своих свойств требуют стабилизации [4]. Разложение хлорметанов происходит в кипятильниках ректификационных колонн, в испарителе для подачи ЧХУ в реактор. Согласно энциклопедии [5] хлороформ без стабилизатора вряд ли продержится без изменения своих свойств в течение суток, если находится в контакте с атмосферой.
Процессы переработки ЧХУ можно классифицировать по степени полезности получаемых продуктов переработки. Это не означает, что в той же последовательности будут располагаться и полезность самих процессов утилизации ЧХУ, так как многое будет зависеть от стоимости переработки и последующего выделения полученных продуктов.
Определенное влияние на выбор метода оказывает и наличие в перерабатываемых отходах кроме ЧХУ большого количества других продуктов (например, в кубовых ректификации производства хлорметанов), когда выделение ЧХУ из этих отходов может потребовать значительных затрат. Такая же ситуация складывается при обезвреживании ЧХУ, содержащегося в небольшом количестве в газовых выбросах. В этом случае неселективное полное сжигание с получением СО2 и HCl с практически нулевой полезностью из-за малой рентабельности их выделения может оказаться наиболее приемлемым решением. Поэтому в каждом конкретном случае выбор может быть сделан только после технико-экономического сравнения.
Сжигание ЧХУ
При сжигании ЧХУ с использованием в качестве окислителя воздуха требуется одновременная подача углеводородного топлива для подвода тепла и связывания хлора в хлористый водород. Как вариант при небольшом количестве хлористого водорода его можно превращать в хлорид натрия путем впрыскивания в газы сжигания раствора гидрооксида натрия [6]. В противном случае хлористый водород выделяют из газов сжигания в виде соляной кислоты.
Утилизация самой соляной кислоты может быть проблемой из-за превышения предложения над спросом. Выделение хлористого водорода из соляной кислоты методом стриппинга приводит к тому, что он становится дороже хлора. Кроме этого, хлористый водород имеет ограниченное применение в процессах оксихлорирования и гидрохлорирования. Превращение хлористого водорода в хлор с помощью электролиза соляной кислоты или окисления кислородом (процесс Дикона) является довольно дорогой и сложной с точки зрения технологии операцией.
Авторами работ [1, 2] в качестве метода полного окисления ЧХУ предпочтение отдается каталитическому окислению по сравнению с обычным термическим сжиганием. Согласно [7] по сравнению со сжиганием процессы каталитического окисления характеризуются большей глубиной деструкции хлорорганических отходов и не сопровождаются образованием диоксинов.
Эти утверждения не соответствуют действительности и могут привести к превратному представлению об эффективности сравниваемых методов. В статье [7] не приводится никаких данных в подтверждение более высоких степеней превращения при каталитическом окислении. В приводимых в пользу такого утверждения ссылках, например [8], степени превращения действительно высокие 98-99%, но это не тот уровень, который достигается при термическом сжигании. Даже если указывается степень превращения 100% или 100,0%, это означает только, что точность этих данных составляет 0,1%.
В соответствии с американским Законом о сохранении и восстановлении ресурсов для основных органических опасных загрязнений эффективность деструктивного удаления должна составлять как минимум 99,9999%. В Европе также рекомендуют придерживаться этой минимальной величины степени разложения непригодных пестицидов и полихлорбифенилов в установках сжигания.
Разработан ряд требований к процессу сжигания, названный BAT – Best Available Technique (наилучший приемлемый способ). Одним из требований наравне с температурой 1200оС и временем пребывания 2 с является турбулентность реакционного потока, позволяющая, в основном, устранять проблему проскока сжигаемого вещества в пристеночном слое и обеспечивать режим идеального вытеснения. По-видимому, в трубчатом реакторе, заполненном катализатором, труднее устранить проскок сжигаемого вещества в пристеночном слое. Кроме этого имеются трудности в равномерном распределении реакционного потока по трубкам. В то же время дальнейшие успехи в устранении «пристеночного эффекта» позволили при сжигании в жидкостном ракетном двигателе достигнуть степени превращения 99,999999% [9].
Другим спорным утверждением авторов [1, 2, 7] является отсутствие ПХДД и ПХДФ в продуктах каталитического окисления. Никаких цифр в подтверждение этого не приводится. В работе [7] даны только две ссылки, подтверждающие факт отсутствия диоксинов при каталитическом окислении. Однако одна из ссылок [10], по-видимому, из-за какой-то ошибки не имеет к каталитическому окислению никакого отношения, так как посвящена биотрансформации органических кислот. В другой работе [11] рассматривается каталитическое окисление, но никаких сведений об отсутствии при этом диоксинов не сообщается. Наоборот приводятся данные об образовании другого стойкого органического загрязнителя – полихлорбифенила при каталитическом окислении дихлорбензола, что может косвенно говорить о возможности образования и диоксинов.
В работе [7] справедливо отмечается, что температурный диапазон каталитических процессов окисления хлорорганических отходов благоприятен для образования ПХДД и ПХДФ, однако отсутствие ПХДД и ПХДФ может быть обусловлено каталитической деструкцией источников их образования. В то же время известно, что на катализаторах с успехом идут и процессы синтеза высокомолекулярных соединений даже из соединений С1.
В европейских странах действуют экологические требования по сжиганию отходов, по которым предельная величина выбросов в атмосферу по диоксинам составляет 0,1 нг ТЭ/нм3.
Представленные выше экологические показатели процесса термоокислительного (огневого) обезвреживания жидких хлорорганических отходов имеются в [6]. Наконец, следует отметить, что в «Реестре существующих мощностей для уничтожения полихлорбифенилов» [12] наиболее широко применяемым и проверенным методом уничтожения ПХБ является высокотемпературное сжигание. Каталитическое окисление для этой цели не применяется.
По нашему мнению, каталитическое окисление, несмотря на использование в качестве катализатора драгоценных металлов на носителе, имеет преимущество при уничтожении остаточных количеств токсичных веществ в газовых выбросах, так как благодаря низкой температуре процесса требуется значительно меньший расход топлива на нагрев реакционного газа, чем при термическом сжигании. Такая же ситуация складывается, когда оптимальные условия для сжигания трудно создать, например, в каталитических дожигателях в автомобильных двигателях. Кроме того, каталитическое окисление хлорорганических отходов под давлением («катоксид-процесс») было использовано фирмой «Goodrich» для непосредственной подачи газов сжигания, содержащих хлористый водород, в реактор окислительного хлорирования этилена для получения дихлорэтана.
Сообщается о том, что при сочетании термического и каталитического окисления газообразных отходов достигается более высокая эффективность, чем при чисто каталитическом окислении [13]. Квалифицированная переработка хлорорганических отходов рассмотрена также в [14]. По нашему мнению, для сжигания ЧХУ в виде концентрированного продукта целесообразнее использовать обычное термическое сжигание.
В заключение этого раздела целесообразно рассмотреть еще один аспект окисления ЧХУ. Согласно [1, 2] ЧХУ является негорючим веществом, поэтому его сжигание может быть осуществлено только в присутствии дополнительного топлива. Это справедливо при использовании воздуха в качестве окислителя. В кислороде же ЧХУ способен сгорать с незначительным тепловым эффектом, теплотворная способность составляет 242 ккал/кг [15]. Согласно другому справочнику [3] теплота сгорания жидкости равна 156,2 кДж/моль (37,3 ккал/моль), а теплота сгорания пара равна 365,5 кДж/моль (87,3 ккал/моль).
Окисление кислородом может быть одним из способов переработки ЧХУ, в котором теряется углеродная составляющая, но регенерируется хлор, потраченный на получение ЧХУ. Такой процесс имеет преимущество перед обычным сжиганием ввиду получения концентрированных продуктов.
CCl4 + O2 → CO2 + 2Cl2
Процесс окислительного дехлорирования ЧХУ позволяет получать также углекислый газ, а при необходимости и фосген.
2CCl4 + O2 → 2COCl2 + 2Cl2
Гидролиз ЧХУ
Еще одним интересным, на наш взгляд, процессом переработки ЧХУ в углекислый газ и хлористый водород является гидролиз.
CCl4 + 2Н2О → CO2 + 4НCl
Публикаций по этому направлению имеется мало. Взаимодействие ОН-групп с хлорметанами в газовой фазе обсуждается в статье [16]. Каталитический гидролиз ЧХУ до HCl и СО2 на окиси магния при температурах более 400оС изучен в [17]. Константы скорости гомогенного гидролиза ЧХУ в жидкой фазе получены в работе [18].
Процесс хорошо идет, по нашим данным, при относительно низких температурах 150-200оС, использует самый доступный реагент и не должен сопровождаться образованием диоксинов и фуранов. Необходим только устойчивый к соляной кислоте реактор, например, покрытый внутри фторопластом. Возможно, такой дешевый и экологически чистый метод переработки может применяться для уничтожения и других отходов.
Взаимодействие ЧХУ с метанолом
Близким к гидролизу и фактически протекающим через эту стадию является процесс парофазного взаимодействия ЧХУ с метанолом с получением хлористого метила в присутствии катализатора – хлористый цинк на активированном угле. Относительно недавно этот процесс был впервые запатентован фирмой Shin-Etsu Chemical (Япония) [19]. Процесс протекает с высокими близкими к 100% конверсиями ЧХУ и метанола.
CCl4 + 4СН3ОН → 4CH3Cl + СО2 + 2Н2О
Авторы считают, что взаимодействие ЧХУ с метанолом протекает в 2 этапа: сначала идет гидролиз ЧХУ до углекислого газа и хлористого водорода (см. выше), а затем хлористый водород реагирует с метанолом с образованием хлористого метила и воды.
СН3ОН + НCl → CН3Cl + Н2О
При этом для инициирования реакции достаточно небольшого количества воды, которое присутствует в атмосфере. Считается, что лимитирует скорость суммарного процесса первая стадия.
При близком к стехиометрическому соотношении ЧХУ к метанолу (1:3,64) реакция стабильно протекала во время эксперимента, длившегося 100 часов, с конверсией ЧХУ 97,0% и метанола 99,2%. Селективность образования хлористого метила была близка к 100%, так как были обнаружены лишь следы диметилового эфира. Температура в слое катализатора составляла 200 о С [19].
Затем было предложено разделить процесс на две реакционные зоны: в первой идет гидролиз ЧХУ, а во второй – взаимодействие хлористого водорода с вводимым в эту зону метанолом [20]. Наконец той же фирмой был запатентован способ получения хлорметанов без образования ЧХУ [21], который включает следующие стадии:
• получение хлорметанов хлорированием метана;
• взаимодействие хлористого водорода, выделившегося на первой стадии, с метанолом с образованием хлористого метила и разбавленной соляной кислоты;
• гидролиз ЧХУ разбавленной соляной кислотой в присутствии катализатора – хлориды или оксиды металлов на носителе.
Недостатком гетерогенно каталитического процесса взаимодействия ЧХУ с метанолом является относительно невысокий срок службы катализатора из-за его обуглероживания. При этом высокотемпературная регенерация для выжигания углистых отложений нежелательна из-за улетучивания хлорида цинка, а при использовании активированного угля в качестве носителя вообще невозможна.
В заключение этого раздела можно упомянуть, что нами предпринимались попытки уйти от твердого катализатора в процессе переработки ЧХУ с метанолом. В отсутствие катализатора при мольном соотношении метанол:ЧХУ = 4:1 и с ростом температуры от 130 до 190оС конверсия ЧХУ увеличивалась с 15 до 65%. Для изготовления реактора требуются материалы, устойчивые в этих условиях.
Проведение каталитического жидкофазного процесса при относительно низких температурах 100-130оС и мольном соотношении метанол:ЧХУ = 4:1 без давления позволило достичь конверсии ЧХУ только 8%, при этом можно получать практически 100% превращение метанола и 100% селективность по хлористому метилу. Для повышения конверсии ЧХУ требуется увеличение температуры и давления, что в лабораторных условиях осуществить не удалось.
Запатентован способ алкоголиза ЧХУ, включающий одновременную подачу ЧХУ и ³ 1 спирта ROH (R = алкил С1 – С10) в каталитическую систему, представляющую собой водный раствор металлгалогенидов, в особенности хлоридов I Б, I I Б, V I Б и V I I I групп [22]. При жидкофазном взаимодействии метанола и ЧХУ (в соотношении 4:1) в лабораторном реакторе с магнитной мешалкой в присутствии каталитического раствора хлорида цинка при температуре 180оС и давлении 3,8 бар конверсии ЧХУ и метанола составляли 77%.
Хлорирование с помощью ЧХУ
ЧХУ является безопасным хлорирующим агентом, например, при получении хлоридов металлов из их оксидов. В процессе такой реакции ЧХУ превращается в углекислый газ.
2Ме2О3 + 3CCl4 → 4МеCl3 + 3СО2
Проводились работы по получению хлоридов железа с применением в качестве хлорирующего агента ЧХУ, процесс идет при температуре около 700оС. Хлорированием с помощью ЧХУ в промышленности получают из оксидов элементов 3-5 групп Периодической системы их хлориды.
Взаимодействие ЧХУ с метаном
Наиболее простым решением проблемы переработки ЧХУ было бы взаимодействие ЧХУ с метаном в реакторе хлорирования метана с получением менее хлорированных хлорметанов, так как в этом случае потребовалось бы практически только организация рецикла не прореагировавшего ЧХУ, а последующее выделение и разделение продуктов реакции может быть осуществлено на основной системе производства.
Ранее при исследовании процесса окислительного хлорирования метана, как в лаборатории, так и на опытной установке, было замечено, что при подаче в реактор реакционного газа от процесса прямого хлорирования метана, содержащего все хлорметаны, включая ЧХУ, количество последнего после реактора оксихлорирования уменьшается, хотя должно было с возрастанием количества всех остальных хлорметанов увеличиваться [23, 24].
В связи с этим представляло определенный интерес провести термодинамический анализ реакций взаимодействия метана с ЧХУ и другими хлорметанами. Оказалось, что наиболее термодинамически вероятным является взаимодействие ЧХУ с метаном. При этом равновесная степень превращения ЧХУ в условиях избытка метана, который реализуется в промышленном хлораторе, близка к 100% даже при самой высокой температуре (самой низкой константе равновесия).
Однако реальное протекание термодинамически вероятного процесса зависит от кинетических факторов. Кроме этого в системе ЧХУ с метаном могут протекать и другие реакции: например, пиролиз ЧХУ до гексахлорэтана и перхлорэтилена, образование других хлорпроизводных С2 за счет рекомбинации радикалов.
Экспериментальное исследование реакции взаимодействия ЧХУ с метаном проводили в проточном реакторе при температурах 450-525оС и атмосферном давлении, при времени взаимодействия 4,9 с. Обработка экспериментальных данных дала следующее уравнение скорости обменной реакции метана с ЧХУ [25]:
r = 1014,94 exp(-49150/RT)•[ССl4]0,5•[СН4], моль/см 3 •с.
Полученные данные позволили оценить вклад обменного взаимодействия ЧХУ с метаном в процессе хлорирования метана, рассчитать необходимый рецикл ЧХУ для полного его превращения. В таблице 1 приведены конверсии ЧХУ в зависимости от температуры реакции и концентрации ЧХУ при примерно одинаковой концентрации метана, которая реализуется в промышленном хлораторе.
Конверсия ЧХУ закономерно падает с уменьшением температуры процесса. Приемлемая конверсия ЧХУ наблюдается только при температурах 500-525 о С, что близко к температуре объемного хлорирования метана на действующих производствах хлорметанов 480-520 о С.
Суммарные превращения ЧХУ и метана могут быть охарактеризованы следующим суммарным уравнением и материальным балансом:
CCl4 + CH4 → CH3Cl + CH2Cl2 + CHCl3 + 1,1-C2H2Cl2 + C2Cl4 + HCl
100,0 95,6 78,3 14,9 15,2 7,7 35,9 87,2 моль
Во второй строчке даны количества прореагировавшего метана и полученных продуктов в молях на 100 молей прореагировавшего ЧХУ. Селективность превращения ЧХУ в хлорметаны равна 71,3%.
Поскольку выделение товарного ЧХУ из кубовых ректификации производства хлорметанов представляло собой определенную проблему, а со сбытом кубовых ректификации периодически возникали трудности, переработка ЧХУ в реакторе хлорирования метана вызывала интерес еще до запрета на выпуск ЧХУ в связи с его озоноразрушающей способностью.
Опытно-промышленные испытания переработки ЧХУ в реакторе хлорирования метана были осуществлены на Чебоксарском п.о. «Химпром». Полученные результаты, в основном, подтвердили лабораторные данные. Селективность превращения ЧХУ в хлорметаны была выше, чем в лабораторных условиях.
То, что селективность процесса взаимодействия ЧХУ в промышленном реакторе оказалась выше, чем в лабораторном можно объяснить тем, что при хлорировании метана в лабораторном реакторе происходит перегрев наружных стенок, обогреваемых кожухом с электроспиралью. Так, при температуре в реакционной зоне 500оС, температура стенок лабораторного хлоратора составляла 550 о С.
В промышленном реакторе происходит аккумулирование тепла центральным кирпичным столбиком и футеровкой, а наружные стенки хлоратора, наоборот, охлаждаются.
Опытно-промышленные испытания возврата ЧХУ в реактор хлорирования метана проводились ранее и на Волгоградском п.о. «Химпром». ЧХУ в промышленный хлоратор подавали без выделения в составе кубовых ректификации вместе со всеми примесями хлоруглеводородов С2. В результате за месяц было переработано около 100 м3 кубовых ректификации. Однако обработка полученных данных вызвала затруднения из-за большого количества компонентов в малой концентрации и недостаточной точности анализов.
Для подавления образования побочных хлоруглеводородов этиленового ряда при взаимодействии ЧХУ с метаном предлагается вводить в реакционную смесь хлор при соотношении хлора к ЧХУ 0,5 [26].
Получение хлорметанов и других продуктов взаимодействием ЧХУ с метаном при температурах 400-650 о С в полом реакторе описано в патенте [27]. Приводится пример, где конверсия ЧХУ составляла в % мол.: в хлороформ – 10,75, метиленхлорид – 2,04, хлористый метил – 9,25, винилиденхлорид – 8,3 и трихлорэтилен – 1,28.
Затем той же фирмой «Stauffer» был запатентован способ получения хлороформа взаимодействием ЧХУ с углеводородами С2-С3 и хлоруглеводородами С1-С3 [28]. Согласно приводимым примерам из ЧХУ и метиленхлорида при температуре 450оС в полом реакторе получается только хлороформ, а при температуре 580оС – хлороформ и перхлорэтилен. Из ЧХУ и хлористого метила при температуре 490оС образовывались только метиленхлорид и хлороформ в равном количестве, а при температуре 575оС появлялся еще и трихлоэтилен.
Предлагался также процесс получения хлористого метила и метиленхлорида взаимодействием метана с хлором и ЧХУ в кипящем слое контакта при температуре 350-450 о С [29]. Описан процесс хлорирования метана до хлороформа в кипящем слое контакта с введением в реакционную зону ЧХУ для обеспечения теплосъема [30]. В этом случае одновременно происходит реакция ЧХУ с метаном.
Обменная реакция между ЧХУ и парафином приводит к образованию хлороформа и хлорпарафина [31].
При разработке процесса окислительного хлорирования метана было найдено, что окислительное дехлорирование ЧХУ в присутствии метана протекает более эффективно, чем взаимодействие метана и ЧХУ в отсутствии кислорода и катализатора.
Полученные данные говорят о том, что процесс окислительного дехлорирования ЧХУ в присутствии метана и катализатора на основе хлоридов меди протекает при более низкой температуре, чем взаимодействие ЧХУ с метаном в отсутствии кислорода, с получением только хлорметанов без образования побочных хлоруглеводородов. Так, конверсия ЧХУ при температурах 400, 425 и 450оС составляла в среднем соответственно 25, 34 и 51%.
Дополнительным преимуществом окислительной переработки ЧХУ является отсутствие зауглероживания катализатора. Однако необходимость катализатора и кислорода снижает преимущества данного метода.
Запатентован способ получения хлорметанов [32] окислительным хлорированием метана без получения ЧХУ в конечных продуктах за счет полного его рецикла в зону реакции. В одном из подпунктов формулы изобретения этой заявки утверждается, что можно получить в качестве конечного продукта один хлороформ, возвращая в реакционную зону метан и все хлорметаны кроме хлороформа.
Переработка ЧХУ с водородом
Гидродехлорирование ЧХУ с помощью водорода (так же, как и метана) в отличие от окислительных превращений с помощью кислорода позволяет с пользой использовать и углеродную составляющую ЧХУ. Катализаторы, кинетика, механизм и другие аспекты реакций гидродехлорирования рассмотрены в обзорах [33, 34].
Одной из основных проблем процесса гидродехлорирования ЧХУ является селективность, нередко реакция идет до образования метана, а выход хлороформа, как наиболее желательного продукта, недостаточно высок. Другой проблемой является довольно быстрая дезактивация катализатора, в основном, за счет обуглероживания при разложении ЧХУ и продуктов реакции. При этом добиться селективного получения хлороформа удается более легко, чем стабильности катализатора. В последнее время появилось довольно много работ, где достигается высокая селективность по хлороформу, данных по стабильности катализатора гораздо меньше.
В патенте [35] в качестве катализаторов гидрогенолиза ЧХУ и хлороформа предлагают Ru, Rh, Pd, Os, Ir, Pt, Cu, Ag или Au. На катализаторе, содержащем 0,5% платины на окиси алюминия, при температурах 70-180 о С из ЧХУ получено 97,7-84,8% хлороформа и 2,3-15,2% метана; при более высоких температурах образуется также метиленхлорид.
В работах 38 гидродехлорирование ЧХУ проводилось на платиновых катализаторах. Выбор MgO в качестве носителя [36] был сделан на основании более высокой селективности по хлороформу и длительности работы катализатора по сравнению с другими носителями: Al2O3, TiO2, ZrO2, SiO2, алюмосиликат и цеолит NaY. Показано [37], что для стабильной работы катализатора Pt/MgO с конверсией ЧХУ более 90% необходимо поддерживать температуру реакции 140оС, соотношение Н2/ЧХУ более 9 и объемную скорость 9000 л/кг.ч. Обнаружено [38] влияние природы исходных соединений платины на активность полученного катализатора – 1% Pt/Al2O3. На катализаторах, приготовленных из Pt(NH3)4Cl2, Pt(NH3)2(NO3)2 и Pt(NH3)4(NO3)2, конверсия ЧХУ близка к 100%, а селективность по хлороформу – к 80%.
Модифицирование катализатора – 0,25% Pt/Al2O3 окисью лантана позволило при 120оС, объемной скорости 3000 ч-1и мольном соотношении Н2:ССl4 = 10 получить выход хлороформа 88% при селективности 92% [39].
По данным [40] прокаливание носителя – окиси алюминия при температурах 800 – 900оС снижает льюисовскую кислотность, благодаря чему повышается стабильность и селективность катализатора. На окиси алюминия с удельной поверхностью 80 м2/г, содержащей 0,5% Pt, конверсия ЧХУ 92,7% при селективности по хлороформу 83% удерживается в течение 118 часов.
В отличие от данных [40] в патенте [41] при получении метиленхлорида и хлороформа гидродехлорированием ЧХУ рекомендуют обрабатывать носитель соляной кислотой или соляной кислотой и хлором, а платину промотировать небольшими количествами металлов, например, оловом. Это позволяет снизить образование побочных продуктов и повысить стабильность катализатора.
При гидродехлорировании ЧХУ на катализаторах, содержащих 0,5-5% Pd на сибуните (угле) или TiO2, при температуре 150-200оС конверсия ЧХУ составляла 100% [42]. В качестве побочных продуктов образовывались нехлорированные углеводороды С2-С5. Стабильно катализаторы работали более 4-х часов, после этого проводилась регенерация продувкой аргоном при нагревании.
Сообщается [43], что при использовании биметаллической композиции платины и иридия, промотированной небольшими количествами третьих металлов, таких как олово, титан, германий, рений и др., образование побочных продуктов уменьшается, а продолжительность работы катализатора увеличивается.
При исследовании некаталитического взаимодействия ЧХУ с водородом методом импульсного сжатия в свободнопоршневой установке при характерных временах процесса 10-3 с было найдено две области протекания реакции [44]. При температуре 1150К (степень превращения до 20%) процесс протекает относительно медленно. Регулируя состав исходной смеси и температуру процесса, можно получить 16%-ный выход хлороформа с селективностью, близкой к 100%. В определенной области температур в условиях самовоспламенения смеси реакцию можно направить на преимущественное образование перхлорэтилена.
Большие успехи в деле разработки активного, стабильного и селективного катализатора газофазного гидродехлорирования ЧХУ водородом были достигнуты фирмой «Sud Chemie MT» [45]. Катализатором являются благородные металлы V группы, нанесенные на микросферическую окись алюминия (состав катализатора фирмой не раскрывается). Процесс проводится в псевдоожиженном слое катализатора при температурах 100-150оС, давлении 2-4 ата, времени контакта 0,5-2 сек и соотношении водород:ЧХУ в реакционной зоне 6-8:1 (мол.).
Конверсия ЧХУ в этих условиях достигает 90%, селективность по хлороформу – 80-85%. Основным побочным продуктом является метан, хлористый метил и метиленхлорид образуются в незначительных количествах.
В работах [46,47] исследовано гидродехлорирование ЧХУ на палладиевых катализаторах в жидкой фазе. При температурах 20-80оС на ацетате палладия с добавкой уксусной кислоты и при использовании в качестве растворителей парафинов С7 -С12, метилэтилкетона, диметилформамида, диоксана и бензилового спирта единственным продуктом реакции оказался метан [46]. Проведение реакции в изопропиловом и трет-бутиловом спиртах в качестве растворителей позволило получить в качестве основных продуктов хлороформ и хлористый метил, образование метана колебалось от следовых количеств до 5%.
Отмечается, что побочная реакция гидрохлорирования спиртов, используемых в качестве растворителей, протекает с конверсией 7-12% от поданного количества и образованием изомеров хлорпроизводных, что создает проблему их утилизации и затруднит выделение товарных продуктов. Поэтому реализация этого метода пока не планируется.
По-видимому, для исключения побочных продуктов в патенте [48] реакцию гидродехлорирования ЧХУ до хлороформа предлагают проводить в галоидированном алифатическом растворителе, в частности в хлороформе. Катализатором служит суспензия платины на носителе. Конверсия ЧХУ составляет 98,1% при селективности образования хлороформа 99,3%.
Такой же процесс получения хлороформа в присутствии Pt и Pd –катализаторов на носителе с использованием 1 растворителя (пентан, гексан, гептан, бензол и др.) описан в патенте [49]. Утверждается, что процесс проводится непрерывно или периодически в промышленном масштабе.
Наиболее часто применяемыми катализаторами для гидродехлорирования ЧХУ до хлороформа и других хлорметанов являются палладий, платина, родий и рутений на носителе. В [50] такой катализатор распыляют и суспензируют в жидком ЧХУ и обрабатывают его водородом при давлении 8000 кПа и температуре ниже 250оС. Сообщается, что способ пригоден для получения хлороформа в промышленных масштабах.
При исследовании гидрохлорирования ЧХУ в жидкофазном барботажном реакторе [51] было показано, что наиболее активным и селективным катализатором является палладий, нанесенный на активированный уголь. Преимущество активированного угля в качестве носителя обусловлено более равномерным распределением металла на его поверхности по сравнению с такими неорганическими носителями как окись алюминия и силикагель. По активности металлов катализаторы можно расположить в ряд Pd/C Pt/C Rh/C Ru/C Ni/C. Основным побочным продуктом является гексахлорэтан.
В дальнейшем было обнаружено, что скорость процесса лимитируется химической реакцией на поверхности [52].
Превращения ЧХУ в ПХЭ
В жестких температурных условиях происходит образование перхлорэтилена из ЧХУ. Процесс получения перхлорэтилена из ЧХУ идет с поглощением тепла и выделением хлора, чем принципиально отличается от производств перхлоруглеродов (перхлорэтилена и ЧХУ) из метана или отходов производства эпихлоргидрина, где процессы идут при подаче хлора и с выделением тепла.
При 600оС Н = 45,2 ккал/моль, а равновесная степень превращения при атмосферном давлении составляет 11,7% 5. Следует отметить, что данные различных авторов о величине теплового эффекта реакции значительно отличаются, что вызывало сомнения в возможности полной переработки ЧХУ в перхлорэтилен в производствах перхлоруглеродов из-за недостатка тепла для этой реакции. Однако полный рецикл ЧХУ в настоящее время осуществлен в производстве перхлоруглеродов на Стерлитамакском ЗАО «Каустик».
Термическое превращение ЧХУ значительно увеличивается в присутствии акцепторов хлора. Очевидно, что акцептор, связывая хлор, сдвигает равновесие реакции:
2CCl4 → C2Cl4 + 2Cl2
в сторону образования перхлорэтилена.
Превращение ЧХУ в перхлорэтилен в присутствии акцептора хлора выполняет еще одну очень важную функцию – превращает эндотермический процесс в экзотермический и исключает практически нереальный подвод тепла через стенку при таких температурах в присутствии хлора.
Введение органических акцепторов хлора (метана, этилена, 1,2-дихлорэтана) в процессе термического дехлорирования ЧХУ позволило повысить выход ПХЭ до 50% масс. [53], однако при этом симбатно возрастало и количество побочных продуктов (гексахлорэтан, гексахлорбутадиен, смолы). Поэтому в работе 53 для реализации процесса в промышленности рекомендуется добавлять акцептор (метан или этилен) в количестве 0,3 от стехиометрии.
В патенте 54 предлагается проводить процесс некаталитического термического превращения ЧХУ в перхлорэтилен при температуре 500-700 о С с использованием в качестве акцептора хлора водорода, благодаря чему образуется мало побочных хлоруглеводородов.
Превращение ЧХУ в ПХЭ при наличии сбыта последнего имеет очень важные преимущества перед другими методами переработки ЧХУ от производства хлорметанов:
• для переработки не требуется выделять ЧХУ из кубовых ректификации;
• в ПХЭ превращаются и хлоруглеводороды С2, содержащиеся в кубовых.
Процесс превращения ЧХУ в перхлорэтилен в присутствии СН4 сопровождается образованием большого количества побочных продуктов, часть из которых (гексахлорэтан, гексахлорбутадиен) перерабатываются в процессе, другие (гексахлорбензол) направляются на захоронение. При этом метан, связывая хлор, превращается в ЧХУ, который также надо перерабатывать, т.е. мощность по переработке ЧХУ увеличивается.
При использовании водорода в качестве акцептора хлора количество побочных продуктов уменьшается, увеличивается только выход хлористого водорода. Процесс проводится в псевдоожиженном слое силикагеля. Температура процесса 550-600 о С, соотношение ЧХУ:Н2 = 1:0,8-1,3 (мол.), время контакта 10-20 с. Конверсия ЧХУ достигает 50% 55. Недостатком этого процесса является необходимость создания отдельной большой технологической схемы, а также наличие трудноутилизируемого отхода – гексахлорбензола.
Минимизировать образование тяжелых побочных продуктов можно и при получении перхлорэтилена хлорированием углеводородов и их хлорпроизводных в присутствии ЧХУ и водорода [56].
Другие методы переработки ЧХУ
Некоторые способы восстановления ЧХУ предложены в 58. Например, можно получить хлороформ медленным восстановлением ССl4 железом с соляной кислотой, цинковой пылью с 50% раствором NH4Cl при 50-60 о С, этанолом при 200 о С.
При электрохимическом восстановлении ЧХУ [61] получаются, в основном, хлороформ и метиленхлорид. В присутствии хлористого алюминия ЧХУ алкилирует ароматические соединения. В свободно радикальных реакциях и реакциях теломеризации ЧХУ служит переносчиком галогена.
Выводы
1. Так как ЧХУ неизбежно образуется при хлорировании метана и хлорметанов, разработка методов его эффективной переработки является актуальной задачей.
2. При уничтожении ЧХУ высокотемпературным сжиганием достигаются существующие экологические требования по эффективности деструктивного удаления 99,9999% и содержанию диоксинов в выбросах не более 0,1 нг ТЭ/нм3. Аналогичных показателей при каталитическом окислении ЧХУ не выявлено.
При каталитическом окислении ЧХУ кислородом возможно получения хлора и/или фосгена.
3. Интересным методом переработки ЧХУ с точки зрения дешевого реагента и низкой температуры процесса является гидролиз до углекислого газа и хлористого водорода.
4. Совмещение гидролиза ЧХУ и взаимодействия образовавшегося HCl с метанолом дает также достаточно интересный процесс переработки ЧХУ с метанолом с получением хлористого метила и СО2.
5. Гидродехлорирование водородом позволяет утилизировать ЧХУ с получением нужных менее хлорированных хлорметанов. Основным недостатком этого процесса, так же как и взаимодействия с метанолом является постепенное падение активности катализатора за счет зауглероживания.
6. Наиболее простым решением проблемы переработки ЧХУ является взаимодействие ЧХУ с метаном при его возврате в реактор хлорирования метана. Однако кроме хлорметанов при этом образуются примеси хлоруглеводородов С2. Избежать образования примесей можно при взаимодействии ЧХУ с метаном в присутствии катализатора и кислорода при более низкой температуре, однако для этого потребуется создание отдельной стадии и наличие кислорода.
7. Пиролиз ЧХУ в присутствии метана, водорода или других акцепторов хлора позволяет получать перхлорэтилен. Процесс осложняется образованием побочных высокомолекулярных продуктов.
8. ЧХУ является безопасным хлорирующим агентом, например, при получении хлоридов металлов из их оксидов.
9. Имеются ряд других методов переработки ЧХУ, например, электрохимическим восстановлением или с помощью реагентов – восстановителей. Можно использовать ЧХУ и в качестве алкилируюшего агента.
Библиография
1. Занавескин Л.Н., Аверьянов В.А.//Экология и пром. России. 1999, июль, с. 12-17.
2. Занавескин Л.Н., Аверьянов В.А.//Хим. пром., 2002, № 9, с. 4-21.
3. Промышленные хлорорганические продукты. Справочник под ред. Л.А.Ошина. М.: Химия, 1978, 656 с.
4. Трегер Ю.А., Карташов Л.М., Кришталь Н.Ф. Основные хлорорганические растворители. М.: Химия, 1984, 224 с.
5. Mc Ketta J.J., Cunningham W.//Encyclopedia. Chem. Process, 1979.
6. Бернадинер М.Н.// Хим. пром. сегодня. 2004, № 7, с. 40-43.
7. Занавескин Л.Н., Конорев О.А., Аверьянов В.А.//Хим. пром., 2002, №2, с. 1-17.
8. Parvesse I.//Hydrocarbon Proc., 2000, V. 79, N 8, P. 85-92.
9. Платэ Н.А., Колбановский Ю.А.//Химия в интересах устойчивого развития. 2000, № 8, с. 567-577.
10. Mastrell N.//Inform. Chimie. 1998, V. 398, P. 89-90.
11. Lago R.M., Green M.L.H. at al.//Appl. Catalysis B: Environmental. 1996, V. 8, P. 107-121.
12. Программа ОНН по окружающей среде. Реестр существующих в мире мощностей для уничтожения ПХБ. ЦМП. июль 2001 г., 72 с.
13. Zieva A., Banaszak T., Miller R.//Applied Catalysis A: General. 1995, V. 124, N 1, P. 47-57.
14. Карташов Л.М., Флид М.Р., Трегер Ю.А., Дасаева Г.С.//Хим. пром. сегодня. 2004, № 7, с. 33-39.
15. Пожарная опасность веществ и материалов. Справочник под ред. И.В.Рябова. М.: Изд. лит-ры по строительству. 1966, 243 с.
16. Borisov Y.A., Arcia E.E., Mielke S.L., Garrett B.C., Dunning T.H.//J. Phys. Chem. A 2001, V. 105, N 32, P. 7724-7736.
17. Weiss U., Rosynek M.P., Runsford J.//Chem. Commun. 2000, N 5, P. 405-406.
18. Jeffers P.M., Ward L.M., Woytowitch L.M., Wolf N.L.//Environ. Sci. Technol. 1989, V. 23, N 8, P. 965-969.
19. Заявка 91-194792 Японии.//Jap. Pat. Abstr. 1991, N 40, P.E:2.
Европейская патентная заявка 0435210 от 03.07.1991 г.
20. Заявка 501501 Европы.//C.A. 1992, V.117, N 16, 153219.
Пат. 5196618 США.//РЖХим. 1994, 14Н24П.
21. Заявка 4-346944 Японии.//Jap. Pat. Gaz. 1993, N 3, P.E:1.
22. Заявка 2720740 Франции.//РЖХим. 1998, 13Н16П.
23. Розанов В.Н.//Хим. пром-сть. 1996, № 6, с.351-356.
24. Авт. св. 540857 СССР//Б.И. 1976, № 48, с. 68.
25. Розанов В.Н., Розловский А.И., Трегер Ю.А., Бабич Н.Ф.//Доклады АН СССР. 1983, Т.264, № 5, с.1126-1130.
26. Японский патент 6016578 от 25.01.1994.
27. Пат. 2979541 США.//РЖХим. 1962, 5Л70.
28. Пат. 3026361 США.//РЖХим. 1963, 13Н21
29. Пат. 2792435 США.//C.A. 1957, V.51, N 21, 16512d.
30. Пат. 2829180 США.//С.А. 1958, V.52, N 17, 14648c.
31. Голубева Е.Н., Смирнов В.В., Абдрашитов Я.М., Ростовщикова Т.Н.//IV Междунар. конф. «Наукоемкие хим. технологии». Волгоград. 1996, с.104-105.
Пат. 2107544; 2107678 РФ.
32. Заявка на пат. 2351565 ФРГ.
33. Занавескин Л.Н., Аверьянов В.А., Трегер Ю.А.//Усп. химии. 1996, Т.65, №7, с. 667.
34. Лунин В.В., Локтева Е.С.//Изв. АН. Сер. хим. 1996, №7, с. 1609-1624.
35. Пат. 3579596 США.//РЖХим. 1972, 8Н14П.
36. Kim S.Y., Choi H.C., Yanga O.B., Lee K.H., Lee I.S., Kim Y.G.//J. Chem. Soc. Chem. Commun. 1995, N 21, P.2169-2170.
37. Choi H.C., Choi S.H., Yang O.B., Lee I.S., Lee K.H., Kim Y.G.//J. Catal. 1996, V.161, N2, P.790-797.
38. Choi H.C., Choi S.H., Lee I.S., Lee K.H., Kim Y.G.//I. Catal. 1997, V.166, N 2, P.284.
39. Пат. 04 — 364136 Японии.//С.А. 1992, V.118, 254378.
40. Пат. 570050 Европы.//С.А. 1994, V.120, 106376.
41. Пат. 5105032 США.//РЖХим. 1994, 3Н14П.
42. Golubina E.V., Lokteva E.S., Lunin V.V., Turakulova A.O., Simagina V.I., Stoyanova I.V.//Applied Catalysis A: General. V. 241, N 1-2, P. 123-132.
43. WO 2005113137 от 01.12.2005 г.
44. Колбановский Ю.А., Чернышева А.С., Щипачев В.С.//Кинетика и катализ. 1988, Т.29, N 5, с.1222-1226.
45. Японский патент 2002191975 от 10.07.2002 г. (Европейский патент 1201300).
46. Дасаева Г.С., Величко С.М., Моисеев И.И., Трегер Ю.А.// Кинетика и катализ. 1990, Т.31, N 4, с.858-862.
47. Дасаева Г.С., Трегер Ю.А., Моисеев И.И. Занавескин Л.Н.//Хим. пром-сть. 1996, N 6, с.16-20.
48. Пат. 4138141 ФРГ.//РЖХим. 1994, 8Н10П.
49. Пат. 652195 Европы.//C.A. 1995, 122:317406.
50. Заявка 91 9827 РСТ.//ИСМ. 1992, Вып. 41, N 12, с.14;
51. Gomez-Sainero L.M., Cortes A., Seoane X.L., Arcoya A.//Ind. Eng. Chem. Res. 2000, V. 39, N 8, P. 2849-2854.
52. Gomez-Sainero L.M., Seoane X.L., Tijero E., Arcoya A.//Chemical Engineering Science. 2002, V. 57, N 17, P. 3565-3574.
53. Антонов В.Н., Рожков В.И., Заликин А.А.//Ж. прикл. химии. 1987, Т.60, N 6, с.1347-1352.
54. Пат. 5315050 США.//РЖХим. 1995, 17Н14П.
55. Абдрашитов Я.М. Дисс. в виде научного доклада на д.т.н. М. 1998 г.
56. Японский патент 7002708 от 06.01.1995. (Европейский патент 0613874).
57. Kirk-Оthmer//Encycl. Chem. Process. 1979, Vol.5, P.668-714.
58. Faith W.H., Clark R.L., Keyes D.B. Industrial Chemicals. 1957.
59. Doong R.-A., Chen K.-T., Tsai H.-C.//Environmental Science and Technology. 2003, T. 37, N 11, P. 2575.
60. Boronina T.N., Klabunde K.J., Sergeev G.B.//Mendeleev Communications. 1998, V. 8, N 4, P. 154-155.
61. Методы элементоорганической химии. Хлоралифатические соединения. М.: Наука. 1973, 750 с.
62. Suppan F.W.//Chemie-Umwelt Technik. 1991, N 20, S.101-102.
63. Пат. 5208393 США.
64. Заявка 91-194792 Японии.//Jap. Pat. Abstr. 1991, N 40, P.E:2.
65. Заявка 501501 Европы.//C.A. 1992, V.117, N 16, 153219.
66. Пат. 5196618 США.//РЖХим. 1994, 14Н24П.
Таблица 1. Взаимодействие ЧХУ с метаном
http://helpiks.org/9-26924.html
http://www.newchemistry.ru/letter.php?n_id=1225