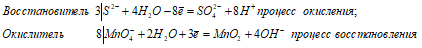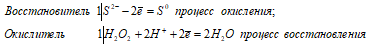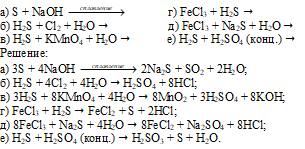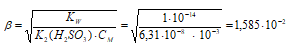Гидроксид натрия: способы получения и химические свойства
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия :
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Качественная реакция
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид натрия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
Сера взаимодействует с гидроксидом натрия только при нагревании:
6. Гидроксид натрия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксид натрия в расплаве подвергается электролизу . При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Напишите уравнения реакции взаимодействия сероводородной кислоты с недостатком и с избытком гидроксида натрия. Назовите образующиеся
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,292
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,160
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Характеристика окислительно-восстановительных свойств серы на примере сероводорода и оксида серы Ⅳ
Задача 855.
Какие свойства проявляет сероводород при взаимодействии с водными растворами КМnO4, Н2O2, NaОН?
Решение:
а) При взаимодействии с водным раствором перманганата калия сероводород проявляет свойства восстановителя, окисляясь при этом S-2 до S+6:
Уравнения ионно-молекулярного баланса:
3S 2- + 8MnO4 — + 28H2O = 3SO4 2- + 8MnO2 + 24H + + 32OH —
После приведения членов в обеих частях равенства, получим:
3S 2- + 8MnO 4 — + 4H 2 O = 3SO 4 2- + 8MnO 2 +8 OH —
б) При взаимодействии с пероксидом водорода сероводород проявляет свойства восстановителя, окисляясь при этом S -2 до S 0 :
Уравнения ионно-молекулярного баланса:
в) С гидроксидом натрия сероводород проявляет свойства кислоты, вступает в реакцию нейтрализации:
Задача 856.
Закончить уравнения реакций:
Задача 857.
Привести примеры реакций получения SO2, которые: а) сопровождаются изменением степени окисленности серы; б) не сопровождаются изменением степени окисленности серы.
Решение:
а) Примеры реакций получения SO2, сопровождающиеся изменением степени окисления серы:
Здесь сера выступает в качестве восстановителя, повышая свою степень окисления от 0 до +4;
Здесь сера выступает в качестве восстановителя, повышая свою степень окисления от -2 до +4.
б) Пример реакции получения SO2, не сопровождающийся изменением степени окисления серы:
Задача 858.
Какова реакция среды в растворах Na2SO3 и NaHSO3? Вычислить рH 0,001 М раствора Na2SO3.
Решение:
1). Na2SO3 — средняя соль, а NaHSO3 – кислая соль сильного основания (гидроксида натрия) и слабой кислоты (угольной кислоты), которые гидролизуются по аниону:
а) Na2SO3 ↔ 2Na + + SO3 2-
I ступень SO3 2- + Н2О ↔ HSO3 — + OH — (ионно-молекулярная форма);
Na 2 SO 3 + Н2О ↔ NaНSO3 + NaOH (молекулярная форма).
II ступень HSO3 — + Н2О ↔ Н2SO3 + OH — (ионно-молекулярная форма);
NaНSO3 + Н2О ↔ Н2SO3 + NaOH (молекулярная форма).
Преимущественно соль гидролизуется по первой ступени. При гидролизе образуется избыток ионов ОН-, которые придают раствору основную среду, рН > 7.
б) NaHSO3 ↔ Na + + НSO3 —
НSO3 — +Н2О ↔ H2SO3 + OH — (ионно-молекулярная форма);
NaНSO3 + Н2О ↔ Н2SO3 + NaOH (молекулярная форма).
Таким образом, гидролиз Na 2 SO 3 и NaHSO3 протекает по аниону с образованием избытка гидроксид-ионов, что придаёт раствору основную среду.
2). Рассчитаем рН 0,001 М раствора Na 2 SO 3.
Рассчитаем концентрацию ионов ОН-, получим:
[OH — ] = β . CM = (1,585 . 10 -2 ) . 10 -3 = 1,585 . 10 -5 моль/л.
Рассчитаем рОН раствора, получим:
рОН = -lgOH = -lg1,585 . 10-5 = 5 — lg1,585 = 5 – 0,20 = 4,8
http://www.soloby.ru/1068568/%D0%B2%D0%B7%D0%B0%D0%B8%D0%BC%D0%BE%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D0%B8%D1%8F-%D1%81%D0%B5%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D0%BE%D0%B9-%D0%BD%D0%B5%D0%B4%D0%BE%D1%81%D1%82%D0%B0%D1%82%D0%BA%D0%BE%D0%BC-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D1%83%D1%8E%D1%89%D0%B8%D0%B5%D1%81%D1%8F
http://buzani.ru/zadachi/khimiya-glinka/1280-okislitelno-vosstanovitelnye-svojstva-sery-zadachi-855-858