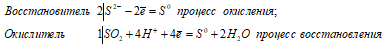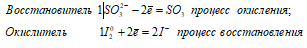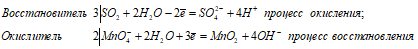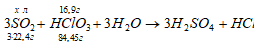H2s s so2 so3 al2s3 уравнение реакций
Вопрос по химии:
Напишите уравнения реакций, С помощью которых можно осуществить следующие превращения:
H2S ← S → SO2 → SO3
↓
Al2S3
Помогите пожалуйста
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
1) H2+S=H2S
2) 2Al(OH)3 + 3H2S=Al2S3 + 6H2O
3) S + O2 = SO2 или S + 2H2SO4 = 2H2O + 3SO2
4)SO2 + O3 = SO3 + O2
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Самостоятельная работа по химии. Генетические цепочки сера и ее соединения.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Самостоятельная работа. 9 класс.
Сера. Соединения серы ( II ), ( IV ), ( VI ).
Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 920 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 36 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 585 137 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 14.06.2017
- 3223
- 22
- 14.06.2017
- 2069
- 2
- 14.06.2017
- 2784
- 6
- 14.06.2017
- 3755
- 11
- 14.06.2017
- 8813
- 151
- 14.06.2017
- 1621
- 29
- 14.06.2017
- 2277
- 3
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.06.2017 12496
- DOCX 51.5 кбайт
- 229 скачиваний
- Рейтинг: 3 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Микурова Ольга Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 4 месяца
- Подписчики: 0
- Всего просмотров: 64161
- Всего материалов: 16
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
Минпросвещения упростит процедуру подачи документов в детский сад
Время чтения: 1 минута
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Характеристика окислительно-восстановительных свойств диоксида серы и сернистой кислоты
Задача 859.
Дать характеристику окислительно-восстановительных свойств диоксида серы и сернистой кислоты. Ответ подтвердить примерами.
Решение:
Сера в SO2 и H2SO3 находится в своей промежуточной степени окисления +4, поэтому SO2 и H2SO3 могут проявлять как восстановительные, так и окислительные
свойства.
а) Сера как восстановитель
Здесь степень окисления серы повышается от +4 до +6.
б) Сера как окислитель
Здесь степень окисления серы понижается от +4 до 0.
Задача 860.
Закончить уравнения реакций:
а) H2S + SO2 ↔ ;
б) H2SO3 + I2 ↔ ;
в) KMnO4 + SO2 + H2O ↔ ;
г) HIO3 + H2SO3 ↔ .
Указать, какие свойства проявляют в каждой из этих реакций диоксид серы или сернистая кислота.
Решение:
а) H2S + SO2 ↔ 3S↓ + 2H2O
Уравнения ионно-молекулярного баланса:
2S 2- + SO2 + 4H + = 3S 0 + 2H2O
Таким образом, диоксид серы проявляет свойства окислителя, а сероводород — восстановителя.
Таким образом, сернистая кислота проявляет свойства восстановителя.
3SO2 + 2MnO4 — + 10H2O = 3SO4 2- + 2MnO2 + 12H + + 8OH —
Таким образом, диоксид серы проявляет свойства восстановителя.
Восстановитель 3|6|SO3 2- + H2O — 2e = SO4 2- + 2H + процесс окисления
Окислитель 1|2|IO3 — + 6H + + 6e = I — + 3H2O процесс восстановления
3SO3 2- + IO3 — + 3H2O + 6H + ↔ 3SO4 2- + I — + 6H + + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя.
Задача 861.
Какие из перечисленных осушителей можно использовать для удаления влаги из SO2: Н2SO4(конц.), КОН(к.), Р2O5(к.), К2CO3(к.)?
Решение:
а) Н2SO4(конц.) бурно реагирует с водой с образованием гидратов, в основном моногидратов:
б) SO2 как кислотный оксид реагирует с кристаллическим КОН с образованием кислой соли:
в) SO2 как кислотный оксид реагирует с кристаллическим К2СО3 с образованием соли сернистой кислоты и диоксида углерода:
г) Р2О5 бурно реагирует с водой с образованием фосфорной кислоты:
Таким образом, Н2SO4(конц.) и Р2О5 можно применить для осушения SO2.
Задача 862.
Сколько литров SO2, взятого при нормальных условиях, надо пропустить через раствор НСIО3, чтобы восстановить 16,9 г ее до НСI?
Решение:
Уравнение реакции имеет вид:
Рассчитаем объем SO2, необходимый для восстановления HCO3 из пропорции:
84,45 : (3 . 22,4) = 16,9 : x; x = [16,9 . (3 . 22,4)]/84,45 = 13,45 л.
Ответ: V(SO2) = 13,45 л.
http://infourok.ru/samostoyatelnaya-rabota-po-himii-geneticheskie-cepochki-sera-i-ee-soedineniya-1977451.html
http://buzani.ru/zadachi/khimiya-glinka/1281-dioksid-sery-i-sernistaya-kislota-zadachi-859-862