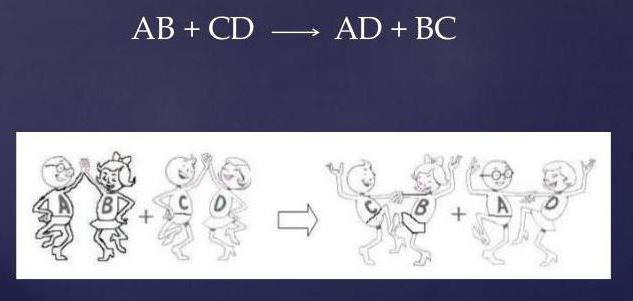
Реакция взаимодействия CaCl2, H2SO4
Одним из камней преткновения на первых шагах изучения химических закономерностей и основ является написание химических реакций. Поэтому вопросы о взаимодействии CaCl2, H2SO4 встречаются даже не периодически, а систематически. Разберем основные «проблемные» моменты.
Запись молекулярного уравнения
Взаимодействие между хлоридом кальция (соль) и серной кислотой протекает по обменному механизму.
- два соединения на входе (исходные вещества);
- два соединения на выходе (продукты);
- полное отсутствие простых веществ.
Обмениваясь друг с другом реакционными группами, реагенты видоизменяются, а уравнение принимает вид:
CaCl2 + H2SO4 = CaSO4 + 2HCl.
Как видно, два сложных вещества, меняясь ионами, образуют совершенно иные соединения: новую соль (CaSO4) и соляную кислоту (HCl).
Возможность протекания до конца
Ответить на сей вопрос можно запросто, записав для CaCl2, H2SO4 уравнение реакции в молекулярном виде. От вида продуктов и будет всё зависеть. До конца процесс идет в случае образования:
- труднорастворимого вещества (осадка);
- летучего соединения (газа);
- малодиссоциирущего реагента (воды, слабого электролита).
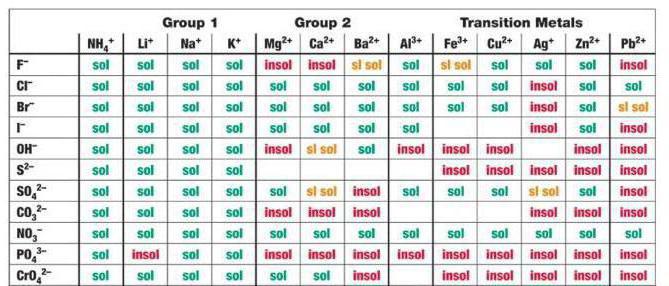
В рассматриваемом для CaCl2, H2SO4 случае среди продуктов реакции имеется сульфат кальция – малорастворимое соединение, выпадающее в осадок, согласно таблице.
Следовательно, обменный процесс пройдет до конца.
Сокращенная ионная форма записи между CaCl2, H2SO4
Расписав все растворимые соединения на ионы и сократив повторяющиеся реакционные группы, получим два искомых уравнения:
- полная ионная форма записи между CaCl2, H2SO4
ca 2+ + 2cl — + 2h + + so4 2- = caso4 + 2h + + 2cl —
- сокращенный вид уравнения
Следует помнить, что на ионы расписываются только растворимые соли, кислоты, основания (это легко определяется по специальным таблицам). Слабые электролиты типа угольной или уксусной кислоты всегда пишутся в молекулярной форме.
Теперь вы знаете, как происходит взаимодействие между хлоридом кальция (соль) и серной кислотой.
H2so4 cacl2 ионное уравнение и молекулярное
Реакции ионного обмена, протекающие между растворами солей
I. Запишем уравнение реакции между растворами карбоната натрия и хлорида кальция.
В результате этого взаимодействия образуется осадок карбоната кальция и хлорид натрия.
Рис. 1. Осадок карбоната кальция
Na 2CO 3 +CaCl 2 = CaCO 3 ↓ + 2NaCl — молекулярное уравнение
Рассмотрим сущность данной реакции обмена. Вы знаете, что карбонат натрия в воде диссоциирует на два катиона натрия и карбонат-анион.
Хлорид кальция в воде также диссоциирует на катион кальция и хлорид — анионы.
В ходе реакции осуществляется обмен ионами, приводящий к образованию осадка карбоната кальция.
2Na + + CO3 2- + Ca 2+ + 2Cl — = CaCO 3 ↓ + 2Na + + 2Cl — — полное ионное уравнение.
Ca 2+ + CO 3 2- = CaCO 3 ↓ – сокращённое ионное уравнение
Химические реакции, протекающие в растворах с участием свободных ионов, называются ионными реакциями.
Запись уравнения реакции с участием ионов называют уравнением в ионной форме (ионное уравнение)
II. Запишем ещё одно уравнение химической реакции, приводящей к образованию осадка карбоната кальция.
При взаимодействии карбоната натрия с нитратом кальция образуется осадок карбоната кальция и нитрат натрия. Запишем уравнение в молекулярной форме:
Na 2CO 3 +Ca(NO 3) 2 = CaCO 3 ↓ + 2NaNO 3 — молекулярное уравнение
Запишем уравнение в ионной форме:
2Na + + CO 3 2- + Ca 2+ + 2NO 3 — = CaCO 3 ↓ + 2Na + + 2 NO 3 — – полное ионное уравнение
Ca 2+ + CO 3 2- = CaCO 3 ↓ – сокращённое ионное уравнение
Обратите внимание: суть обеих реакций взаимодействия карбоната натрия с нитратом кальция и с хлоридом кальциям сводится к тому, что из катиона кальция и карбонат — аниона образуется нерастворимый карбонат кальция.
Теперь мы видим, что для получения карбоната кальция надо взять такие вещества, чтобы в состав одного вещества входили катионы кальция, а в состав другого – карбонат — ионы.
Сущность реакции ионного обмена отражают с помощью сокращённого ионного уравнения.
Образование осадка сульфата бария
Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
Запишем уравнение реакции между сульфатом калия и хлоридом бария в молекулярном виде, в сокращённом ионном виде и в полном ионном виде.
K 2SO 4 +BaCl 2 = BaSO 4 ↓ + 2KCl – молекулярное уравнение
При взаимодействии сульфата калия и хлоридом бария образуется осадок сульфата бария и хлорид калия. Это молекулярная форма уравнения.
Ниже записана полная ионная форма.
2K + + SO 4 2- + Ba 2+ + 2Cl — = BaSO 4 ↓ + 2K + + 2Cl — – полное ионное уравнение
Если мы зачеркнём слева и справа одинаковые ионы, то получим сокращённое ионное уравнение.
Ba 2+ + SO 4 2- = BaSO 4 ↓ – сокращённое ионное уравнение
Таким образом, для получения сульфата бария необходимо, чтобы в состав одного вещества входили катионы бария, а в состав другого – сульфат – анионы.
1. Какой из приведенных реакций не соответствует сокращенное ионное уравнение: Ba 2+ + SO4 2- = BaSO4?
Ответ: уравнению №2, т.к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH — + 2H + + SO4 2- = BaSO4 + 2H2O
2. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca 2+ + CO3 2- = CaCO3?
Ответ: уравнение №1, т.к. оба исходных вещества — растворимые соли, распадаются на ионы, а в продуктах реакции только одно вещество CaCO3выпадает в осадок
3. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
4. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
5. Какая пара ионов не может одновременно присутствовать в растворе?
Ответ: №2, т.к. ионы меди и сульфид-ионы образуют нерастворимую соль сульфид меди (II)
6. При сливании каких двух растворов в воде практически не остается ионов?
Ответ: №2, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O происходит связывание всех ионов с образованием осадка и воды
7. При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
Ответ: №1, т.к. NH4Cl + NaOH = NaCl + NH3 + H2O
Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения: а) HCl + Na2SO4 →
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,297
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,223
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://himi4ok.ucoz.ru/publ/9_klass/khimicheskaja_svjaz_ehlektroliticheskaja_dissociacija/reakcii_ionnogo_obmena/28-1-0-159
http://www.soloby.ru/468533/%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD%D1%87%D0%B8%D1%82%D0%B5-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BF%D1%80%D0%BE%D1%82%D0%B5%D0%BA%D0%B0%D1%8E%D1%89%D0%B8%D1%85-%D1%81%D0%BE%D0%BE%D1%82%D0%B2%D0%B5%D1%82%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D0%B5