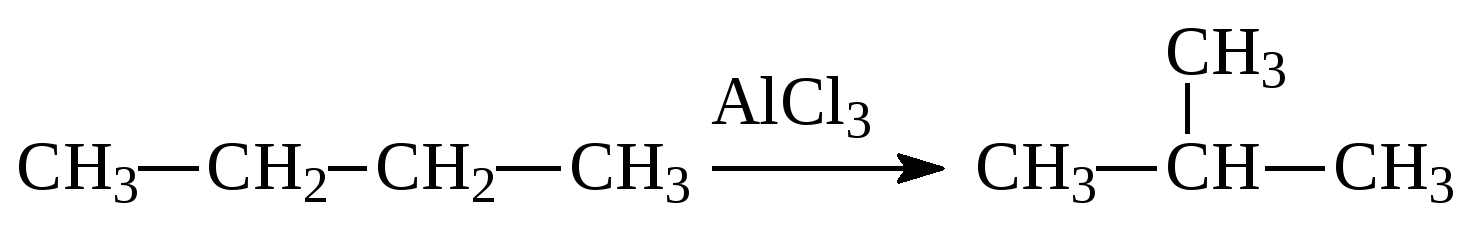Химические реакции
Контрольная работа по химии для 11 класса по теме «Химические реакции»
Просмотр содержимого документа
«Химические реакции»
Контрольная работа №2 «Химические реакции»
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO(т)+CO2(г)↔CaCO3(т)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
Дайте характеристику реакции, уравнение которой Fe203 + 2А1 = 2Fe + А1203 + Q, по всем известным признакам классификации. Рассмотрите данную реакцию с точки зрения ОВР.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Контрольная работа по химии (11 класс)
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
1. (2 балла). Характеристика реакции, уравнение которой 4Fe +6H2O +3O2 = 4Fe(OH)3:
А. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая. В. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая.
2.(2 балла). Какая масса угля вступает в реакцию, термохимическое уравнение которой С + О2 = СО2 + +402кДж, если при этом выделяется 1608 кДж теплоты?
3. (2 балла).Характеристика реакции, уравнение которой AlCl3

А. Дегидрирования, гомогенная, каталитическая. Б. Изомеризации, гомогенная, каталитическая. В. Полимеризации, гетерогенная, каталитическая. Г. Присоединения, гетерогенная, каталитическая.

А. N. Б. H. В. H. Г. N.
5. (2 балла). При повышении температуры на 30оС (температурный коэффициент γ = 3) скорость реакции увеличится: А В 3 раза. Б. В 9 раз. В. В 27 раз. Г. В 81 раз.

А. Повышение температуры и давления. Б. Понижение температуры и давления. В. Понижение температуры и повышение давления. Г. Повышение температуры и понижение давления.
7. (2 балла). Щелочную среду имеет водный раствор соли, формула которой: А. AlCl3. Б. KNO3. В. K2CO3. Г. FeCl3.
8. ( 2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
А. SO32+, K+, H+, SO42-. Б. Mg2+, Na+, Cl-, NO3-. В. Na+, Al3+, OH-, SO42-. 
9. (2 балла). Краткое ионное уравнение Ba2+ + SO42- = BaSO4 отображает взаимодействие серной кислоты и вещества: А. Бария. Б. Гидроксида бария. В. Нитрата бария. Г. Оксида бария.
10. (2 балла). Гидролизу не подвергается: А. Белок. Б. Сульфат цинка. В. Целлюлоза. Г. Этилен.
11. (8 баллов). Установите соответствие. Левая часть уравнения реакции в молекулярном виде:
1. Fe + 2HCl = 2. FeO + 2HCl = 3. Fe(OH)2 + 2HCl = 4. Fe(OH)3 + 3HCl =
Правая часть краткого ионного уравнения:

ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). Составьте уравнения реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам.
13. (6 баллов). Рассчитайте объём углекислого газа (н. у.), выделяющегося при взаимодействии 50г мрамора, содержащего 10% некарбонатных примесей, с избытком соляной кислоты.
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 1 2 3


Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)

1.(2 балла). Характеристика реакции, уравнение которой 2КСCl3 = 2КС1 + ЗО2 :
A. Реакция замещения, ОВР, обратимая. Б. Реакция разложения, ОВР, необратимая.
B. Реакция разложения, не ОВР, необратимая. Г. Реакция обмена, не ОВР, необратимая.
2. (2 балла). Какое количество теплоты выделится при взаимодействии 5,6 л водорода(н. у) с избытком хлора (термохимическое уравнение: Н2 + С12 = 2НС1 + 92,3 кДж)?
А. 2,3 кДж. В. 46 кДж.
Б. 23 кДж. Г. 230 кДж.
3. (2 балла). Характеристика реакции, уравнение которой СН3—СН2—С/Н3 СН3 – CH = СН2 + H2
A. Реакция дегидрирования, гомогенная, каталитическая.
Б. Реакция гидратации, гомогенная, каталитическая.
B. Реакция гидрирования, гетерогенная, каталитическая.
Г. Реакция дегидратации, каталитическая, гомогенная.

А. С. Б. С. В. О. Г. О.
5. (2 балла). Для увеличения скорости химической реакции в 64 раза (температурный коэффициент γ = 2) надо повысить температуру:
А На ЗО° С. Б. На 40 °С. В. На50°С. Г. На 60 °С.
6. (2 балла). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой

A. Повышение температуры и давления.
Б. Понижение температуры и давления.
B. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
7 (2 балла). Кислотную среду имеет раствор соли, формула которой: А. КСl. Б. ZnSO4. В. Na2CO3. Г. NaNO3.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. SO42-, Na+, ОН-, Ва2+. Б. Сu2+, К+, ОН-, С1-. B. .Н+, Na+, C1-, SO42-. Г. Н+, Са2+, NO3-, СО32-.

A. CuO. Б. CuS. B. CuCl. Г. СuС12.
10 (2 балла). Гидролизу подвергается:
А„ Ацетилен. Б. Нитрат калия. В. Целлюлоза. Г. Этанол.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1„ СаСО3 + 2НС1 = 3. Na2CO3 + СаС12 =
2. Na2CO3 + 2HC1 = 4. СаСО3 + Н2О + СО2 =



B. = Са2+ + CO2 + Н20.
ЧАСТЬ Б. Задания со свободным ответом
12 (6 баллов). Составьте уравнение реакции горения водорода. Дайте полную характеристику
данной химической реакции по всем изученным классификационным признакам.
13 (6 баллов). Какой объем ацетилена (н. у.) можно получить из 20 г технического карбида
кальция, содержащего 20% примесей?
14 (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения: 1 2 3


Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение

A. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая.
B. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая.
2. (2 балла). Какое количество теплоты необходимо для синтеза 67,2 л оксида азота (II) (термохимическое уравнение N2 + О2 = 2NO — 90,4 кДж) ?
А. 45,2 кДж. Б. 135,6 кДж. В. 180,8 кДж. Г. 226 кДж.
3 (2 балла). Характеристика реакции, уравнение которой

A. Дегидрирования, гомогенная, каталитическая.
Б. Изомеризации, гомогенная, каталитическая.
B. Полимеризации, гетерогенная, каталитическая.
Г. Присоединения, гомогенная, каталитическая.
4 (2 балла). Окислитель в реакции, уравнение которой 2А1 + Fe2O3 = А12О3 + 2Fe + Q:
А. А1. Б. А1. В. Fe. Г. Fe.
5 (2 балла). При повышении температуры на 30 °С (температурный коэффициент γ = 2) скорость реакции увеличится:
А. В 2 раза. Б. В 4 раза. В. В 6 раз. Г. В 8 раз.

A. Повышение температуры и давления.
Б. Понижение температуры и давления.
B. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
7 (2 балла). Щелочную среду имеет водный раствор соли, формула которой:
А. А1С13. Б. NaNO3. В. Na2S. Г. ВаС12.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. К+, Cu2+, C1-, ОН-. Б. Na+, Ва2+, ОН-, С1-. B. Са2+, Н+, СО32- , NO3-. Г. Н+, К+, S2-, SO42- .

A. Fe2O3. Б. FeCl2. В. FeCl3. Г. FePO4.
10 (2 балла). Гидролизу не подвергается:
А. Стеарат натрия. Б. Сульфат натрия. В. Целлюлоза. Г. Этилэтаноат.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1. CuO + H2SO4 = 3. Сu(ОН)2 + H2SO4 =
2. 
Правая часть краткого ионного уравнения:
A.= Сu2+ + Н2О. Б. = 2Сu+ + Н2О. B.= Сu2+ + 2Н2О. Г. = Cu2++H2O +SO2 Д. = Cu2++H2O + CO2
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). Составьте уравнение реакции взаимодействия растворов сульфата магния и хлорида бария. Дайте полную характеристику данной химической реакции по всем изученным классификационным признакам.
13. (6 баллов). Рассчитайте объем углекислого газа (н. у.), выделившегося при полном сгорании 5 л метана, содержащего 5% негорючих примесей.
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 1 2 3


Для перехода 3 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Характеристика реакции, уравнение которой 2А1 + Fe2O3 = 2Fe + А12О3:
A. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая.
B. Замещения, не ОВР, обратимая. Г. Обмена, не ОВР, необратимая.
2 (2 балла). Какой объем хлора вступает в реакцию, термохимическое уравнение которой
Н2 + С12 = 2НС1 + 92,3 кДж, если при этом выделяется 184,6 кДж теплоты?
А. 11,2 л. Б. 22,4 л. В. 33,6 л. Г. 44,8 л. H3PO4, t

А. Реакция гидратации, гомогенная, каталитическая.
Б. Реакция дегидратации, гомогенная, каталитическая.
В. Реакция гидрирования, гетерогенная, каталитическая.


A. N. Б. N. В. О. Г. О.
5 (2 балла). Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ = 2) надо повысить температуру:
А. На 20 °С. Б. На 30 °С. В. На 40 °С. Г. На 50 °С.
6 (2 балла). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой


A. Повышение температуры и давления. B. Понижение температуры и повышение давления.
Б. Понижение температуры и давления. Г. Повышение температуры и понижение давления.
7.(2 балла). Кислотную среду имеет раствор соли, формула которой:
А. ВаС12. Б. FeCl2. В. Na2SO3. Г. KNO3.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. SO32-, К+, SO42-, Н+. Б. Al3+, Na+, ОН-, С1-. B. . К+, Fe2+, ОН-, SO42-. Г. К+, Ва2+, ОН-, NO3-.
9 (2 балла). Для осуществления реакции, ионное уравнение которой СО32- + 2Н+ = Н2О + СО2
можно использовать раствор серной кислоты и вещество, формула которого:
А. СаСО3. Б. NaHCO3. В. Na2CO3. Г. MgCO3.
10 (2 балла). Гидролизу подвергается:
А. Глюкоза. Б. Глицерин. В. Жир. Г. Уксусная кислота.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1. Zn + 2HC1 = 3. Zn(OH)2 + 2HC1 =
2. ZnO + 2НС1 = 4. ZnCl2 + 4NaOH =
Правая часть краткого ионного уравнения: А. = Zn2+ + 2Н2О. Б. = Zn2+ + Н2О.

ЧАСТЬ Б. Задания со свободным ответом
12 (6 баллов). Составьте уравнение реакции разложения гидроксида железа (III). Дайте пол-
ную характеристику данной химической реакции по всем изученным классификационным
признакам.
13 (6 баллов). Какой объем оксида серы (IV) (н. у.) можно получить из 800 кг технической
серы, содержащей 10% примесей?
14 (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения: 1 2 3


Для перехода 2 составьте электронный баланс, укажите окислитель и восстановитель.
http://www.soloby.ru/471876/%D1%85%D0%B0%D1%80%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D1%81%D1%82%D0%B8%D0%BA%D1%83-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5-%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D1%8B%D0%BC-%D0%BA%D0%BB%D0%B0%D1%81%D1%81%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D0%B8-%D1%80%D0%B0%D1%81%D1%81%D0%BC%D0%BE%D1%82%D1%80%D0%B8%D1%82%D0%B5
http://pandia.ru/text/78/483/26425.php