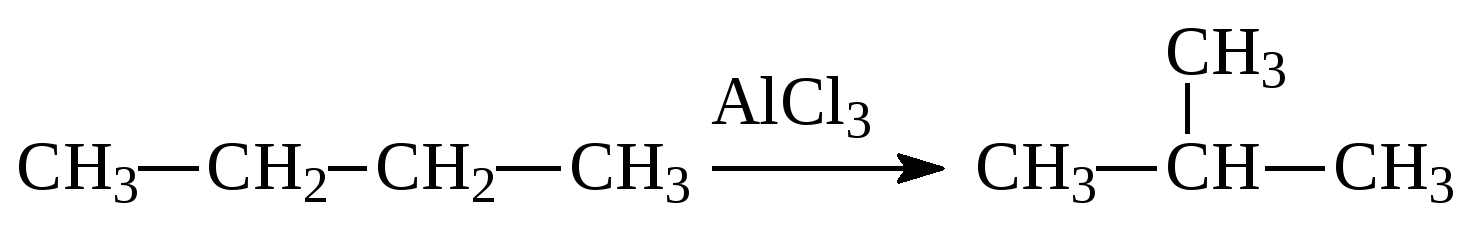Химические реакции
Контрольная работа по химии для 11 класса по теме «Химические реакции»
Просмотр содержимого документа
«Химические реакции»
Контрольная работа №2 «Химические реакции»
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO(т)+CO2(г)↔CaCO3(т)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
Контрольная работа по химии (11 класс)
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
1. (2 балла). Характеристика реакции, уравнение которой 4Fe +6H2O +3O2 = 4Fe(OH)3:
А. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая. В. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая.
2.(2 балла). Какая масса угля вступает в реакцию, термохимическое уравнение которой С + О2 = СО2 + +402кДж, если при этом выделяется 1608 кДж теплоты?
3. (2 балла).Характеристика реакции, уравнение которой AlCl3

А. Дегидрирования, гомогенная, каталитическая. Б. Изомеризации, гомогенная, каталитическая. В. Полимеризации, гетерогенная, каталитическая. Г. Присоединения, гетерогенная, каталитическая.

А. N. Б. H. В. H. Г. N.
5. (2 балла). При повышении температуры на 30оС (температурный коэффициент γ = 3) скорость реакции увеличится: А В 3 раза. Б. В 9 раз. В. В 27 раз. Г. В 81 раз.

А. Повышение температуры и давления. Б. Понижение температуры и давления. В. Понижение температуры и повышение давления. Г. Повышение температуры и понижение давления.
7. (2 балла). Щелочную среду имеет водный раствор соли, формула которой: А. AlCl3. Б. KNO3. В. K2CO3. Г. FeCl3.
8. ( 2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
А. SO32+, K+, H+, SO42-. Б. Mg2+, Na+, Cl-, NO3-. В. Na+, Al3+, OH-, SO42-. 
9. (2 балла). Краткое ионное уравнение Ba2+ + SO42- = BaSO4 отображает взаимодействие серной кислоты и вещества: А. Бария. Б. Гидроксида бария. В. Нитрата бария. Г. Оксида бария.
10. (2 балла). Гидролизу не подвергается: А. Белок. Б. Сульфат цинка. В. Целлюлоза. Г. Этилен.
11. (8 баллов). Установите соответствие. Левая часть уравнения реакции в молекулярном виде:
1. Fe + 2HCl = 2. FeO + 2HCl = 3. Fe(OH)2 + 2HCl = 4. Fe(OH)3 + 3HCl =
Правая часть краткого ионного уравнения:

ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). Составьте уравнения реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам.
13. (6 баллов). Рассчитайте объём углекислого газа (н. у.), выделяющегося при взаимодействии 50г мрамора, содержащего 10% некарбонатных примесей, с избытком соляной кислоты.
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 1 2 3


Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)

1.(2 балла). Характеристика реакции, уравнение которой 2КСCl3 = 2КС1 + ЗО2 :
A. Реакция замещения, ОВР, обратимая. Б. Реакция разложения, ОВР, необратимая.
B. Реакция разложения, не ОВР, необратимая. Г. Реакция обмена, не ОВР, необратимая.
2. (2 балла). Какое количество теплоты выделится при взаимодействии 5,6 л водорода(н. у) с избытком хлора (термохимическое уравнение: Н2 + С12 = 2НС1 + 92,3 кДж)?
А. 2,3 кДж. В. 46 кДж.
Б. 23 кДж. Г. 230 кДж.
3. (2 балла). Характеристика реакции, уравнение которой СН3—СН2—С/Н3 СН3 – CH = СН2 + H2
A. Реакция дегидрирования, гомогенная, каталитическая.
Б. Реакция гидратации, гомогенная, каталитическая.
B. Реакция гидрирования, гетерогенная, каталитическая.
Г. Реакция дегидратации, каталитическая, гомогенная.

А. С. Б. С. В. О. Г. О.
5. (2 балла). Для увеличения скорости химической реакции в 64 раза (температурный коэффициент γ = 2) надо повысить температуру:
А На ЗО° С. Б. На 40 °С. В. На50°С. Г. На 60 °С.
6. (2 балла). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой

A. Повышение температуры и давления.
Б. Понижение температуры и давления.
B. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
7 (2 балла). Кислотную среду имеет раствор соли, формула которой: А. КСl. Б. ZnSO4. В. Na2CO3. Г. NaNO3.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. SO42-, Na+, ОН-, Ва2+. Б. Сu2+, К+, ОН-, С1-. B. .Н+, Na+, C1-, SO42-. Г. Н+, Са2+, NO3-, СО32-.

A. CuO. Б. CuS. B. CuCl. Г. СuС12.
10 (2 балла). Гидролизу подвергается:
А„ Ацетилен. Б. Нитрат калия. В. Целлюлоза. Г. Этанол.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1„ СаСО3 + 2НС1 = 3. Na2CO3 + СаС12 =
2. Na2CO3 + 2HC1 = 4. СаСО3 + Н2О + СО2 =



B. = Са2+ + CO2 + Н20.
ЧАСТЬ Б. Задания со свободным ответом
12 (6 баллов). Составьте уравнение реакции горения водорода. Дайте полную характеристику
данной химической реакции по всем изученным классификационным признакам.
13 (6 баллов). Какой объем ацетилена (н. у.) можно получить из 20 г технического карбида
кальция, содержащего 20% примесей?
14 (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения: 1 2 3


Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение

A. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая.
B. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая.
2. (2 балла). Какое количество теплоты необходимо для синтеза 67,2 л оксида азота (II) (термохимическое уравнение N2 + О2 = 2NO — 90,4 кДж) ?
А. 45,2 кДж. Б. 135,6 кДж. В. 180,8 кДж. Г. 226 кДж.
3 (2 балла). Характеристика реакции, уравнение которой

A. Дегидрирования, гомогенная, каталитическая.
Б. Изомеризации, гомогенная, каталитическая.
B. Полимеризации, гетерогенная, каталитическая.
Г. Присоединения, гомогенная, каталитическая.
4 (2 балла). Окислитель в реакции, уравнение которой 2А1 + Fe2O3 = А12О3 + 2Fe + Q:
А. А1. Б. А1. В. Fe. Г. Fe.
5 (2 балла). При повышении температуры на 30 °С (температурный коэффициент γ = 2) скорость реакции увеличится:
А. В 2 раза. Б. В 4 раза. В. В 6 раз. Г. В 8 раз.

A. Повышение температуры и давления.
Б. Понижение температуры и давления.
B. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
7 (2 балла). Щелочную среду имеет водный раствор соли, формула которой:
А. А1С13. Б. NaNO3. В. Na2S. Г. ВаС12.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. К+, Cu2+, C1-, ОН-. Б. Na+, Ва2+, ОН-, С1-. B. Са2+, Н+, СО32- , NO3-. Г. Н+, К+, S2-, SO42- .

A. Fe2O3. Б. FeCl2. В. FeCl3. Г. FePO4.
10 (2 балла). Гидролизу не подвергается:
А. Стеарат натрия. Б. Сульфат натрия. В. Целлюлоза. Г. Этилэтаноат.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1. CuO + H2SO4 = 3. Сu(ОН)2 + H2SO4 =
2. 
Правая часть краткого ионного уравнения:
A.= Сu2+ + Н2О. Б. = 2Сu+ + Н2О. B.= Сu2+ + 2Н2О. Г. = Cu2++H2O +SO2 Д. = Cu2++H2O + CO2
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). Составьте уравнение реакции взаимодействия растворов сульфата магния и хлорида бария. Дайте полную характеристику данной химической реакции по всем изученным классификационным признакам.
13. (6 баллов). Рассчитайте объем углекислого газа (н. у.), выделившегося при полном сгорании 5 л метана, содержащего 5% негорючих примесей.
14. (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 1 2 3


Для перехода 3 составьте электронный баланс, укажите окислитель и восстановитель.
Контрольная работа по химии (11 класс)
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Характеристика реакции, уравнение которой 2А1 + Fe2O3 = 2Fe + А12О3:
A. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая.
B. Замещения, не ОВР, обратимая. Г. Обмена, не ОВР, необратимая.
2 (2 балла). Какой объем хлора вступает в реакцию, термохимическое уравнение которой
Н2 + С12 = 2НС1 + 92,3 кДж, если при этом выделяется 184,6 кДж теплоты?
А. 11,2 л. Б. 22,4 л. В. 33,6 л. Г. 44,8 л. H3PO4, t

А. Реакция гидратации, гомогенная, каталитическая.
Б. Реакция дегидратации, гомогенная, каталитическая.
В. Реакция гидрирования, гетерогенная, каталитическая.


A. N. Б. N. В. О. Г. О.
5 (2 балла). Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ = 2) надо повысить температуру:
А. На 20 °С. Б. На 30 °С. В. На 40 °С. Г. На 50 °С.
6 (2 балла). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой


A. Повышение температуры и давления. B. Понижение температуры и повышение давления.
Б. Понижение температуры и давления. Г. Повышение температуры и понижение давления.
7.(2 балла). Кислотную среду имеет раствор соли, формула которой:
А. ВаС12. Б. FeCl2. В. Na2SO3. Г. KNO3.
8 (2 балла). Формулы группы ионов, которые могут одновременно существовать в растворе:
A. SO32-, К+, SO42-, Н+. Б. Al3+, Na+, ОН-, С1-. B. . К+, Fe2+, ОН-, SO42-. Г. К+, Ва2+, ОН-, NO3-.
9 (2 балла). Для осуществления реакции, ионное уравнение которой СО32- + 2Н+ = Н2О + СО2
можно использовать раствор серной кислоты и вещество, формула которого:
А. СаСО3. Б. NaHCO3. В. Na2CO3. Г. MgCO3.
10 (2 балла). Гидролизу подвергается:
А. Глюкоза. Б. Глицерин. В. Жир. Г. Уксусная кислота.
11 (8 баллов). Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
1. Zn + 2HC1 = 3. Zn(OH)2 + 2HC1 =
2. ZnO + 2НС1 = 4. ZnCl2 + 4NaOH =
Правая часть краткого ионного уравнения: А. = Zn2+ + 2Н2О. Б. = Zn2+ + Н2О.

ЧАСТЬ Б. Задания со свободным ответом
12 (6 баллов). Составьте уравнение реакции разложения гидроксида железа (III). Дайте пол-
ную характеристику данной химической реакции по всем изученным классификационным
признакам.
13 (6 баллов). Какой объем оксида серы (IV) (н. у.) можно получить из 800 кг технической
серы, содержащей 10% примесей?
14 (10 баллов). Напишите уравнения реакций, при помощи которых можно осуществить сле-
дующие превращения: 1 2 3


Для перехода 2 составьте электронный баланс, укажите окислитель и восстановитель.
Презентация на тему «Химические реакции»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Х–11 Контрольная работа №2 «Химические реакции» Вариант №1
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание.
А1. Характеристика реакции, уравнение которой 4 Fe + 6 H 2 O + 3 O 2 →4 Fe ( OH )3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Окислитель в реакции синтеза аммиака, уравнение которой N 2 + 3 H 2 = 2 NH 3 + Q
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO (т)+ CO 2(г)↔ CaCO 3(т)+ Q , в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
4 балла за верно выполненное задание.
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
В2. Установите соответствие между солью и реакцией среды раствора
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Отношение к гидролизу
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
Для задания С1 дайте полный развернутый ответ.
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
С2(4 балла). Вычислите рН раствора, в котором концентрация ионов ОН – (в моль/л) равна 1•10 –7 ..
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Х–11 Контрольная работа №2 «Химические реакции» Вариант №2
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание.
А1. Характеристика реакции, уравнение которой 4 KClO 3 → 2 KCl + 3 O 2:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты выделится при взаимодействии 5,6 л водорода и избытком хлора. Термохимическое уравнение Н2+С l 2 = 2 HCl + 92,3 кДж.
1) 2,3 кДж 2) 23 кДж 3) 46 кДж 4) 230 кДж
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Восстановитель в реакции, уравнение которой 2СО + О2 = 2СО2 + Q
1) С +2 2) С +4 3) О 0 4) О –2
А5. Для увеличения скорости химической реакции в 64 раза (температурный коэффициент равен 2) надо повысить температуру
1) на 30 °С 2) на 40 °С 3) на 50 °С 4) на 60 °С
А6. Факторы, позволяющие сместить химическое равновесие, для реакции 2 NO (г)+ O 2(г)↔2 NO 2(г)+ Q , в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Кислую среду имеет водный раствор соли, формула которой:
А8. К неэлектролитам относится:
А9. Газ образуется при взаимодействии серной кислоты с:
1) AgNO 3 2) NaOH 3) ZnS 4) Na 2 SO 4
А10. Гидролизу не подвергается:
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
4 балла за верно выполненное задание.
В1. Установите соответствие между схемой ОВР и формулой восстановителя в ней:
А ) Cl 2 + KOH = KCl + KClO + H 2 O
В2. Установите соответствие между солью и реакцией среды раствора
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Отношение к гидролизу
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
Для задания С1 дайте полный развернутый ответ.
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
С2( 4 балла). Вычислите рН раствора, в котором концентрация ионов ОН – (в моль/л) равна 5•10 –6 .
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Х–11 Контрольная работа №2 «Химические реакции» Вариант №3
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание.
А1. Характеристика реакции, уравнение которой N 2 + 3 H 2→ 2 NH 3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты необходимо для синтеза 67,2 л оксида азота ( II ). Термохимическое уравнение N 2+ O 2 = 2 NO – 90,4 кДж.
1) 45,2 кДж 2) 135,6 кДж 3) 180,8 кДж 4) 226 кДж
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Окислитель в реакции, уравнение которой 2 Al + Fe 2О3 = Al 2О3 + 2 Fe + Q
1) Al 0 2) Al +3 3) Fe 0 4) Fe +3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 2) скорость реакции увеличится в:
1) 2 раза 2) 4 раза 3) 6 раз 4) 8 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции 2 SO 2(г)+ O 2(г)↔2 SO 2(г)+ Q , в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. К неэлектролитам относится:
А9. Осадок образуется при взаимодействии сульфата цинка с:
1) AgNO 3 2) NaOH 3) ZnS 4) Na 2 SO 4
А10. Гидролизу не подвергается:
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
4 балла за верно выполненное задание.
В1. Установите соответствие между схемой ОВР и формулой окислителя в ней:
В2. Установите соответствие между солью и реакцией среды раствора
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Отношение к гидролизу
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
Для задания С1 дайте полный развернутый ответ.
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
С2(4 балла). Вычислите рН раствора, в котором концентрация ионов ОН – (в моль/л) равна 2•10 –9 .
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Для перехода 3 составьте полное и сокращенное ионное уравнение.
Х–11 Контрольная работа №2 «Химические реакции» Вариант №4
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание.
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какой объем хлора вступает в реакцию, термохимическое уравнение которой Н2+С l 2 = 2 HCl + 92,3 кДж, если при этом выделилось 184,6 кДж теплоты?
1) 11,2 л 2) 22,4 л 3) 33,6 л 4) 44,8 л
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Восстановитель в реакции, уравнение которой 2 KN О3 = 2 KNO 2 + O 2
1) N +3 2) N +5 3) O 0 4) O –2
А5. Для увеличения скорости химической реакции в 32 раза (температурный коэффициент равен 2) надо повысить температуру
1) на 20 °С 2) на 30 °С 3) на 40 °С 4) на 50 °С
А6. Факторы, позволяющие сместить химическое равновесие, для реакции 4 NH 3(г)+5 O 2(г)↔4 NO +6 H 2 O (г)+ Q , в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Кислую среду имеет водный раствор соли, формула которой:
А8. К неэлектролитам относится:
А9. Газ образуется при взаимодействии азотной кислоты с:
А10. Гидролизу не подвергается:
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
4 балла за верно выполненное задание.
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
В2. Установите соответствие между солью и реакцией среды раствора
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Отношение к гидролизу
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
Для задания С1 дайте полный развернутый ответ.
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
С2(4 балла). Вычислите рН раствора, в котором концентрация ионов ОН – (в моль/л) равна 4•10 –2 .
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Для перехода 3 составьте полное и сокращенное ионное уравнение.
Ответы к Варианту №1
Окислитель — H 2 SO 4 Восстановитель — KI
[ H + ]•[ OH – ] = 10 –14
[ H + ] = 10 –14 /[О H – ] = 10 –14 /10 –7 = 10 –7
pH = –lg[H + ] = –lg 10 –7 = 7
Ответы к Варианту № 2
Окислитель — KMnO 4 Восстановитель — Na 2 SO 3
[ H + ]•[ OH – ] = 10 –14
[ H + ] = 10 –14 /[О H – ] = 10 –14 /5•10 –6 = 0 ,2•10 –8
pH = –lg[H + ] = –lg0 ,2•10 –8 = 8– lg0 ,2
Ответы к Варианту №3
Окислитель — HClO 3 Восстановитель — P
[ H + ]•[ OH – ] = 10 –14
[ H + ] = 10 –14 /[О H – ] = 10 –14 /2•10 –9 = 0 ,5•10 –5
pH = –lg[H + ] = –lg0 ,5•10 –5 = 5– lg0 ,5
Ответы к Варианту № 4
Окислитель — KMnO 4 Восстановитель — NH 3
[ H + ]•[ OH – ] = 10 –14
[ H + ] = 10 –14 /[О H – ] = 10 –14 /4•10 –2 = 
pH = –lg[H + ] = –lg 
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 924 человека из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 578 869 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 24.08.2015
- 999
- 2
- 24.08.2015
- 2960
- 47
- 24.08.2015
- 2194
- 9
- 24.08.2015
- 696
- 0
- 24.08.2015
- 419
- 1
- 24.08.2015
- 1476
- 0
- 24.08.2015
- 1816
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 24.08.2015 15168
- DOCX 317 кбайт
- 20 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Агаева Ульвия Ариф. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 6 месяцев
- Подписчики: 0
- Всего просмотров: 17334
- Всего материалов: 5
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://pandia.ru/text/78/483/26425.php
http://infourok.ru/prezentaciya-na-temu-himicheskie-reakcii-384790.html