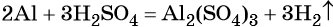Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
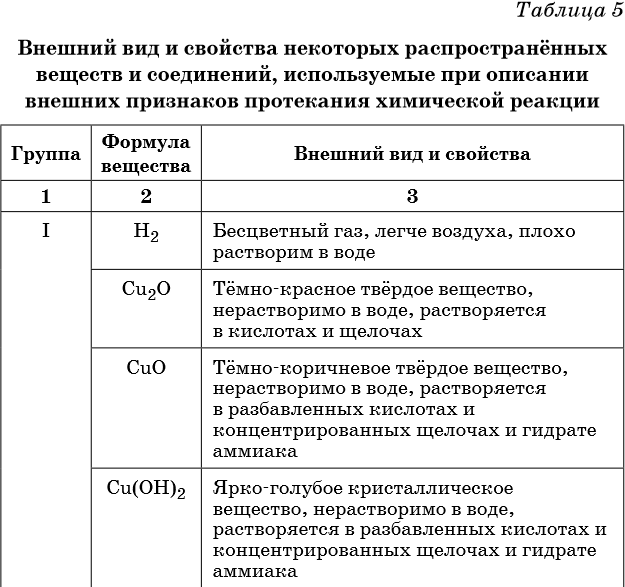
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
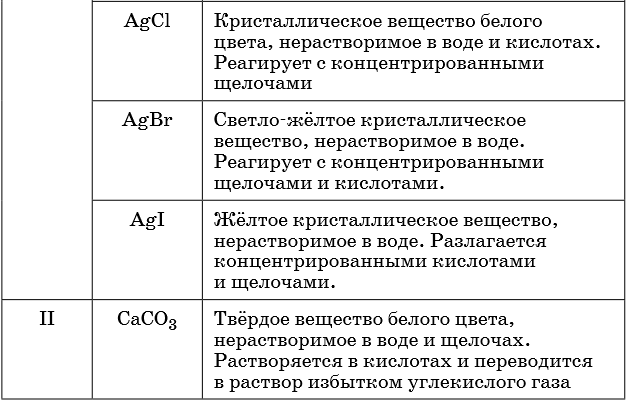
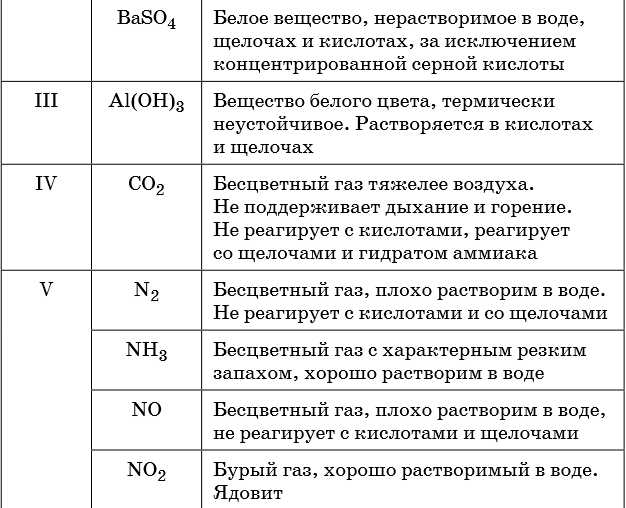
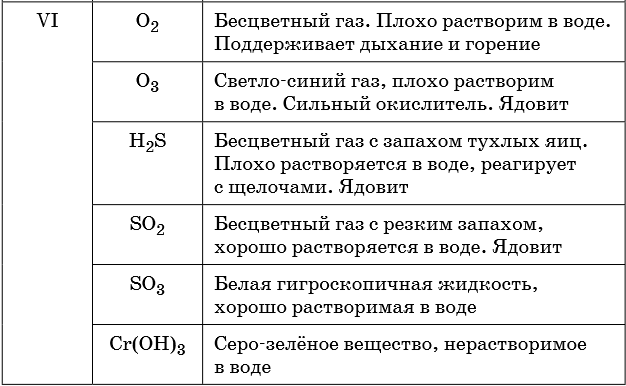
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Характеристика химических реакций
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Мир химических реакций очень разнообразен, чтобы в нем ориентироваться, необходимо научиться характеризовать химические реакции. Данный урок посвящен изучению условий начала, условий протекания и признаков химических процессов. Вы научитесь давать характеристику химической реакции, определять тип реакций соединения и разложения по количеству исходных веществ и продуктов реакции.
Химические реакции: типы, свойства, уравнения
Содержание:
Характеристика реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Видео
И в завершение интересно видео про самые удивительные химические реакции.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Reactions.
Похожие посты:
4 комментария
Спасибо за статью, хотелось бы также больше узнать про химические реакции ферментов и необратимые химические реакции.
Пожалуй эти темы заслуживают отдельной статьи.
1. Вы пишете: “Зная константу равновесия можно определить направление протекания химической реакции.” Одного знания константы равновесия бывает недостаточно. В общем случае, необходимо знать еще концентрации веществ.
2. Про тепловой эффект реакции сразу видно, что переписан без пояснений соответствующий абзац из учебника. Может даже не школьного. Но народу будет не до конца понятно.
3. В начале статьи вы заикаетесь о биохимических реациях и далее даже говорите о том, что есть сложные реакции. И далее не слова про них. Интуитивно понятно, что сложные реакции это совокупность нескольких. Но по хорошему надо бы хотя бы обозначить определение. И пару предложений сказать про биохимические реакции
4. Вы пишете: “К факторам скорости химической реакции можно отнести:
природу реагирующих веществ,
наличие катализатора,
температуру,
давление,
площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.” Перфекционисту, такое утверждение будет резать слух. Например, вы ничего не говорите о концентрациях, а также не разделяете гомогенные и гетерогенные реакции-для них немного разный набор влияющих факторов. Некоторые из указанных вами факторов не так сильно влияют на скорость (если влияют вообще).
4. Указывая признаки протекания химической реакции вы выделяете яркие, заметные но не всегда проявляемые факторы, а также не эти признаки являются фундаментальным признаком протекания химической реакции. Таковым является изменение количества(концентрации) реагирующих веществ. И именно эти изменения фиксируют, т.н. кинетические кривые, снимаемые по ходу реакции графики зависимости какого-либо параметра от количества вещества.
5. Если уж вас спросили в комментариях, и вы сами вкратце касаетесь понятия химического равновесия и т.н. константы равновесия можете в дальнейшем указать, что необратимые это те реакции, у которых очень большое значение константы равновесия.
И еще предложение “При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.” Перечитайте! Кто отличает ядерные реакции от химических (условно говоря, 90% школьников) им это предложение ни к чему. А кто захочет разобраться (те самые 10% кто не различает ядерные и химические реакции) они ничего не поймут!
http://interneturok.ru/lesson/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/harakteristika-himicheskih-reaktsiy
http://www.poznavayka.org/himiya/himicheskie-reaktsii-tipyi-svoystva-uravneniya/