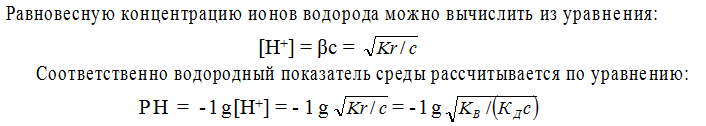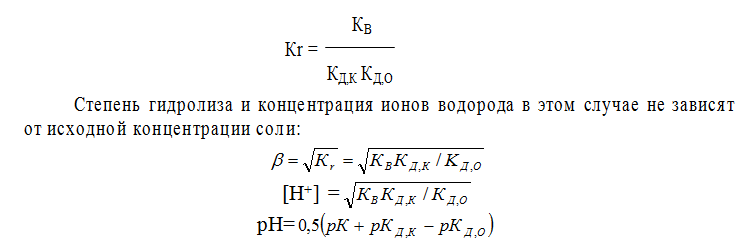Гидролиз цианида натрия
NaCN — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
NaCN + HOH ⇄ HCN + NaOH
Полное ионное уравнение
Na + + CN — + HOH ⇄ HCN + Na + + OH —
Сокращенное (краткое) ионное уравнение
CN — + HOH ⇄ HCN + OH —
Среда и pH раствора цианида натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Гидролиз солей, образованных кислотой и основанием
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Гидролиз солей.
Гидролиз – химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодисcоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КСl.
Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH3COONa. Соль в растворе полностью диссоциирует на ионы:
Вода, как уже указывалось, является слабым электролитом:
Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты
Таким образом, гидролиз в ионной форме можно представит уравнением
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза β, представляющая собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул электролита:
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза Кr:
Как указывалось ранее, [OH – ][ Н + ] ≈ КВ, а отношение – [Н + ][А – ] / [НА]
является константой диссоциации КД слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Если выразить концентрацию ионов и молекул при установлении равновесия
через степень гидролиза β и исходную концентрацию иона с, то получаем, что
Подставив эти значения в уравнение
Если гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
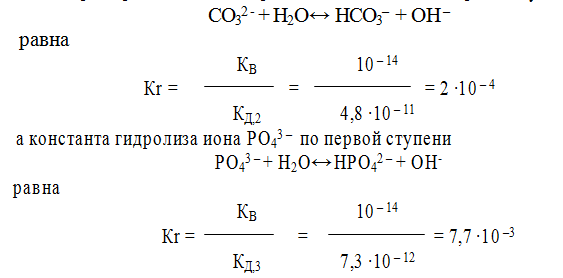
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза СО3 2 – , при 298 К
Поэтому, при расчете концентраций ионов [ОН – ] или [Н + ], второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что в уравнении Кr = КВ / КД для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени. Например, константа гидролиза иона СО3 2- по первой ступени
Гидролиз солей, образованных сильной кислотой и слабым основанием, напримерNH4C1. В растворе соль NH4Cl диссоциирована
Гидролизу подвергается ион слабого основания NH4 +
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями, но лишь с включением константы диссоциации слабого основания.
Гидролиз соли, образованной слабым основанием и слабой кислотой, напримерNH4F
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания КД,О, так и слабой кислоты КД,К
Как видно, в зависимости от соотношения рКД,К и рКД,О среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы K + и анионы CN. Катионы K + не могут связывать ионы ОН воды, так как КОН — сильный электролит. Анионы же CN связывают ионы H + воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CN – + H2O ↔ HCN + OH –
или в молекулярной форме
KCN + H2O↔ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН, поэтому раствор KCN имеет щелочную реакцию( рН > 7).
Таблица 19. Константы и степени диссоциации некоторых слабых электролитов
| Электролиты | Формула | Численные значения констант диссоциации | Степень диссоциации в 0,1 н. растворе, % |
| Азотистая кислота | HNO2 | K= 4,0 · 10 -4 | 6,4 |
| Аммиак (гидроксид) | NH4OH | K= 1,8 · 10 -5 | 1,3 |
| Муравьиная кислота | HCOOH | K= 1,76 · 10 -4 | 4,2 |
| Ортоборная кислота | H3BO3 | K1= 5,8 · 10 -10 | 0,007 |
| K2= 1,8 · 10 -13 | |||
| K3= 1,6 · 10 -14 | |||
| Ортофосфорная кислота | H3PO4 | K1= 7,7 · 10 -3 | 27 |
| K2= 6,2 · 10 -8 | |||
| K3= 2,2 · 10 -13 | |||
| Сернистая кислота | H2SO3 | K1= 1,7 · 10 -2 | 20,0 |
| K2= 6,2 · 10 -8 | |||
| Сероводородная кислота | H2S | K1= 5,7 · 10 -8 | 0,07 |
| K2= 1,2 · 10 -15 | |||
| Синильная кислота | HCN | K= 7,2 · 10 -10 | 0,009 |
| Угольная кислота | H2CO3 | K1= 4,3 · 10 -7 | 0,17 |
| K2= 5,6 · 10 -11 | |||
| Уксусная кислота | CH3COOH | K= 1,75 · 10 -5 | 1,3 |
| Фтороводородная кислота | HF | K= 7,2 · 10 -4 | 8,5 |
| Хлорноватистая кислота | HClO | K= 3,0 · 10 -8 | 0,05 |
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
или в молекулярной форме
В растворе появляется избыток ионов ОН, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn 2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образования молекул Zn(OH)2 не происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn 2+ + H2O ↔ ZnOH + + H +
или в молекулярной форме
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН 3+ + H2O ↔ AlOH 2+ + H +
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы H + и ОH образуют молекулу слабого электролита Н2O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
Общая химия
Гидролиз солей
В общем случае гидролиз – это реакция обменного разложения вещества водой. Гидролизу подвержены соединения различных классов.
Гидролиз солей – процесс взаимодействия ионов, образовавшихся при диссоциации соли, с молекулами воды, сопровождающийся образованием слабых электролитов и изменением рН среды.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются
Растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию. Например при растворении в воде цианида калия он полностью диссоциирует (все соли сильные электролиты):
Образующиеся в результате диссоциации ионы калия соответствуют сильному электролиту КОН, а цианид-ионы — слабой циановодородной кислоте HCN. Ионы водорода, образовавшиеся в результате диссоциации молекул воды, связываются цианид-ионами в молекулы HCN, в результате в растворе накапливаются ионы гидроксила:
Обычно эти два процесса при записи объединяют, получая сокращенное ионное уравнение гидролиза:
рН этого раствора больше 7. Такой гидролиз называется гидролизом по аниону. Для него можно записать полное ионное:
K + + CN — + H2O =K + + HCN + OH —
и молекулярное уравнение:
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию. Аналогично предыдущему примеру гидролиз хлорида аммония NH4Cl:
Диссоциация при растворении соли:
Слабому основанию — аммиаку — соответствует ион аммония NH4 + , он и будет взаимодействовать с молекулами воды образуя слабый электролит:
В растворе накапливаются ионы водорода, среда кислая, рН раствора меньше 7. Такой гидролиз называется гидролизом по катиону. Полное ионное уравнение:
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. В этом случае происходит гидролиз по катиону и аниону. Пример — гидролиз сульфида аммония. Соль при растворении в воде диссоциирует:
Оба иона, образовавшиеся при диссоциации, соответствуют слабым элетролитам, поэтому протекает гидролиз по катиону:
Ионы водорода и гидроксила дают молекулы воды — среда не может быть одновременно кислотй и щелочной:
однако среда не будет нейтральной. Реакция среды будет определяться соотношением констант диссоциации кислоты и основания. Если больше константа диссоциации основания (основание сильнее кислоты), среда будет щелочной, если больше константа диссоциации кислоты (кислота сильнее основаниия) — кислой. В приведенном примере аммиак — более сильный электролит по сравнению с сероводородной кислотой, поэтому среда будет слабощелочной, рН > 7.
В редких случаях, когда константы диссоциации кислоты и основания практически одинаковы, например, при гидролизе ацетата аммония CH3COONH4, среда будет почти нейтральная.
Если соль образована многокислотным основанием или многоосновной кислотой, гидролиз протекает ступенчато. Пример — гидролиз хлорида железа(III). Диссоциация соли при растворении:
Ион Fe 3+ соответствует слабому трехкислотному основанию Fe(OH)3, он и подвергается ступенчатому гидролизу. I-я ступень:
Гидролиз по первой ступени всегда протекает в значительно большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в рассмотренном примере — ионы H + ), способствуют смещению равновесия второйступени влево, т. е. также подавляют гидролиз по второй ступени. Поэтому в обычных условиях (комнатная температура, атмосферное давление) гидролизом по второй и последующим ступеням можно пренебречь.
Следующий пример — гидролиз карбоната натрия Na3CO3. Диссоциация:
Ион соответствует слабой двухосновной угольной кислоте, именно он и подвергается гидролизу. I-я ступень:
И опять в обычных условиях существенна только первая ступень гидролиза.
http://farmf.ru/lekcii/gidroliz-solej-obrazovannyh-kislotoj-i-osnovaniem/
http://www.chem03.ru/index.php/data/index.php?id=33