Гидролиз сульфата ртути (II)
HgSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Hg 2+ + 2SO4 2- + 2HOH ⇄ 2HgOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Hg 2+ + HOH ⇄ HgOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2HgOH + + SO4 2- + 2HOH ⇄ 2Hg(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
HgOH + + HOH ⇄ Hg(OH)2 + H +
Среда и pH раствора сульфата ртути (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Гидроксид ртути: структура, свойства, применение, риски
Гидроксид ртути: структура, свойства, применение, риски — Наука
Содержание:
В гидроксид ртути Это неорганическое соединение, в котором металлическая ртуть (Hg) имеет степень окисления 2+. Его химическая формула — Hg (OH).2. Однако этот вид еще не был получен в твердой форме при нормальных условиях.
Гидроксид ртути или гидроксид ртути является короткоживущим переходным промежуточным продуктом при образовании оксида ртути HgO в щелочном растворе. Из исследований, проведенных в растворах оксида ртути HgO, было установлено, что Hg (OH)2 это слабая база. Другие виды, которые его сопровождают, — HgOH. + и Hg 2+ .
Несмотря на то, что не может осаждаться в водном растворе, Hg (OH)2 Он был получен фотохимической реакцией ртути с водородом и кислородом при очень низких температурах. Он также был получен в виде соосаждения вместе с Fe (OH).3, где присутствие галогенид-ионов влияет на pH, при котором происходит соосаждение.
Поскольку его нелегко получить в чистом виде на лабораторном уровне, не было возможности найти какое-либо применение этому соединению или определить риски его использования. Однако можно сделать вывод, что он представляет те же риски, что и другие соединения ртути.
Строение молекулы
Строение гидроксида ртути (II) Hg (OH)2 Он основан на линейной центральной части, образованной атомом ртути с двумя атомами кислорода по бокам.
К этой центральной структуре прикреплены атомы водорода, каждый рядом с каждым кислородом, которые свободно вращаются вокруг каждого кислорода. В простом виде это можно представить следующим образом:
Электронная конфигурация
Электронная структура металлической ртути Hg выглядит следующим образом:
где [Xe] — электронная конфигурация благородного газа ксенона.
Наблюдая за этой электронной структурой, можно сделать вывод, что наиболее стабильной степенью окисления ртути является та, в которой теряются 2 электрона слоя 6.s.
В гидроксиде ртути Hg (OH)2, атом ртути (Hg) находится в степени окисления 2+. Следовательно, в Hg (OH)2 ртуть имеет следующую электронную конфигурацию:
Номенклатура
— Гидроксид ртути (II)
Свойства
Молекулярный вес
Химические свойства
Согласно полученной информации, возможно, что Hg (OH)2 является переходным соединением при образовании HgO в щелочной водной среде.
Добавление гидроксильных ионов (OH – ) к водному раствору ионов ртути Hg 2+ приводит к осаждению желтого твердого вещества оксида ртути (II) HgO, из которого Hg (OH)2 является временным или временным агентом.
В водном растворе Hg (OH)2 Это очень короткоживущий промежуточный продукт, так как он быстро высвобождает молекулу воды и твердый осадок HgO.
Хотя осадить гидроксид ртути Hg (OH) не удалось.2Оксид ртути (II) HgO до некоторой степени растворяется в воде, образуя раствор разновидностей, называемых «гидроксидами».
Эти частицы в воде, называемые «гидроксидами», являются слабыми основаниями и, хотя иногда они ведут себя как амфотерные, в целом Hg (OH)2 он более щелочной, чем кислый.
Когда HgO растворяется в HClO4 исследования указывают на присутствие иона ртути Hg 2+ , моногидроксимеркуриновый ион HgOH + и гидроксид ртути Hg (OH)2.
Равновесия, которые возникают в таких водных растворах, следующие:
Hg 2+ + H2O ⇔ HgOH + + H +
HgOH + + H2O ⇔ Hg (OH)2 + H +
В щелочных растворах NaOH образуется Hg (OH).3 – .
Получение
Чистый гидроксид ртути
Гидроксид ртути (II) Hg (OH)2 Его нельзя получить в водном растворе, поскольку при добавлении щелочи к раствору ионов ртути Hg 2+ , осаждается желтый оксид ртути HgO.
Однако некоторым исследователям впервые удалось получить гидроксид ртути Hg (OH) в 2005 году.2 используя ртутную дуговую лампу, исходя из элемента ртуть Hg, водорода H2 и кислород O2.
Реакция является фотохимической и проводилась в присутствии твердого неона, аргона или дейтерия при очень низких температурах (около 5 К = 5 градусов Кельвина). Свидетельства образования соединения получали по спектрам поглощения ИК (инфракрасного) света.
Hg (OH)2 приготовленный таким образом, он очень стабилен в условиях опыта. Подсчитано, что фотохимическая реакция протекает через промежуточный продукт O-Hg-O до стабильной молекулы H-O-Hg-O-H.
Соосаждение с гидроксидом железа (III)
Если сульфат ртути (II) HgSO растворяется4 и сульфат железа (III) Fe2(SW4)3 в кислом водном растворе, и pH начинает увеличиваться при добавлении раствора гидроксида натрия NaOH, после периода отстаивания образуется твердое вещество, которое, как предполагается, является соосаждением Hg (OH)2 и Fe (OH)3.
Было обнаружено, что образование Hg (OH)2 является критическим шагом в этом соосаждении с Fe (OH)3.
Образование Hg (OH)2 в осадке Fe (OH)3-Hg (ОН)2 он сильно зависит от присутствия таких ионов, как фторид, хлорид или бромид, от их конкретной концентрации и от pH раствора.
В присутствии фторида (F – ), при pH более 5 соосаждение Hg (OH)2 с Fe (OH)3 это не влияет. Но при pH 4 образование комплексов между Hg 2+ и F – препятствует соосаждению Hg (OH)2.
В случае наличия хлорида (Cl – ), соосаждение Hg (OH)2 это происходит при pH 7 или выше, то есть предпочтительно в щелочной среде.
Когда бромид (Br – ), соосаждение Hg (OH)2 это происходит при еще более высоком pH, то есть pH выше 8,5 или более щелочном, чем с хлоридом.
Приложения
Обзор доступных источников информации показывает, что гидроксид ртути (II) Hg (OH)2Поскольку это соединение еще не получено коммерчески, его применение неизвестно.
Недавние исследования
С помощью методов компьютерного моделирования в 2013 г. были изучены структурно-энергетические характеристики, связанные с гидратацией Hg (OH).2 в газообразном состоянии.
Были рассчитаны и сопоставлены энергии координации металл-лиганд и энергии сольватации, варьируя степень гидратации Hg (OH).2.
Среди прочего, было обнаружено, что, по-видимому, теоретическая степень окисления составляет 1+ вместо предполагаемой 2+, обычно назначаемой для Hg (OH).2.
Риски
Хотя Hg (OH)2 как таковой он не был изолирован в достаточном количестве и поэтому не использовался в коммерческих целях. Его конкретные риски не определены, но можно сделать вывод, что он представляет те же риски, что и остальные соли ртути.
Он может быть токсичным для нервной системы, пищеварительной системы, кожи, глаз, дыхательной системы и почек.
Вдыхание, проглатывание или контакт с кожей соединений ртути может вызвать повреждение, начиная от раздражения глаз и кожи, бессонницы, головных болей, тремора, повреждения кишечного тракта, потери памяти и заканчивая почечной недостаточностью. другие симптомы.
Ртуть признана загрязнителем во всем мире. Большинство соединений ртути, которые вступают в контакт с окружающей средой, метилируются бактериями, присутствующими в почвах и отложениях, с образованием метилртути.
Это соединение биоаккумулируется в живых организмах, переходя из почвы в растения, а оттуда — в животных. В водной среде перенос происходит еще быстрее: от очень мелких видов к крупным за короткое время.
Метилртуть оказывает токсическое действие на живые существа и, в частности, на людей, которые попадают в организм через пищевую цепочку.
При попадании в организм с пищей он особенно вреден для маленьких детей и плода у беременных женщин, поскольку, будучи нейротоксином, он может вызвать повреждение мозга и нервной системы в процессе формирования и роста.
Ссылки
- Коттон, Ф. Альберт и Уилкинсон, Джеффри. (1980). Продвинутая неорганическая химия. Четвертый выпуск. Джон Вили и сыновья.
- Ван, Сюэфэн и Эндрюс, Лестер (2005). Инфракрасный спектр Hg (OH)2 в твердом неоне и аргоне. Неорганическая химия, 2005, 44, 108-113. Восстановлено с pubs.acs.org.
- Амаро-Эстрада, J.I., et al. (2013). Водная сольватация Hg (OH)2: Исследования функциональной теории энергии и динамической плотности Hg (OH)2— (H2ИЛИ)п (n = 1-24) Структуры. J. Phys. Chem. A 2013, 117, 9069-9075. Восстановлено с pubs.acs.org.
- Иноуэ, Йошиказу и Мунэмори, Макото. (1979). Соосаждение ртути (II) с гидроксидом железа (III). Наука об окружающей среде и технологии. Том 13, номер 4, апрель 1979 г. Получено с pubs.acs.org.
- Чанг, Л.В. и др. (2010). Нервная система и поведенческая токсикология. В комплексной токсикологии. Восстановлено с sciencedirect.com.
- Хейни, Алан и Липси, Ричард Л. (1973). Накопление и эффекты гидроксида метилртути в наземной пищевой цепи в лабораторных условиях. Environ. Загрязнение. (5) (1973) стр. 305-316. Восстановлено с sciencedirect.com.
Патологическое пристрастие к азартным играм: симптомы, причины, последствия и лечение
Карибский тюлень-монах: характеристика, среда обитания, причины исчезновения
Действие некоторых реагентов на катионы VI аналитической группы
Cu 2+ , Hg 2+ , Co 2+ , Ni 2+
| Реагент | Катионы | |||
| Cu 2+ | Hg 2+ | Co 2+ | Ni 2+ | |
| NaOH или KOH | Cu(OH)2 голубой осадок | Hg(OH)2 белый осадок, разлагается до HgO. Желтый осадок. | Co(OH)Cl синий осадок | Ni(OH)2 зеленый осадок |
| Осадки растворяются в кислотах и в избытке раствора аммиака | ||||
| Основные соли и амидные соединения | ||||
| NH3 * H2O без избытка | Cu(OH)2SO4↓ и др. зеленый | NH2HgCl↓ белый | Co(OH)Cl↓ и др. синий | (NiOH)2SO4↓ и др. зеленый |
| Осадки растворяются в избытке реактива | ||||
| NH3 * H2O в избытке | [Cu(NH3)4] 2+ — синий | [Hg(NH3)4] 2+ бесцветный | [Co(NH3)6] 2+ оранжево-коричневый | [Ni(NH3)6] 2+ сиреневый |
| Разрушаются кислотами | ||||
| Na2S2O3 | Cu2S↓ черный + S↓ растворяется в HNO3 | HgS черный, растворяется в бромной воде | — | — |
| KI | CuI белый + +I2 бурый | HgI2 оранжево-красный, растворяется в избытке реагента | — | — |
| (NH4)2NCS | Cu(NCS)2↓ черный, который постепенно превращается в белый CuNCS↓ | Hg(NCS)2↓ белый, растворимый в избытке реагента с образованием [Hg(NCS)4] 2ˉ бесцветный | (NH4)2[Co(NCS)4] синий цвет | — |
| SnCl2 | Cu↓ | Hg↓ | — | — |
Схема систематического хода анализа катионов VI аналитической группы Cu 2+ , Hg 2+ , Co 2+ , Ni 2+
Этапы исследования
1. Взаимодействие катионов VI аналитической группы с групповым реагентом (избыток NH3*H2O):
Cu 2+ изб. NH 3* H 2 O [Cu(NH3O)4] 2+
2. Разрушение аммиакатов действием 2 моль/дм 3 H2SO4
3. Отделение Cu 2+ и Hg 2+ ионов от других катионов VI
аналитической группы действием Na2S2O3 на раствор №2:
Cu 2+ Na2S2O3;Δ Cu2S↓ + S↓
Hg 2+ Na 2 S 2 O 3; Δ HgS↓
4. Отделение Cu2Sот HgSпри частичном растворении осадка №3 в разб. HNO3 при нагревании:
Cu2S↓ HNO 3; Δ Cu 2+
5. Определение Cu 2+ ионов в растворе №4 действием
концентрированного NH3 * H2O:
Cu 2+ NH 3* H 2 O [Cu(NH3)4] 2+
6. Растворение осадка № 4 действием бромной воды в присутствииHClили в «царской водке»:
HgS↓ Br ; HCl [HgCl2] + S↓
HgS↓ конц . HNO 3,конц. HCl [HgCl2]
7. Отделение [HgCl2] от S↓ центрифугированием.
8. Определение Hg 2 + ионов в центрифугате №7 действием раствора SnCl2:
[HgCl2] SnCl 2 Hg↓
9. Определение Co 2+ ионов в центрифугате №3 действием раствора NH4NCS в присутствии амилового спирта:
C 5 H 11 OH
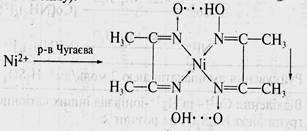
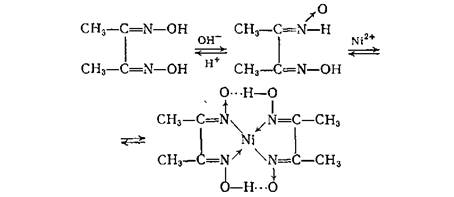
10. Определение Ni 2+ ионов в центрифугате №3 действием реактива Чугаева (диметилглиоксима):
Схема систематического хода анализа катионов III аналитической группы Ba 2+ , Sr 2+ , Ca 2+
Этапы исследования
1.Осаждение катионов III аналитической группы действием 1 моль/дм 3 H2SO4 в присутствии C2H5OH при нагревании:
Ba 2+ H2SO4, Δ BaSO4↓
Sr 2+ H2SO4, Δ SrSO4↓
Ca 2+ H2SO4, C2H5OH, Δ CaSO4↓
Промывание осадка водой, которая содержит H2SO4
2.Переосаждение осадков сульфатов катионов III аналитической группы в осадки их карбонатов действием насыщенного раствора Na2CO3 при кипячении:
CaSO4↓ Na 2 CO 3, Δ CaCO3↓
Промывание осадка водой
3.Растворение осадка №2 действием раствора СН3СООН:
BaCO3↓ СН3СООН Ba 2+
SrCO3↓ СН3СООН Sr 2+
CaCO3↓ СН3СООН Ca 2+
4.Выявление Ba 2+ катиона в отдельной порции раствора №3 действием раствора K2CrO4:
Ba 2+ K 2 CrO 4 BaCrO4↓
Если присутствие Ba 2+ катиона доказано, то его извлекают из раствора №3 действием раствора K2CrO4
5.Выявление Sr 2+ катиона в отдельной порции центрифугата №4 действием насыщенного раствора кальция сульфата (гипсовая вода):
Sr 2+ насыщ. раствор CaSO 4 SrSO4↓
гипсовая вода
6.Удаление Sr 2+ катионов из центрифугата №4 действием конц. раствора (NH4)2SO4:
7.Выявление Ca 2 + катиона в центрифугате № 6 действием раствора (NH4)2С2O4 :
http://ru1.warbletoncouncil.org/hidroxido-de-mercurio-3130
http://helpiks.org/8-68558.html