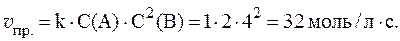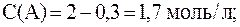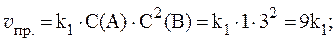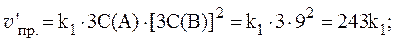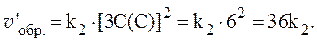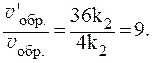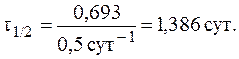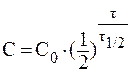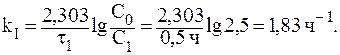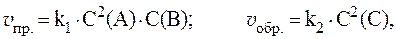Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Эталоны решения задач
1. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А + В = С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Какие количества непрореагировавших газов А и В остались в системе?
Из уравнения реакции следует, что:
Dn(A) = Dn(B) = Dn(C) = 2 моль,
где Dn ‑ изменение количества вещества в ходе реакции.
Следовательно, в сосуде осталось:
2. Реакция протекает по уравнению: 2A + B ⇄ C и имеет второй порядок по веществу А и первый по веществу B. В начальный момент времени скорость реакции равна 15 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 50% вещества B, если начальные концентрации равны: С(A) = 10 моль/л; С(B) = 5 моль/л. Как изменится скорость химической реакции?
Согласно закону действующих масс:

С(B), вступившего в реакцию, равна:
С(B) = 0,5·5 = 2,5 моль/л.
Соответственно С(A), вступившего в реакцию, равна:
2 моль/л A — 1 моль/л B
С(A) и С(B) после протекания реакции:
С(A) = 10 — 5 = 5 моль/л,
С(B) = 5 — 2,5 = 2,5 моль/л.
Скорость прямой реакции будет равна:
Скорость химической реакции изменится:
т. е. уменьшится в 8 раз.
3. Реакция между веществами А и В выражается уравнением: А + 2В = С и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С(А) = 2 моль/л; С(В) = 4 моль/л; константа скорости равна 1,0. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,3 моль/л.
Согласно закону действующих масс:
Если концентрация вещества А уменьшится на 0,3 моль/л, то концентрация вещества В уменьшится на 0,3×2 = 0,6 моль/л. После протекания реакции концентрации равны:
4. Скорости прямой и обратной газофазных реакций, протекающих в замкнутом сосуде, выражаются уравнениями:
Рассчитать, как изменятся скорости прямой и обратной реакций при увеличении давления в системе в 3 раза, если исходные концентрации веществ равны: С0(A) = 1 моль/л; С0(B) = 3 моль/л; С0(C) = 2 моль/л.
Согласно закону действующих масс, скорости прямой и обратной реакций при начальных условиях равны:
Увеличение давления в 3 раза для газообразных систем приводит к уменьшению объема газовой смеси в 3 раза, во столько же раз увеличатся концентрации всех трех газов, и скорости обеих реакций станут соответственно равны:
Отношения скоростей реакций составляют:
Таким образом, скорость прямой реакции увеличится в 27 раз, обратной — в 9.
5. Реакция при температуре 50 0 С протекает за 2 мин 15 с. За какое время закончится эта реакция при температуре 70 0 С, если в данном температурном интервале температурный коэффициент скорости gравен 3?
При увеличении температуры от 50 до 70 0 С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
где 
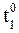


т.е. скорость реакции увеличивается в 9 раз.
В соответствии с определением, время реакции обратно пропорционально скорости протекания реакции, следовательно:
где 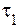

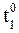

Учитывая, что 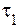

6. Во сколько раз увеличится скорость химической реакции при повышении температуры от 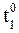

Из правила Вант-Гоффа:
Скорость реакции увеличится в 128 раз.
7. При изучении кинетики выведения лекарственного препарата из организма больного было установлено, что за 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. Определить период полувыведения и константу скорости реакции выведения препарата из организма человека, если известно, что это реакция первого порядка.
Так как за данный промежуток времени из организма было выведено 50% препарата, то t1/2 = 3 часа. Константу скорости реакции рассчитаем из уравнения:
8. При лабораторных исследованиях водных растворов лекарственного средства было установлено, что вследствие гидролиза концентрация препарата за сутки уменьшилась от 0,05 моль/л до 0,03 моль/л. Вычислить период полупревращения реакции гидролиза препарата.
Так как реакции гидролиза обычно протекают при значительном избытке воды, то ее концентрацию можно постоянной. Следовательно, в ходе реакции изменяется только концентрация препарата и реакцию гидролиза можно считать реакцией первого порядка.
Значение константы скорости реакции найдем из уравнения:
9. Период полувыведения препарата из организма больного (реакция первого порядка) равен 5 часам. Определить время, за которое из организма будет выведено 75% препарата.
При выведении из организма 75% препарата отношение С/С0 составит 0,25. В данном случае удобно воспользоваться формулой:
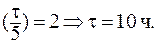
10. Константа скорости реакции гидролиза сахарозы равна 2,31×10 — 3 ч — 1 . Рассчитать:
1) период полупревращения реакции;
2) время, за которое гидролизу подвергнется 20% сахарозы;
3) какая часть глюкозы подвергнется гидролизу через 5 суток.
1. Период полупревращения равен:
2. После того, как гидролизу подвергнется 20% сахарозы, отношение С/С0 составит 0,8. Следовательно:
3. Через 5 суток (120 часов) отношение С/С0 составит:
Следовательно, гидролизу подверглось 24% глюкозы.
11. В ходе некоторой реакции первого порядка за 30 мин превращению подвергается 60% исходного количества вещества. Определить, какая часть вещества останется через 1 час.
1. Через 30 минут количество оставшегося вещества составит:
2. Найдем константу скорости реакции:
3. Количество вещества С2, оставшееся через 1 час, определим по формуле:
Таким образом, через 1 час останется 16% от исходного вещества.
Вопросы для самоконтроля
1. Что называется скоростью химической реакции?
2. Что называется истинной скоростью гомогенной реакции?
3. Какова размерность скорости гомогенной реакции?
4. Что называется скоростью гетерогенной реакции?
5. Какова размерность скорости гетерогенной реакции?
6. Перечислите факторы, влияющие на скорость реакции.
7. Сформулируйте закон действующих масс.
8. Каков физический смысл константы скорости реакции? От чего зависит и от чего не зависит константа скорости реакции?
9. Что называется порядком реакции? Приведите примеры уравнений реакций нулевого, первого, второго и третьего порядков.
10. Зависит ли размерность константы скорости реакции от порядка реакции?
11. Что называется молекулярностью реакции?
12. По какой формуле можно рассчитать период полупревращения реакции первого порядка?
13. Дайте определение простым и сложным реакциям. Приведите классификацию сложных реакций.
14. Сформулируйте правило Вант-Гоффа. Приведите математическое выражение правила Вант-Гоффа.
15. Как скорость реакции зависит от энергии активации? Напишите уравнение Аррениуса.
16. Что такое активированный комплекс? Почему протекание реакций протекает через стадии образования активированных комплексов?
17. Что называется катализатором? Гомогенный и гетерогенный катализ. Почему в присутствии катализаторов реакции протекают быстрее?
18. Что такое ферментативный катализ? Напишите уравнение Михаэлиса-Ментен.
Варианты задач для самостоятельного решения
Вариант № 1
1. Реакция между веществами А и В выражается уравнением 2А + В = С и имеет второй порядок по веществу А и первый по веществу B. Начальные концентрации веществ равны: С0(А) = 0,4 моль/л; С0(В) = 0,8 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,2 моль/л.
2. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 64 раза? Температурный коэффициент скорости реакции gравен 2.
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
а) при увеличении давления в системе в 2 раза?
б) при увеличении объемов газов в 2 раза?
Вариант №2
1. Реакция протекает по уравнению: A + B = C и имеет первый порядок по веществу А и по веществу B. Концентрацию A увеличили с 2 до 8 моль/л, а концентрацию B с 3 до 9 моль/л. Во сколько раз возросла скорость прямой реакции?
2. При 150 0 С реакция заканчивается за 10 минут. Принимая температурный коэффициент gравным 2, рассчитайте, через сколько минут закончилась бы реакция при 170 0 C.
3. Скорость реакции выражается уравнением: 
Вариант №3
1. Реакция выражается уравнением: A + B = C и имеет первый порядок по веществу А и по веществу B. При начальных концентрациях С0(A) = 3 моль/л и С0(B) = 5 моль/л скорость прямой реакции равна 0,3 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация A уменьшится на 2 моль/л.
2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 70 0 С, если температурный коэффициент скорости gравен 2?
3. Скорость реакции A(тв) + 2B(газ) = C(тв) выражается уравнением: 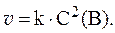
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Рассчитать скорость прямой реакции в тот момент, когда прореагирует 40% вещества B, если начальные концентрации равны: С0(А) = 8 моль/л; С0(B) = 4 моль/л; k = 0,4.
2. Некоторая реакция при 100 0 С заканчивается за 5 мин. За какое время она закончится при 80 0 С, если температурный коэффициент скорости g равен 3?
3. Скорость реакции 3A + B = C выражается уравнением: 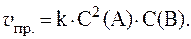
а) при увеличении концентрации вещества A в 2 раза?
б) при одновременном уменьшении концентрации исходных веществ в 2 раза?
Вариант №5
1. Скорость некоторой реакции при повышении температуры с 40 до 70 0 С увеличилась в 8 раз. Определить величину g.
2. Реакция протекает по уравнению: A + 3B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 2 моль/л; С0(B) = 6 моль/л; k = 1. Рассчитать начальную скорость прямой реакции и скорость в тот момент, когда концентрация вещества A уменьшилась на 1 моль/л. Как изменится скорость химической реакции?
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №6
1. В закрытом сосуде находится смесь газов, состоящая из 1 моль A и 3 моль B, которая реагирует по уравнению: A + 3B = 2C. Скорость прямой реакции описывается уравнением 
2. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 9 раз, если температурный коэффициент скорости g равен 3?
3. Как изменится скорость прямой газофазной реакции: 2A = B, порядок которой оценивается как 0,5, при изотермическом уменьшении давления в системе в 3 раза?
Вариант №7
1. Реакция между веществами А и В протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и по веществу В. Начальные концентрации реагирующих веществ составили: С0(A) = 1,5 моль/л; С0(B) = 3 моль/л; k = 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
2. Чему равен температурный коэффициент скорости g, если при увеличении температуры на 30 0 С скорость реакции возрастает в 27 раз?
3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №8
1. В растворе объемом 1 л, содержащем 1 моль вещества A и 2 моль вещества B, протекает реакция: A + 3B = 2C + D. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Во сколько раз уменьшится скорость прямой реакции после того, как прореагируют 0,65 моль вещества A?
2. При повышении температуры от -5 до +5 0 С скорость бактериального гидролиза (ферментативный процесс) увеличивается в 4 раза. Найти значение температурного коэффициента скорости реакции g.
3. Во сколько раз следует увеличить концентрацию вещества A в системе 2A(газ) = B(газ) + C(тв.), чтобы скорость прямой реакции, которая является реакцией второго порядка, увеличилась в 4 раза?
Вариант №9
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Скорость прямой реакции равна 8 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 30% вещества B, если начальные концентрации равны: С0(A) = 2 моль/л; С0(B) = 1 моль/л. Как изменится скорость химической реакции?
2. При увеличении температуры от 10 до 50 0 С скорость реакции увеличилась в 16 раз. Определить температурный коэффициент скорости g.
3. Реакция протекает по уравнению: A + B = C + D + E и имеет первый порядок по веществу А и нулевой по веществу B. Как изменится скорость прямой реакции после разбавления реагирующей смеси в 3 раза?
Вариант №10
1. Реакция протекает по уравнению: A + 2B = AB2 и имеет первый порядок по веществу А и второй по веществу B. Константа скорости реакции равна 0,01. Рассчитать скорость реакции при начальных концентрациях: С0(A) = 0,8 моль/л; С0(B) = 0,8 моль/л и скорость реакции к моменту образования 0,2 моль/л вещества АВ2.
2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 30 до 60 0 С, если температурный коэффициент скорости g равен 3?
3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 6 часам. Определить, за какое время содержание препарата в организме человека уменьшится в 8 раз.
Вариант №11
1. Реакция протекает по уравнению: A + B = 2C и имеет первый порядок по веществу А и по веществу B. Начальные концентрации веществ равны: С0(A) = 0,3 моль/л; С0(B) = 0,5 моль/л; k = 0,1. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация А уменьшится на 0,1 моль/л.
2. При 100 0 С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости g равным 2, рассчитать, через сколько минут закончилась бы эта же реакция при 140 0 С?
3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 2 часам. Определить время, за которое из организма будет выведено 99% препарата.
Вариант №12
1. Реакция протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 0,9 моль/л; С0(B) = 1,5 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда израсходуется 50% вещества A.
2. Чему равен температурный коэффициент скорости химической реакции g, если при увеличении температуры на 30 0 С скорость возрастает в 27 раз?
3. Период полупревращения некоторой реакции первого порядка равен 30 мин. Рассчитать, какая часть от исходного количества останется через 1 час.
Вариант №13
1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Константа скорости реакции равна 5×10 — 2 . Рассчитать скорость реакции при начальных концентрациях С0(A) = 0,4 моль/л; С0(B) = 0,9 моль/л и скорость реакции к моменту образования 0,1 моль вещества С.
2. При температуре 10 0 С реакция протекает за 80 минут. При какой температуре реакция закончится за 20 минут, если температурный коэффициент скорости gравен 2?
3. В ходе лабораторных исследований было установлено, что за сутки концентрация препарата в организме больного снизилась от 0,1 моль/л до 0,02 моль/л. Вычислить период полуэлиминации препарата, считая, что данная реакция первого порядка.
Вариант №14
1. В закрытом сосуде объемом 1 л находится смесь газов, состоящая из 1 моль газа A и 3 моль газа B, которая реагирует по уравнению: A + 3B = 2C. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Как изменится скорость прямой реакции после того, как прореагирует 0,5 моль газа A?
2. При увеличении температуры системы от 10 до 50 0 С скорость химической реакции увеличилась в 16 раз. Определить температурный коэффициент скорости реакции g.
3. Во время аварии на Чернобыльской АЭС (1986 г.) произошел выброс радионуклида Cs-137, период полураспада которого составляет 30 лет. Рассчитать, какая часть попавшего в организм радионуклида осталась в настоящее время.
Вариант № 15
1. Реакция протекает по уравнению: A + B = C имеет первый порядок по веществу А и по веществу B. При начальных концентрациях веществ С0(A) = 0,6 моль/л; С0(B) = 0,8 моль/л скорость реакции равна 0,03 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация вещества A уменьшится на 0,3 моль/л.
2. Скорость реакции при 0 0 С равна 1 моль/л×с. Вычислить скорость этой реакции при 30 0 С, если температурный коэффициент скорости реакции равен 3.
3. Константа скорости гидролиза пестицида при 25 0 С равна 0,32 с — 1 . Исходная концентрация пестицида в пробе составила 2,5 моль/л. Рассчитать, за какое время концентрация пестицида снизится до 0,01 моль/л.
Вариант №16
1. Реакция разложения протекает по уравнению: 2A = 2B + C и имеет второй порядок по веществу А. Константа скорости данной реакции при 200 0 С равна 0,05. Начальная концентрация С(A) = 2 моль/л. Определить скорость реакции при указанной температуре в начальный момент и в тот момент, когда разложится 80% вещества A.
2. Как изменится скорость прямой реакции: 2A(тв) + 3B(газ) = 2С(тв), которая имеет нулевой порядок по веществу А и третий по веществу B, если давление в системе увеличить в 3 раза?
3. В ходе некоторой реакции первого порядка за 45 мин превращению подвергается 20% исходного количества вещества. Определить, какая часть вещества останется через 1,5 часа.
Вариант №17
1. Взаимодействие газов протекает по уравнению: A + 2B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации газов равны: С0(A) = 2 моль/л; С0(B) = 4 моль/л; k = 0,02. Вычислить скорость прямой реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 50%вещества A.
2. При 20 0 С реакция протекает за 2 мин. За какое время будет протекать эта же реакция при 0 0 С, если g = 2?
3. Муравьиная кислота разлагается на оксид углерода (IV) и водород на поверхности золота. Константа скорости этой реакции при 140 0 С равна 5,5×10 — 4 мин –1 , а при 185 0 С составляет 9,2×10 — 3 мин –1 . Определить энергию активации данной реакции.
Вариант №18
1. Реакция протекает по уравнению: 2A + B = 2C и имеет первый порядок по веществу А и по веществу B. Скорость реакции 0,5 моль/л×с. Начальные концентрации веществ равны: С(A) = 6 моль/л; С(B) = 3 моль/л. Определить константу скорости данной реакции и скорость реакции через некоторое время, когда концентрация вещества B уменьшится на 1 моль/л.
2. При 20 0 С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 50 0 С, если g = 2?
3. Константа скорости реакции инверсии тростникового сахара при 25 0 С равна 9,67×10 — 3 мин — 1 , а при 40 0 С составляет 73,4×10 — 3 мин –1 . Определить энергию активации данной реакции в указанном интервале температур.
Примеры решения типовых задач. Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л
Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л, а вещества В — 5 моль/л. Константа скорости реакции равна 0,5 л 2 моль -2 •с –1 . Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В.
Решение. Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере V= K*CA 2 * CB
Скорость химической реакции в начальный момент равна:
V=0,5 . 6 2 . 5 = 90,0 моль . с -1 . л -1
По истечении некоторого времени в реакционной смеси останется 45 % вещества В, т. е. концентрация вещества В станет равной 5 . 0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 — 2,25= 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2 : 1, то концентрация вещества А уменьшилась нa 5,5 моль/л (2,75 . 2) и стала равной 0,5 моль/л (6,0 — 5,5). Следовательно, V2 = 0,5(0.5) 2 • 2,25 = 0,28 моль . с -1 . л -1 .
Ответ: 0,28 моль . с -1 . л -1
Задача 2.Как изменится скорость прямой реакции 2СО + О2 = 2СО2
если общее давление в системе увеличить в 4 раза?
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Это вытекает из газовых законов, в соответствии с которыми, давление прямо пропорционально концентрации газа в объеме.
PV= 

Согласно закону действующих масс начальная скорость реакции равна V1 = 
После увеличения давления в 4 раза, концентрация каждой компоненты вырастит в 4 раза. Тогда V2= k 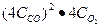


Следовательно, после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Ответ: скорость реакции возросла в 64 раза.
Задача 3. Константа скорости реакции А + 2В 
Решение. Начальную скорость реакции считаем, пользуясь законом действующих масс:






Допустим, имеем один литр реакционной смеси. Следовательно, в реакционной смеси имеем по 0,75 моль исходных реагентов. Когда концентрация вещества В стала 0,5 моль/л, значит в реакцию вступило 0,75 — 0,5 = 0,25 моль вещества В. Так как вещества А и В реагируют в мольных отношениях 1 : 2, то изменение концентрации вещества А при этом составит 0,5 
Рассчитаем скорость реакции. V1= 0,6 



Вещество С образуется в мольном отношении к веществу А равному 3:1, следовательно при расходе вещества А 0,125 буде образоваться 3 
При сопоставлении значений скорости реакции в начальный момент и после превращения, то окажется, что скорость реакции по ходу уменьшилась в 0,253:0,09375= 2,7 раза. Такая закономерность обусловлена тем, что во времени происходит расходование исходных веществ. А по закону действующих масс, скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Ответ: скорость реакции уменьшилась в 2,7 раза.
Задача 4: На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
Решение: В соответствии с правилом Вант – Гоффа.



Ответ: Для того, чтобы скорость реакции возросла в 90 раза, необходимо повышать температуру реакционной смеси на 45,45 0 С.
Задача 5: При 10 0 С реакция заканчивается за 95с, а при 20 0 С за 60с. Вычислить энергию активации этой реакции.
Ответ: Чем дольше протекает реакция, тем она медленнее и наоборот. Поэтому, время реакции, 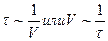

Взаимосвязь константы скорости реакции с энергией активации определяется уравнением Аррениуса:
К= 
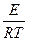
где А — предэкспоненциальный множитель, зависит от типа реакции, Е- энергия активации (кДж/моль), также зависит от типа реакции и не зависит от температуры. Таким образом, константа скорости реакции зависит от типа реакции (А и Е) и от температуры (T).



ln1,58= 
Ответ: 31,49 кДж/моль.
Задача 6: Через некоторое время после начала реакции 3А + В 
Решение: Допустим, что имеем один литр реакционной смеси, в которой в начале реакции отсутствовали вещества С и D. Так как за время реакции образовалось 0,008 моль вещества С, то за это время прореагировало два раза меньше вещества В (в соответствии с уравнением реакции). Таким образом, исходная концентрация вещества В составляла 0,01 + 0,004= 0,014моль/л. Если прореагировало 0,004 моль вещества В, то по уравнению реакции в это же время прореагировало 3 раза больше вещества А, то тесть 0,004 
Задача 7: Рассчитать константу скорости реакции первого порядка, учитывая, что за 25 мин реакция проходит на 25%.
Решение: Дифференциальное уравнение для реакций первого порядка, а именно реакции, протекающие по схеме: А 
— 




Ответ: K1 = 1,15 * 10 -3 сек -1
Варианты задач по теме 2.1.1
1. Реакция протекает по схеме 2А+3В =С. Концентрация А уменьшилась на 0,1 моль/л. Как при этом изменились концентрации веществ В и С?
2. Начальные концентрации веществ, участвующих в реакции СО+Н2О = СО2 + Н2 были равны (моль/л, слева на право): 0,3; 0,4; 0,4; 0,05. Каковы концентрации всех веществ в момент, когда прореагировала ½ часть от начальной концентрации СО?
3. Начальные концентрации веществ участвующих в реакции N2+3H2 =2NH3, равны (моль/л, слева на право): 0,2; 0,3; 0. Каковы концентрации азота и водорода в момент, когда концентрация аммиака станет равной 0,1 моль/л.
4. Во сколько раз изменится скорость реакции 2А + В 
5. Через некоторое время после начала реакции 3А + В 
6. В системе СО + Сl2 
7. Начальные концентрации веществ А и В реакции А+2В 
8. Как изменится скорость реакции 2NO + O2 
9. Во сколько раз следует увеличить концентрацию вещества В в системе 2А +В 
10. Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе 2СО 
11. Начальные концентрации веществ в реакции СО + Н2О 
12. При повышении температуры на 60 0 С скорость реакции увеличилась в 4х10 3 раза. Вычислить 
13. Сколько времени потребуется для завершения реакции при 18 0 С, если при 90 0 С она завершается за 20 секунд, а 
14. При 10 0 С реакция заканчивается за 95с, а при 20 0 С за 60с. Вычислить E активации.
15. Во сколько раз возрастет скорость реакции при повышении температуры с 30 0 до 50 0 С, если энергия активации равна 125,5 кДж/моль?
16. Каково значение энергии активации реакции, скорость которой при 300К в 10 раз больше, чем при 280 К?
17. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличится в 2 раза?
18. Энергия активации некоторой реакции равна 100 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 0 С?
19. При 150 0 С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент за 2,5 рассчитать, через какое время закончится эта реакция, если проводить её: а) при 200 0 С, б) при 80 0 С?
20. При какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа? Температурный коэффициент реакции 3,2.
21. Энергия активации реакции NO2 = NO + 1/2O2 равна 103,5 кДж/моль. Константа скорости этой реакции при 298К равна 2,03 х 10 4 с -1 . Вычислить константу скорости этой реакции при 288 К.
22. При снижении температуры на 20 0 С скорость реакции уменьшилась в 420 раз. Вычислить 
Химическое равновесие
Теоретические пояснения
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции Vпрямая равна скорости обратной реакции Vобратная . Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия. Если в выражении константы равновесия концентрации веществ приведены в моль/л, то такая константа называется Кс. Когда реагирующие вещества находятся в газовой фазе, то можно концентрацию заменить на парциальные давления этих веществ. Константа равновесия, в которой концентрации реагирующих веществ представлены парциальными давлениями этих веществ называется Кр.
Для обратимой реакции Н2(г) + I2(г) 
KР =
Для обратимой реакции синтеза аммиака N2+3H2 
KР =
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии , оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
http://mydocx.ru/12-66543.html
http://lektsii.org/11-7457.html