Химическая реакция протекает согласно уравнению: А+2В → С. Исходные концентрации А – 0,80моль/л В – 1,00моль/л Спустя
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Химическая реакция протекает согласно уравнению aa bb
Химическим равновесием называется такое состояние обратимой химической реакции
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
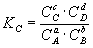
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
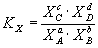
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
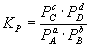
Константа равновесия связана с rG o химической реакции:
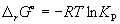
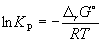
Изменение rG или rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
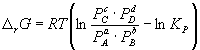
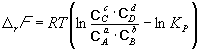
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
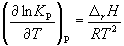
и изохоры химической реакции (изохоры Вант-Гоффа)
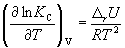
Интегрирование уравнения (9.9) в предположении, что rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
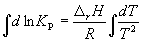
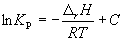
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – rH /R.
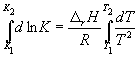
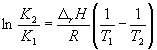
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать rH реакции. Соответственно, зная rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
Пример 9-1. Рассчитать константу равновесия для реакции
при 500 K. fG o для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж . моль –1 и –134.20 кДж . моль –1 соответственно.
Решение. G o реакции:
rG o = fG o (CH3OH) – fG o (CO) = –134.20 – (–155.41) = 21.21 кДж . моль –1 .
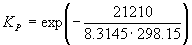
Пример 9-2. Константа равновесия реакции
равна KP = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
Решение. Пусть прореагировало моль N2. Тогда
| N2(г) | + | 3H2(г) | = | 2NH3(г) |
| Исходное количество | 1 | 1 | ||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2 ) | |
| Равновесная мольная доля: | 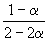 | 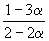 | 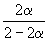 |
Следовательно, KX = 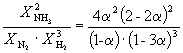
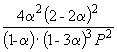
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =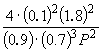
Пример 9-3. Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H2(г) | = | CH3OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N2 = 4–2 моль | ||||
| Равновесная мольная доля | 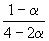 | 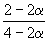 | 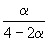 | ||
Следовательно, KX = 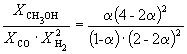
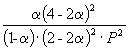
Таким образом, 6.09 10 –3 = 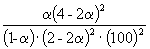
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: 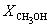
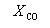
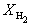
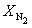
Пример 9-4. Для реакции
при 298 К KP = 6.0 10 5 , а fH o (NH3) = –46.1 кДж . моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
rH o = 2 fH o (NH3) = –92.2 кДж . моль –1 .
Согласно уравнению (9.14), 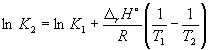
= ln (6.0 10 5 ) + 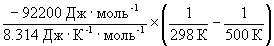
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
Указание: во всех задачах считать газы идеальными.
- При 1273 К и общем давлении 30 атм в равновесной смеси
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
Константа равновесия реакции
при 500 o C равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
Константа равновесия реакции
при 25 o C равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
при 250 o C rG o = –2508 Дж . моль –1 . При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250 o C составит 30%?
константа равновесия KP = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать rG o для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400 o C. Константа равновесия для реакции
при 400 o C равна K = 1.60 10 –4 .
При 250 o C и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
При 2000 o C для реакции
Kp = 2.5 10 –3 . В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
При 420 o C давление газов равно 5.16 10 4 Па, а при 450 o C 10.8 10 4 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
получены следующие данные по зависимости константы равновесия от температуры:
3.98 10 –4
1.41 10 –2
1.86 10 –1
Определить стандартную энтальпию реакции в этом температурном интервале.
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Рассчитать rG o , rH o и rS o реакции при 400 К.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Скорость химических реакций
Скорость химических реакций
Цель работы: на основании экспериментальных данных выявить зависимость скорости химической реакции от концентрации
1 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1 Закон действия масс
Различные химические реакции протекают с различными скоростями: быстро – выпадение осадка в реакциях ионного обмена; мгновенно – взаимодействие водорода и кислорода, происходит взрывообразно; медленно – коррозия металлов, которая протекает годами.
Под скоростью химической реакции понимают изменение концентрации реагирующих веществ с течением времени:
В уравнении знак «+» показывает, что с течением времени концентрация продуктов реакции увеличивается, знак «–», что с течением времени концентрация исходных веществ становится меньше. Время, как правило, выражается в секундах.
Рис. 1. Зависимость концентрации веществ от времени протекания реакции.
а – исходные вещества; б – продукты реакции.
Для изучения кинетики химических реакций, большое значение имеет не только определение скорости реакции, но и определение механизма протекания реакции.
Уравнения химических реакций указывают только начальное и конечное состояние системы и являются символическим выражением материального баланса (закона сохранения массы веществ). В действительности реакция может протекать через ряд промежуточных стадий, так называемых элементарных актов реакции. Например, реакция окисления иодоводорода пероксидом водорода записывается следующим образом:
2HI + H2O2 ® I2 + 2H2O
Механизм этой реакции представлен следующими стадиями:
1) HI + H2O2 ® HIO + H2O (медленная стадия)
2) HIO + HI ® I2 + H2O (быстрая стадия)
Скорость и общий порядок реакции определяется медленной стадией — лимитирующая стадия реакции. Такие реакции называются сложными.
К сложным реакциям также относятся цепные реакции (простые и разветвленные), например, реакция образования хлороводорода из простых веществ, которая на свету сопровождается взрывом:
H2 + Cl2 
Для цепных реакций характерны 3 стадии:
1) стадия зарождения цепи
Cl2 
2) стадия развития цепи
H2 + Cl· ® HCl + H·
H· + Cl2 ® HCl +Cl· и т. д.
3) стадия обрыва цепи
К сложным относятся и параллельные реакции:


Рис. 2. Зависимость концентрации продуктов реакции от времени протекания реакции.
1 – обычная реакция; 2 – цепная реакция; I – первая стадия; II – вторая стадия; 3 – III – третья стадия.
Число молекул, участвующих в одном элементарном акте реакции, называется молекулярностью реакции. Одностадийная реакция, в которой участвует только одна молекула, называется мономолекулярной. Реакция, в которой участвуют две молекулы – бимолекулярная, реакции в которых участвуют три молекулы – тримолекулярная (так как вероятность одновременного столкновения трех разных молекул мала, то и тримолекулярные реакции очень редки).
Факторами, влияющими на скорость реакции, являются природа и концентрация реагирующих веществ, температура, давление (для газовой фазы), а для гетерогенной реакции еще и площадь соприкосновения.
Зависимость скорости реакции от концентрации выражается законом действия масс (здм), сформулированным в 1867 г. Гульдбергом и Вааге:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степень, равную коэффициентам в уравнении реакции.
Так, для гомогенной реакции
u = k∙

где СA, CB – текущие концентрации исходных веществ A и B;
a, b – коэффициенты в уравнении химической реакции;
k – константа скорости реакции, она равна скорости реакции при концентрациях веществ равных единице.
Константа скорости не зависит от концентрации реагирующих веществ, а определяется только природой реагирующих веществ и условиями протекания процесса.
Если эта реакция протекает в газовой фазе, то закон действия масс записывается следующим образом:
u = k∙

где pA, pB – текущие парциальные давления компонентов A и B.
Порядок реакции – это показатель степени, в которой входит концентрация этого вещества в уравнение скорости реакции. Но, как правило, порядок реакции и стехиометрические коэффициенты совпадает лишь для некоторых простых реакций. Для сложных реакций порядок реакции определяется экспериментально. Порядок реакции — величина формальная. Он может быть положительным, отрицательным, дробным, нулевым — это свидетельствует о многоступенчатом характере протекающей реакции.
1.2 Влияние площади соприкосновения на скорость реакции
Различают гомогенные и гетерогенные реакции.
Гомогенные химические реакции — это реакции, протекающие в гомогенных (однофазных) системах, т. е. системах, в которых нет границы раздела между фазами. Гомогенные реакции протекают во всем объеме.
Гетерогенные химические реакции — это реакции, протекающие в гетерогенных (многофазных) системах, т. е. системах, в которых есть граница раздела между фазами. Гетерогенные реакции протекают на границе раздела фаз, поэтому скорость химической реакции зависит от площади соприкосновения. Твердая фаза в явном виде не входит в закон действия масс. Так, для гетерогенной реакции
в выражение здм не входит кристаллическое вещество B:
υ = k∙C

Константы скорости k и k΄ учитывают влияние твердой фазы, т. к. k и k΄ определяются поверхностью соприкосновения фаз, которая меняется в ходе реакции.
1.3 Влияние температуры на скорость реакции
Зависимость скорости реакции от температуры, в общем виде, представлена эмпирическим правилом Вант-Гоффа:
При повышении температуры на 10° скорость реакций возрастает в 2-4 раза:


Повышение температуры приводит к увеличению константы скорости химической реакции. Эта зависимость выражается уравнением Аррениуса:

где R – универсальная газовая постоянная, R=8,314 Дж/моль∙К;
T – абсолютная температура, K;
ko – константа скорости при T→∞;
Ea – энергия активации химической реакции.
Не каждое соударение молекул или других частиц приводит к химическому взаимодействию, так, например, число соударений в газовой фазе при нормальных условиях достигает порядка 1028 соударений в минуту, при этом реакция синтеза иодоводорода заканчивалась бы за 10-10 сек, но в действительности она протекает со скоростью в 1014 раз меньше. Можно сделать вывод, что для осуществления химического взаимодействия, молекулы должны обладать определенным запасом энергии – энергией активации. Энергии активации химических реакций изменяются в пределах от 40 до 400 кДж/моль. Реакции, для которых энергия активации больше 150 кДж/моль не протекают, даже если DGреакц. 0. Катализатор ускоряет те реакции, для которых DG
http://www.chem.msu.su/rus/teaching/eremin1/2-9.html
http://pandia.ru/text/78/092/23899.php







