Растворы электролитов
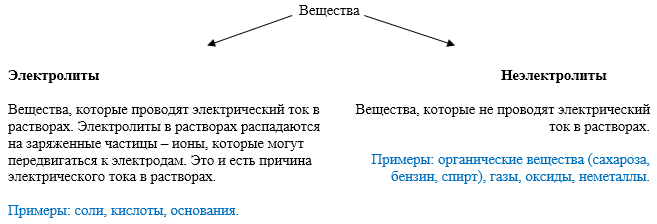
Электролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
- Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.
- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α — + bB +
K = [A — ] a ·[B + ] b /[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α 2 C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α 2 C
Отсюда нетрудно найти степень диссоциации
α = (K/C) 1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H + + Cl — +Na + + OH — = Na + + Cl — + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H + + OH — = HOH
Мы видим, что процесс нейтрализации сводится к соединению H + и OH — и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
Молекулярное уравнение AgNO3 + HI →AgI↓ + HNO3 Полное ионное уравнение Ag + + NO3 — + H + + I — →AgI↓ + H + + NO3 — Сокращенное ионное уравнение Ag + + I — →AgI↓ Процесс осаждения сводится к взаимодействию только Ag + и I — и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
Молекулярное уравнение Na2SO3 + 2HI → 2NaI + SO2↑ + H2O Полное ионное уравнение 2Na + + SO3 2- + 2H + + 2I — → 2Na + + 2I — + SO2↑ + H2O Сокращенное ионное уравнение SO3 2- + 2H + → SO2↑ + H2O Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
Молекулярное уравнение CaCl2 + 2NaI = 2NaCl +CaI2 Полное ионное уравнение Ca 2+ + Cl — + 2Na + + I — = 2Na + + Cl — + Ca 2+ + 2I — Сокращенное ионное уравнение отсутствует Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита. В качестве неэлектролита может выступать вода.
- Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена, например взаимодействие между растворами двух солей:
Это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SО4 и ВаCl2 являются сильными электролитами, т. е. в растворе находятся в виде ионов. Сульфат бария — нерастворимая соль, которая выпадает в осадок, следовательно, ионы Ва 2+ и SО4 2- уходят из раствора. Хлорид натрия NaCl — растворимая соль, сильный электролит, в растворе находится в виде ионов (Na + + Сl — ). Таким образом, с учетом диссоциации сильных электролитов уравнение реакции можно записать так:
Такое уравнение называется полным ионным уравнением.
Результат взаимодействия хлорида бария с сульфатом натрия
Ионы Na + и Cl — имеются и в левой, и в правой частях уравнения, т. е. эти ионы в реакции участия не принимают, их можно исключить из уравнения:
Полученное уравнение называется сокращенным ионным уравнением. Оно показывает, что в ходе данной реакции происходит связывание ионов SO4 2- , которые находились в растворе NaSО4, и ионов Ва 2+ , которые находились в растворе ВаCl2, и в результате образовалась нерастворимая соль BaSО4.
Сокращенное ионное уравнение (3) выражает сущность не только реакции (1). Напишем уравнения нескольких реакций:
Как видим, сущность реакций (4) и (5), как и реакции (1), заключается в связывании ионов SO4 2- и Ва 2+ с образованием нерастворимой соли BaSО4.
В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул.
В виде ионов записывают формулы:
В виде молекул записывают формулы:
— малорастворимых солей(↓) AgCl, BaSO4, СаСО3, FeS и др.;
Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы.
В виде молекул также записывают:
В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т. е. протекать до конца;
2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях.
1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют:
а) малорастворимые вещества;
б) малодиссоциирующие вещества — слабые электролиты;
в) газообразные или летучие вещества.
Рассмотрим эти случаи.
а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓).
Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl:
Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4:
или, сокращая коэффициенты, получим: ОН — + Н + = Н2О.
В результате реакции нейтрализации ионы водорода Н + и гидроксид-ионы ОН — образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима.
в) Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl:
Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода.
2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например:
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
6. Теоретические основы в химии
Читать 0 мин.
6.392. Электролитическая диссоциация и реакции ионного обмена
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов.
И все вещества по способности проводить электрический ток можно разделить на 2 группы: электролиты и неэлектролиты.
В зависимости от значения степени диссоциации, электролиты можно разделить на сильные, средние и слабые:
Сила электролита
Класс соединений
Примеры
Сильные (степень диссоциации от 30% до 100%)
1. Растворимые соли
3. Сильные кислоты
Средней силы (Степень диссоциации от 2% до 30 %
Слабые (степень диссоциации меньше 2%)
1. Нерастворимые соли
2. Нерастворимые основания
3. Слабые кислоты
4. Органические кислоты
Степень диссоциации – $a = \displaystyle \frac
$, где n-число распавшихся (диссоциированных) молекул, N-общее число молекул. При написании уравнений диссоциации помните, что суммарный заряд катионов и анионов должен быть равен нулю.
В случае сильных электролитов распад на ионы протекают необратимо (только в одну сторону), ионы обратно не соединяются в кристаллическую решетку, этому препятствуют молекулы воды, окружающие эти ионы (гидратные оболочки).
Диссоциация слабых электролитов ― обратимый процесс. Это значит, что в растворе присутствуют как ионы, так и недиссоциированные молекулы.
Все электролиты можно разделить на 3 группы: кислоты, основания и соли.
Кислоты ― это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют.
Многоосновные кислоты диссоциируют ступенчато.
H2PO — 4 ⇄ H + + HPO 2- 4, α = 3 ∙ 10 -4 %
HPO 2- 4 ⇄ H + + PO 3- 4, α = 2 ∙ 10 -9 %
Основания ― это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют. Диссоциация нерастворимых оснований не происходит, нет ионов в растворе.
К сильным основаниям относят все щелочи, т. е. все растворимые основания, кроме гидроксида аммония.
KOH = K + + OH — , Ca(OH)2 = Ca 2+ + 2OH — .
Средние соли ― это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н + , и любые анионы, кроме ОН — .
Все растворимые соли ― сильные электролиты.
Реакции между электролитами ― это реакции между ионами, которые образовались при их диссоциации, поэтому их записывают и в молекулярном, и в ионном виде. Протекают всегда в сторону наиболее полного связывания ионов.
Молекулярное
Полное ионное
Краткое ионное
2H + + SO4 2- + 2K + + 2OH — = 2K + + SO4 2- + 2H2O
источники:http://al-himik.ru/reakcii-obmena-v-vodnyh-rastvorah-jelektrolitov-ionnye-reakcii-i-uravnenija/
http://reshutest.ru/theory/11?theory_id=359

 Результат взаимодействия хлорида бария с сульфатом натрия
Результат взаимодействия хлорида бария с сульфатом натрия






 Читать 0 мин.
Читать 0 мин.