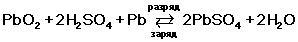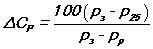Устройство автомобилей
Аккумуляторные батареи
Принцип работы свинцового аккумулятора
Источником электроэнергии на автомобиле при неработающем или работающем с малой частотой вращения коленчатого вала двигателе является аккумуляторная батарея. В настоящее время на автомобилях наиболее широко применяются свинцовые аккумуляторные батареи, состоящие из нескольких последовательно соединенных аккумуляторов. Применение кислотных аккумуляторов объясняется тем, что они обладают небольшим внутренним сопротивлением и способны в течение короткого промежутка времени (несколько секунд) отдавать ток силой в несколько сотен ампер, что необходимо для питания стартера при пуске двигателя.
Свинцовый аккумулятор электрической энергии был изобретен в 1859 году французским физиком Гастоном Планте. В последующие годы конструкция аккумулятора, особенно – химический состав его электродов (пластин) постоянно совершенствовалась. В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
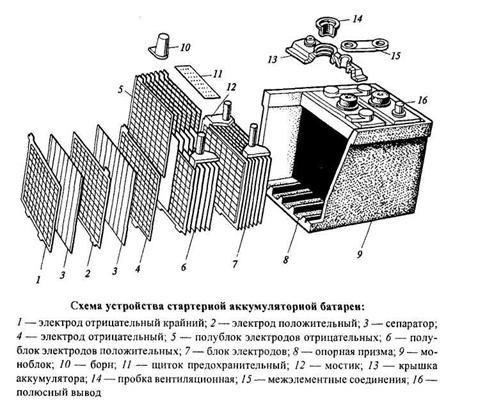
Конструктивно аккумулятор представляет собой емкость, наполненную электролитом, в которой размещены свинцовые электроды. В качестве электролита используется раствор серной кислоты и дистиллированной воды. Электроды выполнены в виде пластин, одна из которых изготовлена из губчатого свинца Pb, а вторая – из диоксида свинца PbO2. При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца.
Во время разряда происходит восстановление диоксида свинца на положительном электроде (аноде) и окисление свинца на отрицательном электроде (катоде). При пропускании через электроды аккумулятора зарядного тока в нем протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
Реакции на аноде:
Реакции на катоде:
Физические процессы, происходящие в аккумуляторе, объясняются свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Легкоокисляющиеся металлы (например, свинец) обладают этим свойством в большей степени, чем инертные металлы.
При погружении свинцового электрода в раствор электролита от него начнут отделяться положительно заряженные ионы свинца и переходить в раствор, при этом сам электрод будет заряжаться отрицательно.
По мере протекания процесса растет разность потенциалов раствора и электрода, и переход положительных ионов в раствор будет замедляться.
При какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления — с другой.
В результате переход ионов свинца в электролит прекратится.
При погружении электрода, изготовленного из двуокиси свинца, в раствор серной кислоты наблюдается такой же процесс, но результат получается иной. Двуокись свинца в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ и одновалентные ионы гидроксила ОН.
Четырехвалентные ионы свинца, осаждаясь на электроде, создают положительный потенциал относительно раствора. Серная кислота образует в воде практически только на ионы НO + и HSO4.
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах — сульфат свинца. При заряде процессы протекают в обратном направлении.
При подключении потребителей в аккумуляторе возникает разрядный ток. При этом ионы сернокислотного остатка SO4 соединяются со свинцом электродов и образуют на них сернокислый свинец PbSO4, а ионы водорода соединяются с кислородом, выделяясь на положительной пластине в виде воды.
В результате электроды покрываются сернокислым свинцом, а серная кислота разбавляется водой, т. е. при разряде аккумулятора плотность электролита уменьшается. Поэтому по плотности электролита можно судить о степени заряженности аккумуляторной батареи.
При прохождении электрического (зарядного) тока через аккумуляторную батарею протекают обратные электрохимические процессы. Ионы водорода, образующиеся в результате распада воды, взаимодействуют с сернокислым свинцом электродов.
Водород, соединяясь с сернистым осадком, образует серную кислоту, а на электродах восстанавливается губчатый свинец. Выделяющийся из воды кислород, соединяется со свинцом положительной пластины, образуя перекись свинца.
В результате этих процессов содержание воды в электролите уменьшается, а содержание кислоты увеличивается, что приводит к повышению плотности электролита.
По завершению процессов восстановления свинца на электродах заряд аккумулятора прекращается. При дальнейшем прохождении электрического тока через электролит начинается процесс электролиза (разложения) воды, при этом аккумулятор «закипает», и выделяющиеся пузырьки образуют смесь водорода и кислорода. Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Кроме того, длительный перезаряд приводит к потере электролитом воды (испарению), в результате чего его плотность повышается и для корректировки требуется доливка дистиллированной воды.
При доливке воды необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли, что при попадании на открытое тело или одежду может привести к ожогам кожи, слизистых оболочек, прожигу одежды и другим неприятным последствиям.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Среднее значение напряжения аккумулятора – 2 В. Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт.).
Важным параметром аккумулятора является его емкость, т. е. количество электрической энергии, которую способен отдать аккумулятор. Емкость – это произведение силы разрядного тока на продолжительность разрядки до предельно допустимого разряженного состояния. Измеряется емкость аккумулятора в ампер-часах (А×ч). Емкость аккумулятора зависит, в первую очередь, от активной площади его электродов.
Поэтому повышения емкости можно достичь увеличением поверхности электродов, что достигается использованием нескольких параллельно соединенных между собой пластин, а также применением пористого материала для их изготовления, что позволяет использовать в качестве активной массы не только поверхность, но и внутренний объем пластин.
Емкость аккумулятора не постоянна, она зависит от силы разрядного тока, температуры электролита и состояния активной поверхности пластин. При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
Химические процессы в свинцово-кислотных аккумуляторах
Как не формулируй название статьи, — оно всё равно будет правильным. Химия и энергия — связаны воедино в конструкции аккумулятора.
Свинцово-кислотные аккумуляторы могут работать несколько лет в режимах заряда-разряда. Они быстро подзаряжаются и быстро отдают запасённую энергию. Секрет этих метаморфоз кроется в химии, ведь именно она помогает преобразовывать электричество, но как?
В качестве электролита используют жидкость, которая плохо проводит ток, но является хорошим проводником для ионов. Это водный раствор серной кислоты (H2S04). В химической реакции происходит процесс, всем известный со школьной скамьи — электролитическая диссоциация.
В процессе реакции, — положительно заряженные ионы (Н+) направляются к положительному электроду, а отрицательно заряженные ионы (SO42-) к отрицательному. Когда аккумулятор разряжается, то из восстановителя (губчатый свинец), через электролит к положительному электроду, — направляются ионы с положительным зарядом РЬ2+.
Четырехвалентные ионы свинца (РЬ4+) превращаются в двухвалентные (РЬ4+). Однако, это еще не все химические реакции. Когда ионы кислотных остатков с отрицательным зарядом (SO42-) соединяются с положительно заряженными ионами свинца (РЬ2+), то на обоих электродах образуется сульфат свинца (РЬSО4). А вот это уже плохо для аккумулятора. Сульфатация сокращает срок службы аккумулятора и постепенно накапливаясь, может привести к его разрушению. Побочным эффектом химических реакций в обычных свинцово-кислотных аккумуляторах, являются газы.
Что же происходят, когда аккумулятор подзаряжают?
Электроны направляются к электроду с отрицательным зарядом, где выполняют свою функцию — нейтрализуют ионы свинца (РЬ2+). Химические реакции, происходящие в аккумуляторных батареях можно описать такой формулой:
Плотность электролита, и его уровень в аккумуляторе, зависит от того, — заряжен, или разряжен аккумулятор. Изменения плотности электролита можно описать следующей формулой:
где показатель разрядки аккумулятора, который измеряется в процентах, — Cp. Плотность электролита при полной зарядке — Рз. Плотность электролита при полной разрядке — Pр.
Стандартная температура, при которой делают измерения + 25°С, Плотность электролита в соответствии с температурой + 25°С, г/см3 — Р25.
Во время химической реакции положительные электроды используют в 1,6 раза больше кислоты, чем отрицательные. Когда аккумулятор разряжается, то объем электролита растет, а когда заряжается, наоборот — уменьшается.
Таким вот образом, с помощью химических реакций, аккумулятор принимает, а потом отдаёт электрическую энергию.
Электролит и химические процессы в свинцовых аккумуляторах
Электролит. Свинцовые аккумуляторы заливают электролитом, который состоит из аккумуляторной серной кислоты и дистиллированной воды. Аккумуляторная серная кислота — тяжелая прозрачная маслянистая жидкость, хорошо растворяется в воде, без запаха, разъедает кожу, бумагу, материю. Для приготовления электролита применяют три сорта серной кислоты: с государственным Знаком качества, 1-го сорта и 2-го сорта. В серной кислоте 1-го и 2-го сорта до допустимых пределов снижено число примесей (железа, окислов азота, мышьяка, марганца и др.). Аккумуляторная серная кислота поступает с заводов в стеклянных бутылях со стеклянными притертыми пробками, навинчивающимися полиэтиленовыми или пластмассовыми крышками. Бутыли устанавливают в ивовые корзины, полиэтиленовые или деревянные обрешетки. Их должны переносить два работника при строгом соблюдении правил техники безопасности.
Дистиллированная вода отличается от водопроводной или речной почти полным отсутствием примесей (солей, сульфатов, хлоридов и др ). Такую воду получают при помощи перегонных кубов — дистилляторов.
Электролит готовят в чистой кислотостойкой посуде (эбонитовой, керамической, фаянсовой). Часто используют деревянные баки, внутри выложенные листовым свинцом. Нельзя пользоваться стеклянной посудой: при растворении серной кислоты выделяется большое количество тепла и стеклянные сосуды, нагреваясь, могут лопнуть.
В сосуд наливают дистиллированную воду, а затем тонкой струей серную кислоту, перемешивая этот раствор палочкой из стекла или эбонита Так как серная кислота тяжелее воды, то выделяющееся при растворении тепло равномерно распределяется по всему объему электролита. Запрещается вливать воду в кислоту. В этом случае струя воды, соприкасаясь только с поверхностными слоями кислоты, быстро нагревается и разбрызгивается вместе с частицами серной кислоты Эти брызги, попадая на кожу, могут причинить серьезные ожоги. При приготовлении электролита необходимо надевать защитные очки, резиновые перчатки и фартук, суконный комбинезон и галоши. Для нейтрализации серной кислоты и электролита, попавших на кожу или одежду, необходимо всегда иметь 5-10%-ный раствор соды или 5-10%-ный раствор нашатырного спирта. Если серная кислота попала на кожу, то ее следует сразу смочить защитным раствором, а затем несколько раз промыть водой. Плотность электролита измеряют ареометром (рис 211, а) Он представляет собой стеклянную трубку 4, запаянную с обеих сторон, в нижней части которой находится грузик, а в верхней — шкала Ареометр Л, опущенный в мензурку 1 с электролитом 2, занимает вертикальное положение, причем некоторая часть его выступает наружу Глубина погружения ареометра зависит от плотности электролита:
чем больше плотность электролита, тем меньше погружается ареометр По делению шкалы, которое находится на уровне раствора, определяют плотность электролита Аккумуляторный ареометр (рис 211, б) помещается в стеклянную трубку 4, на один конец которой надета резиновая груша 5, а на другой -трубчатый наконечник 6 из кислотостойкого материала При помощи резиновой груши электролит всасывают в стеклянную трубку с ареометром. Для заполнения новых стационарных свинцовых аккумуляторов применяют электролит плотностью 1,18 г см 3 при температуре 25 С С повышением плотности электролита от 1,18 до 1,29 гем 3 снижается температура его замерзания Например, электролит плотностью 1,29 г/см 3 замерзает при температуре -74 С Поэтому переносные аккумуляторы, работающие при низких температурах, заливают электролитом повышенной плотности Например, в центральных районах при температуре зимой до -ЗО С в стартерные аккумуляторы заливают электролит плотностью 1,27 г/см 3 Аккумуляторы типов АБН-72 и АБН-80 заливают электролитом плотностью 1,21 г ем 3 Перед заливкой в аккумуляторы электролит необходим/) охладить до температуры 25 С Для того чтобы уменьшить время охлаждения, рекомендуется ступенчатое приготовление электролита: из кислоты плотностью 1,83 г ем 3 приготовить электролит плотностью 1,4 гем 3 , а из,него — — электролит плотностью 1,18-1,3 г см 3
Химические процессы. У заряженного свинцового аккумулятора активная масса положительных пластин состоит из двуокиси свинца РЬ02, а отрицательных — из губчатого свинца РЬ Двуокись свинца имеет темно-коричневый цвет, а губчатый свинец — светло-серый Пластины погружены в электролит — водный раствор серной кислоты В результате электролитической диссоциации молекулы серной кислоты электролита распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка
К заряженному аккумулятору присоединим приемник энергии сопротивлением г (рис 212, а) и рассмотрим химические процессы в аккумуляторе при его разряде Разрядный ток 1,, направлен от положительной пластины через приемник энергии г к отрицательным пластинам, а затем через электролит — от отрицательных пластин к положительной
В электролите положительные ионы водорода 2Н + перемещаются по направлению тока, а отрицательные ионы БОГ — — против В результате разряда в свинцовом аккумуляторе происходят химические реакции
Из уравнения видно, что в процессе разряда двуокись свица РЬО., на положительных пластинах и губчатый свинец РЬ на отрицательных пластинах превращаются в сернокислый свинец РЬЯО+ Эти химические реакции идут с поглощением серной кислоты, поэтому в про цессе разряда плотность электролита снижается. При глубоком разряде сернокислый свинец превращается в твердую крупнокристаллическую соль, которая плохо восстанавливается во время заряда. Поэтому аккумуляторы разряжают только до определенной плотности электролита. Для стационарных аккумуляторов она равна 1,17- 1,15 г/см 3 . Для заряда через аккумуляторы пропускают постоянный ток, направленный противоположно разрядному току. Для этого аккумулятор подключают к выпрямителю В (рис. 212, б) или другому источнику постоянного тока. Положительный зажим выпрямителя соединяют с блоком положительных пластин, а отрицательный — с блоком отрицательных пластин.
Зарядный ток 13 направлен внутри электролита от положительных пластин к отрицательным. Поэтому к положительным пластинам подходят отрицательные ионы кислотного остатка , а к отрицательным пластинам — положительные ионы водорода 2Н+.
Химические реакции при заряде можно представить следующим уравнением: Р1эбЬ4 + РЬ5Ю4 + 2Н20 РЬ ( 02 + 4- 2Н2804.
Во время заряда сернокислый свинец РЬБ04 превращается в двуокись свинца РЬ02 на положительных пластинах и в губчатый свинец РЬ на отрицательных пластинах. Одновременно увеличивается количество серной кислоты в растворе, что повышает плотность электролита до тех пор, пока весь сульфат свинца не преобразуется в активные вещества, которые были в аккумуляторе перед разрядом. Поэтому плотность электролита в конце заряда равна плотности электролита в начале разряда. У стационарных аккумуляторов плотность электролита в конце заряда достигает 1,2-1,21 г/см 3 ; у аккумуляторов типа АБН плотность электролита достигает 1,18-1,2 г/см 3 летом и 1,3-1,32 г/см 3 зимой. После восстановления активных масс на пластинах зарядный ток разлагает воду электролита на водород и кислород, которые, смешиваясь, образуют взрывоопасную смесь,
Рис. 212. Простейший свинцовый аккумулятор (а) и схема его заряда (б)
называемую гремучим газом. Разложение воды электрическим током обнаруживается по интенсивному выделению пузырьков водорода и кислорода на поверхности электролита («кипению»).
http://www.akbli.com.ua/info/38-himicheskie-processy-v-svincovo-kislotnyh-akkumulyatorah.html
http://www.dieselloc.ru/elektropitayushchie-ustrojstva-i-linejnye-sooruzheniya/elektrolit-i-khimicheskie-protsessy-v-svintsovykh-akkumulyatorakh.html