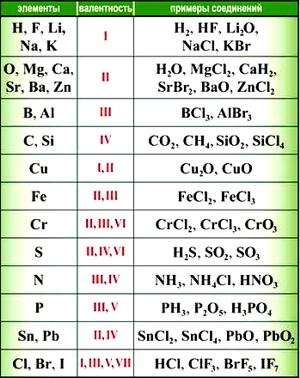
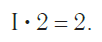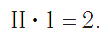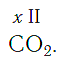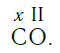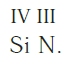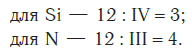Написание формулы по валентности
Валентность — способность атома присоединять то или иное число других атомов с образованием химической связи (см. «Что такое валентность»).
Для того, чтобы выводить химические формулы веществ по валентности элементов, необходимо знать, как минимум, валентности наиболее часто встречающихся элементов.
Алгоритм написания химической формулы вещества по валентности элементов, входящих в него:
- записать химические знаки элементов, входящих в вещество;
- определить валентность этих элементов;
- найти наименьшее общее кратное для валентностей этих элементов;
- определить индексы для атомов.
Составление формулы оксидов по валентности элементов
В качестве примера составим формулу оксида железа (III).
- В оксид железа входят железо и кислород: Fe O;
- Указываем валентность этих элементов: Fe III O II ;
- Находим наименьшее общее кратное (НОК): 3·2=6;
- Делим НОК на число единиц валентности каждого элемента:
- для Fe — 6:3=2;
- для O — 6:2=3.
- Записываем полученные индексы справа внизу от элемента: Fe2O3.
Составление формулы оснований
Важный нюанс, который неободимо знать — группы атомов могут рассматриваться, как единое целое.
Составление формул оснований по валентности элементов отличается от составления формулы оксидов лишь тем, что вместо атома кислорода в формуле стоит гидроксогруппа OH. В случае, если гидроксогруппа в формуле повторяется несколько раз, она берется в скобки.
В качестве примера составим составим формулу гидроксида магния.
На первом месте в основаниях стоит атом металла, гидроксогруппа — на втором.
Составление формулы солей
В солях «роль» гидроксогруппы OH играют кислотные остатки.
На первом месте в формуле средней соли стоит атом(ы) металла, кислотный остаток — на втором.
В качестве примера составим формулу соли фосфата натрия.
Составление формулы кислот
На первом месте в формуле кислот стоит атом(ы) водорода, кислотный остаток — на втором.
В качестве примера составим формулу серной кислоты.
Потренируемся в решении обратной задачи, когда по готовой формуле надо определить валентность элементов.
Определение валентности по готовой формуле
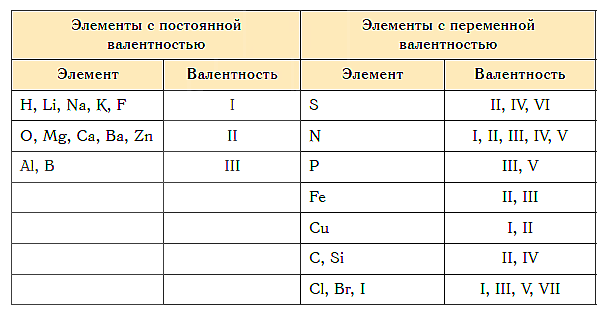
«Фишка» решения подобных задач заключается в том, что некоторые химические элементы в любых соединениях, в которые они входят, имеют постоянную валентность.
Элементы с постоянной валентностью:
- валентность I: H, F, Li, Na, K, Rb, Cs
- валентность II: O, Mg, Ca, Sr, Ba, Zn
- валентность III: Al
Большинство элементов в различных соединениях могут принимать различную валентность,, т. е., образовывать различное число химических связей.
Для нахождения валентности элементов с переменной валентностью в том или ином соединении используют правило валентности.
| x·m=y·n |
| в бинарных соединениях типа AmBn произведение валнетности элемента A(x) на кол-во его атомов m равно произведению валентности элемента B(y) на число его атомов n |
Определим, используя правило валентности, валентность фософра в соединении P2O5.
Поскольку валентность кислорода равна II, то:
Теперь решим ту же задачу, используя алгоритм, описанный выше для выведения формулы по валентности, который будем применять «сзади-наперёд».
Определим валентность фосфора и кислорода в соединении P2O5.
- P2O5
- валентность кислорода равна двум: P2O5 II
- общее число единиц валентности всех атомов вещества будет равно 2·5=10
- делим общее число единиц валентности (10) на индекс кислорода, валентность которого известна: 10:2=5 — это и будет валентность неизвестного, в нашем случае, фосфора
- P2 V O5 II
Немного усложним задачу и определим валентность элементов в соли кислородсодержащей кислоты Al2(SO4)3.
- решение задачи начинается с элемента с известной валентностью, т. е., с кислорода — определяем кол-во его атомов: 4·3=12
- с учётом того, что валентность кислорода равна 2, находим общее число единиц валентности для кислорода: 12·2=24
- по аналогии вычисляем общее число единиц валентности для атомов алюминия (валентность=3): 2·3=6
- от общего числа единиц валентности кислорода вычитаем общее число единиц валентности алюминия: 24-6=18 — это общее число единиц валентности, которое будет приходиться на серу
- по аналогии с кислородом определяем число атомов серы, валентность которой неизвестна: 1·3=3
- чтобы узнать валентность серы следует разделить разность, найденную в п.4, на число атомов серы: 18:3=6
- Al2 III (S VI O4 II )3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
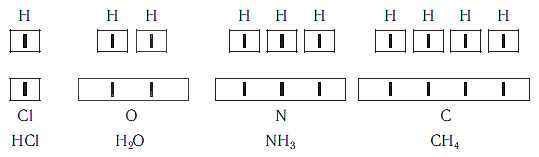
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
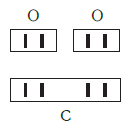
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
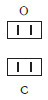
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические формулы
Содержание:
Химическая формула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химические формулы
Химическая формула — это условная запись состава вещества с помощью символов химических элементов и индексов. Вы знаете, что символ химического элемента показывает один атом этого элемента, а индекс — число атомов данного химического элемента в молекуле и пишется в формуле после знака химического элемента внизу.
Вспомните, молекулы каких простых веществ состоят из двух атомов. Выучите их формулы: H2, N2, O2, F2, Cl2, Br2, I2.
Химическая формула показывает качественный и количественный состав вещества.
Чтобы указать число свободных атомов химического элемента или число молекул вещества, пользуются коэффициентом, который записывается перед символом химического элемента или перед химической формулой (табл. 13).
Химические формулы
| Состав молекулы | Химическая формула | Рисунок молекулы | Прочтение формулы |
| Два атома водорода | H2 |  | «аш-два» |
| Один атом серы и три атома кислорода | SO3 |  | «эс-о-три» |
| Два атома калия, один атом серы и четыре атома кислорода | K2SO4 |  | «калий-два-эс-о-четыре» |
| Три молекулы аммиака | 3NH3 |  | «три-эн-аш-три» |
Химические формулы можно вывести на основе данных о составе веществ. Однако чаще всего при составлении химических формул учитывается валентность элементов.
Валентность — это свойство атомов химического элемента присоединять определенное число атомов другого химического элемента.
За единицу валентности принята валентность атома водорода. Если к одному атому данного элемента присоединяется один атом водорода, то элемент одновалентен, если два — двухвалентен и т. д.
Например: 
Водородные соединения известны не для всех элементов, но практически все элементы образуют соединения с кислородом. Кислород постоянно двухвалентен, поэтому валентность определяют также по кислороду. Например: MgO, СаО, так как кислород двухвалентен и в этих оксидах на один атом элемента приходится по одному атому кислорода, то магний и кальций двухвалентны.
Многие элементы в соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (табл. 14). Сера в химическом соединении SO2 имеет валентность, равную четырем, а в соединении SO3 валентность серы равна шести.
Валентность некоторых химических элементов
| Валентность | Химические элементы |
| С постоянной валентностью | |
| I | H, Na, K, Li |
| II | O, Be, Mg, Ca, Ba, Zn |
| III | Al, B |
| С переменной валентностью | |
| I и II | Cu |
| II и III | Fe, Co, Ni |
| II и IV | Sn, Pb |
| III и V | P |
| II, III и VI | Cr |
| II, IV и VI | S |
Составление химических формул по валентности
Вещество, состоящее из двух элементов, называется бинарным соединением. Примером бинарных соединении являются оксиды. Чтобы составлять их химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение (табл. 14). Будем составлять формулы в соответствии с алгоритмом.
1) записываем рядом символы химических элементов:
2) ставим над химическими элементами их валентности римскими цифрами:
3) находим наименьшее общее кратное чисел, выражающих валентность обоих элементов:
4) делим его на валентности элементов и находим индексы соответствующего элемента (индекс 1 не пишется):
Знаешь ли ты?
Самым длинным химическим названием обладает ДНК, выделенная из митохондрии человека. Полное название этого соединения, рассчитанное теоретически, должно содержать около 207 тыс. знаков.
Если у данного элемента валентность переменная» то ее указывают в скобках. Например, FeO — оксид железа (II), Fе2О3 — оксид железа (III). А также, зная формулу вещества, можно определить валентность элементов. Например, в оксиде алюминия Al2O3 валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равно шести (2*3). Следовательно, шесть валентностей кислорода приходятся на два атома алюминия, а на один атом алюминия приходится три единицы валентности (6:2).
Знаешь ли ты?
Если 100 миллионов атомов водорода расположить рядом друг с другом, то они образуют цепочку длиной 1 см.
Относительная молекулярная масса
Масса молекулы, выраженная в атомных единицах массы, называется молекулярной массой данного вещества.
Относительная молекулярная масса (Мr) вещества показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Например, молекула водорода в два раза тяжелее, чем атомная единица массы (рис. 28).
Рис. 28. Молекула водорода в два раза тяжелее, чем атомная единица массы
По химической формуле вещества можно вычислить его относительную молекулярную массу, исходя из величин относительных атомных масс элементов вещества. Относительная молекулярная масса является безразмерной величиной, потому что атомные массы элементов, входящих в состав молекулы, также безразмерные величины. Относительная молекулярная масса обозначается символом (Мr).
Относительная молекулярная масса вещества вычисляется следующим образом: относительная атомная масса каждого элемента умножается на число его атомов в составе молекулы и полученные величины суммируются (см. табл. 15).
Теперь можно выяснить, что показывает химическая формула. Рассмотрим это на примере воды и сульфида магния (см. табл. 16).
Пользуясь химическими формулами, производят различные расчеты. Рассмотрим, как по химическим формулам вычисляется отношение масс атомов элементов в сложном веществе.
• Задача. Вычислите массовое соотношение элементов в карбонате магния (MgCO3).
Решение. Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовое соотношение этих элементов;
w(Mg) : w(C): w(O)= 24 : 12 : 48 = 2 : 1: 4:
Это означает, что на 7 мас. ч. карбоната магния приходится 2 мас. ч, магния, 1 мас. ч. углерода и 4 мас. ч. кислорода. Массовые части можно измерить любыми единицами (г, кг, т). 7 г карбоната магния содержат 2 г магния, 1 г углерода и 4 г кислорода.качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Относительные молекулярные массы
| N2 |  | Mr(N2) = 2 • 14 = 28 |
| SO3 |  | Mr(SO3) = 32 + 3 • 16 = 80 |
| H2SO4 |  | Mr(H2SO4) = 1 • 2 + 32 +4 • 16 = 98 |
| Fe(NO3)2 |  | Mr(Fe(NO3)2) = 56 + 2 • (14+3 • 16) = 180 |
| 1 | Химическая формула вещества | H2O | MgS |
| 2 | Название вещества | Вода | Сульфид магния |
| 3 | Одна молекула данного вещества | Одна молекула воды | Одна молекула сульфида магния |
| 4 | Качественный состав (из каких химических элементов состоит данное вещество) | В состав воды входят химические элементы водород Н и кислород О | В состав сульфида магния входят химические элементы магний Мg и сера S |
| 5 | Количественный состав | Молекула воды образована двумя атомами водорода Н и одним атомом кислорода О | В состав сульфида магния входят один атом магния и один атом серы |
| 6 | Массовые отношения элементов в этом веществе | m(H) : m(O) = 2:16 = 1 : 8 | m(Mg) : m(S) = 24 : 32 = 3 : 4 |
| 7 | Относительная молекулярная масса | Mr(H2O) = 2 • 1+16 = 18 | Mr(MgS) = 24 + 32 = 56 |
Знаешь ли ты?
Молекулярная формула перекиси водорода H2O2. Это вещество часто используют для осветления волос и в качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Самое важное
Химическая формула — это условное обозначение состава вещества с помощью символов химических элементов и индексов. Химическая формула показывает количественный и качественный состав вещества. Индекс показывает количество атомов элемента в химической формуле. Коэффициент показывает количество атомов или молекул. Вещество, состоящее из двух элементов, называется бинарным соединением. Валентность — это свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента. Валентность бывает постоянной и переменной.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://himi4ka.ru/arhiv-urokov/urok-6-valentnost.html
http://natalibrilenova.ru/himicheskie-formulyi/