Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Формула фосфата аммония, свойства и основные применения
фосфат аммония неорганическое вещество, которое образуется при взаимодействии аммиака (NH3) с фосфорной кислотой (H3PO4). В результате получается водорастворимая соль, очень важная для сельскохозяйственного сектора..
Его химическая структура состоит из группы фосфатов (H2PO4) и аммония (NH4). Фосфатная группа состоит из фосфорного ядра (P), которое связывается с кислородом с двойной связью, с двумя гидроксидами (OH) и с кислородом с одинарной связью.
В свою очередь, этот последний кислород связан с аммонием, образуя, таким образом, всю молекулу фосфата аммония. Его формула представлена в виде (NH4) 3PO4.
В природе это происходит в кристаллах. Это продукт, который производится в масштабе довольно экономно.
Основные характеристики
Это происходит в природе в виде белых кристаллов в форме четырехугольных призм или в виде ярко-белых порошков.
В удобрениях он поставляется в гранулированном виде или в виде порошка. Не имеет характерного запаха.
Фосфат аммония обычно является стабильным веществом, поэтому вам не нужно обращать большого внимания на то, будете ли вы реагировать с каким-либо агентом.
В отличие от других веществ, он не представляет опасности для контакта. Однако в случае проглатывания или раздражения важно проконсультироваться с врачом.
свойства
— Это водорастворимое соединение.
— Он имеет плотность 1800 кг / м3.
— Имеет молекулярную массу 115 г / моль.
— Нерастворим в ацетоне.
— Его pH слегка кислый. Он входит в диапазон от 4 до 4,5.
приложений
Основное применение фосфата аммония — удобрения. Растения нуждаются в минералах и питательных веществах, которые они получают из земли, чтобы развиваться, расти и производить.
К ним относятся азот и фосфор. Поскольку фосфат аммония растворим в воде, растения очень легко поглощают его из земли..
Фосфат аммония также играет фундаментальную роль в фотосинтезе, дыхании и управлении энергией растений..
С другой стороны, было проведено исследование для использования этого соединения в качестве элемента хранения водорода в топливных элементах.
Тенденция к поиску эффективных технологий привела к испытаниям различных материалов, но многие из них слишком дороги. Фосфат аммония очень дешевый, поэтому он может представлять собой отличный вариант.
Некоторые компании используют его как огнетушитель.
ФОСФАТЫ АММОНИЯ
Фосфатами аммония обычно называют соли ортофосфорной жислоты — моноаммонийфосфат NH4H2PO4, . диаммонийфосфат.(NH4)2HP04 и триаммонийфосфат (МН4)зР04. Наиболее устойчивым соединением является моноаммонийфосфат, при нагревании которого до 100—110° не наблюдается потерь аммиака. Диаммонийфосфат при 70° теряет аммиак и переходит в моноаммонийфосфат:
Триаммонийфосфат разлагается на воздухе уже при 30—40°.
Давление диссоциации при 100° над NH4H2PO4 равно практически нулю, над (NH4)2HP04 —5 мм рт. ст. И над (NH4)3P04 —643 мм рт. ст. При 125° давление NH3 над этими солями возрастает соответственно до 0,05, 30 и 1177 мм рт. ст.
При 20° в 100 г воды растворяется: NH4H2PO4 40,3 г, (NH4)2HP04 71,0 г, (ЫН4)зР04 17,7 г. Растворимость в системе NH3— —Н3РО4—Н2О показана на рис. 37 1 239
Значения рН 0,1 молярного раствора равны: для NH4H2PO4 — 4,4, для (NH4)2HP04 —8,0 и для (NH4)3Р04 — 9,4.
Моно — и диаммонийфосфаты малогигроскопичны. Гигроскопическая точка NH4H2PO4 при 50° равна 88%, а при 15° —97%. При смешении моноаммонийфосфата с такими веществами, как
Ca(H2P04)2-H20, (NH4)2S04, NH4N03t NH4C1 и СО(NH2)2, получаются удобрительные смеси, обладающие хорошими физическими свойствами, с низкой гигроскопичностью и не слеживающиеся при хранении245-246.
При смешении моноаммонийфосфата с Ca(N03)2 в присутствии небольших количеств воды протекает обменная реакция:
Эта смесь обладает большой гигроскопичностью.
При смешении диаммонийфосфата и хлористого калия с сульфатом аммония, суперфосфатом или с моноаммонийфосфатом получаются смеси с хорошими физическими свойствами. При смешении с нитратом аммония или карбамидом полученная смесь при хранении во влажном воздухе плохо рассевается 239> 24?-249.
Система NH4NO3—NH4H2P04—Н20 представляет большой практический интерес в связи с расширяющимся производством сложного удобрения типа нитроаммофоски. Совместная растворимость компонентов данной системы была исследована для 100—200° 250. В связи с целесообразностью извлечения NH3 из коксового газа растворами фосфатов аммония изучалось равновесие в системе H3P04—NH3—С02—H2S—Н20 251.
В системе NH4H2P04—NaNOg—Н20 в диапазоне температур 0— 110° кристаллизуются NH4H2P04, NaH2P04-2H20, NaN03, лед 252.
Все большее внимание уделяется изучению свойств и технологии полифосфатов аммония, получаемых аммонизацией суперфосфорной кислоты 253.
Полифосфаты аммония представляют собой смесь аммонийных солей орто-, пиро-, Триполи — и других полифосфорных кислот 254″259. Полифосфаты аммония являются стойкими соединениями и хорошо растворимыми в воде 260-261, что важно для использования их в качестве удобрений. Содержание питательных веществ в них колеблется в пределах: N — 13—22% и Р205 — 54—68%. О свойствах полифосфатов и стабильности кристаллических фаз в системе NH3— —Н4Р207—Н20 при 25° и в системе NH3—Н5РзО10—Н20 при 0 и 25° — СМ. 262-264 _
Из ортофосфатов аммония промышленностью производятся только моно — и диаммонийфосфат; триаммонийфосфат ввиду его нестойкости не изготовляют. Производят также полифосфаты аммония.
Наиболее широкое применение как фосфаты аммония, так и по — Лифосфаты аммония нашли в сельском хозяйстве в качестве удобрения. Они содержат два основных питательных элемента — азот и фосфор — в водорастворимой форме. Фосфаты аммония применяют также в виде компонентов комплексных удобрений и для поучения ЖИДКИХ удобрений 265-274..
Фосфаты аммония являются высококонцентрированным удобре Лием благодаря большому содержанию питательных веществ, именно — (в вес. %):
Отношения N : Р2О5 составляют для NH4H2PO4 1 : 5 и для (NH4)2HP04 1 :2,5. В диаммонийфосфате это соотношение является более благоприятным, однако вследствие своей меньшей устойчивости, чем моноаммонийфосфат, один диаммонийфосфат в качестве удобрения не применяется, а используют его смесь с моноам — лгонийфосфатом. Такую смесь называют аммофосом.
Для увеличения отношения азота к фосфору к смеси фосфатов аммония добавляют какое-либо азотное удобрение, например сульфат аммония. В этом случае смесь называют сульфоаммофо —
Фосфаты аммония применяют также в пищевой и фармацевтической промышленности; их используют и в качестве антипире — нов — для пропитки тканей, дерева и строительных материалов с целью придания им огнестойкости.
В последнее время благодаря тому, что были разработаны специальные методы выращивания крупных кристаллов моноаммонийфосфата, последние нашли применение для изготовления осцилляторов высокой частоты, используемых в электронной технике6’278.
Технический диаммонийфосфат, согласно ГОСТ 8515—57, выпускают двух марок — А и Б, — в которых должно содержаться, соответственно, не менее 50,5 и 48,5% Р205 и не более: 22,4 и 21,5% NH3, 6 и 8% влаги.
Сырьем для производства фосфатов аммония являются аммиак и ортофосфорная кислота, как экстракционная, так и термическая 276,277>279-28*.
TOC o «1-3» h z Фосфорная кислота нейтрализуется по реакциям: .j
Как видно из рис. 371, наибольший выход твердого монофосфата аммония достигается при осуществлении процесса по лучу АВ. Пви нейтрализации экстракционной кислоты, содержащей 35— 40% Н3Р04, выход кристаллов даже при 25° небольшой; поэтому предпочитают использовать предварительно выпаренную кислоту. При нейтрализации термической фосфорной кислоты (75% Н3Р04) состав системы соответствует точке С и количество образующейся твердой фазы весьма велико даже при температуре массы выше 75°. Этому способствует и испарение части воды за счет тепла реакции.
При применении с целью получения аммофоса экстракционной фосфорной кислоты, загрязненной примесями, в процессе нейтрализации ее аммиаком, по достижении рН = 4—5,5, выделяются в осадок фосфаты железа и алюминия. Выделяется также гипс. Эти вещества осаждаются в форме кристиллогидратов (CaS04-2H20, FeP04-2H20, Fe2(S04)3-9H20 и т. п.), что связано с удалением из раствора некоторого количества воды 289
Для того чтобы получаемая при нейтрализации пульпа не была слишком густой (это затрудняет поглощение ею аммиака), концентрация исходной фосфорной кислоты не должна быть слишком высокой. Чем больше в кислоте примесей железа и алюминия, тем ее концентрация должна быть ниже для того, чтобы компенсировать убыль воды, переходящей в твердую фазу с осадками, образующимися из примесей. Обычно исходная экстракционная фосфорная кислота, полученная из флотированных фосфоритов, берется с концентрацией 23—26% Р2О5, а более чистая кислота из апатитового концентрата — 26—30 % Р2О5.
Фосфаты аммония, получаемые из термической фосфорной кислоты, обладают высокой чистотой, не содержат примесей и используются в основном в пищевой, фармацевтической промышленности или для других технических целей. Концентрация термической кислоты не должна быть выше 77% Н3Р04.
В настоящее время фосфаты аммония производят несколькими способами, которые отличаются между собой условиями нейтрализации кислоты и процессом кристаллизации готового продукта 294-296
При использовании термической фосфорной кислоты процесс может быть осуществлен по сатураторной схеме 297 и по схеме с кристаллизацией в вакуум-кристаллизационной установке 298.
При нейтрализации экстракционной фосфорной кислоты, загрязненной примесями, выделяющиеся в осадок фосфаты железа и алюминия, гипс и другие примеси остаются в готовом продукте, загрязняют его и снижают содержание основных компонентов. Для получения более чистого продукта из экстракционной фосфорной кислоты процесс нейтрализации ведут в две ступени. Сущность Двухступенчатой нейтрализации состоит в том, что в первой ступени неупаренная кислота нейтрализуется до рН = 4—4,5. При этом в осадок выделяется большая часть примесей, которые зат 312>313.
Сушку диаммонийфосфата производят при температуре не выше 60° во избежание потери им аммиака и перехода в моноаммоний- фосфат. Сушку же моноаммонийфосфата можно вести при температуре до 100—110°.
Фосфаты аммония можно получать и другими способами, например действием аммиака на раствор монокальцийфосфата или на водную суспензию дикальцийфосфата (т. е. используя суперфосфат) 314
Или взаимодействием хлористого аммония с фосфорной кислотой в присутствии бутилового и изоамилового спиртов. Степень превращения достигает 85% 3i5-3is_
Процесс нейтрализации фосфорной кислоты можно также вести путем распыления Н3РО4 с помощью дискового распылителя в башне в атмосфере аммиака, который поглощается каплями кислоты 319-323
Изучался процесс получения азотно-фосфорного удобрения в конусно-цилиндрическом аппарате с псевдоожиженным слоем, в котором были совмещены процессы нейтрализации кислоты аммиаком, выпарки, грануляции и сушки. Подогретая кислота распыляется с помощью форсунки в поток поступающей непосредственно под решетку подогретой аммиачно-воздушной смеси 324. Исследовалась возможность получения фосфатов аммония с высоким содержанием азота за счет частичного образования (МН4)3Р04 325.
Разработан способ получения кристаллического NH4H2PO4 нейтрализацией экстракционной фосфорной кислоты (49% Н3Р04) при Р = 2,1 ат и 165—170° с последующим распылением плава в башне высотой 15 м 325> 327 Полученный кристаллический NH4H2PO4 может быть подвергнут грануляции или использован для получения комплексных удобрений 328-331 ^
Фосфаты аммония можно получать также путем воздействия фосфорсодержащих компонентов на сульфат аммония 332. Наблюдается тенденция замены серной кислоты фосфорной в процессе Улавливания аммиака из коксового газа с получением моно — и ди — аммонийфосфатов. Этот процесс может быть осуществлен как по старой сатураторной схеме, так и по бессатураторной схеме с
Вакуум-выпаркой 327> 333-340
Этот процесс эффективен тем, что раствор NH4H2P04 поглощает только один аммиак341-342. В НИУИФ разработан способ для промышленного использования отбросных сернистых газов цветной металлургии с получением аммофоса. Этот метод основан на поглощении SO2 из газов аммиаком с последующим разложением получаемых при этом растворов сульфит-бисульфита аммония фосфорной кислотой:
Получающуюся аммофосную пульпу перерабатывают в аммофос по схеме с сушкой в распылительной сушилке. Удаляемый из пульпы сернистый ангидрид может быть использован для получения серной кислоты 343>344.
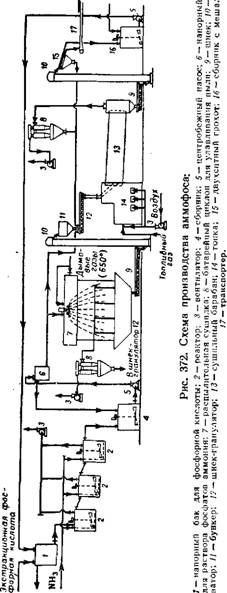
Схема производства аммофоса с применением распылительной сушки пульпы 345, при которой не требуется предварительной выпарки и очистки фосфорной кислоты, изображена на рис. 372. Экстракционная фосфорная кислота (22—28% Р205) нейтрализуется аммиаком непрерывным способом последовательно в нескольких реакторах 2. Вытекающая из последнего реактора пульпа поступает в распылительную сушилку 7. Сушка в распылительной сушилке производится дымовыми газами с температурой 650°, получающимися в топке при сжигании газообразного топлива. Выходящие из сушилки дымовые газы имеют температуру 100° и проходят для очистки от пыли батарейный циклон 8.
Высушенный порошкообразный аммофос непрерывно дозируется в шнек-гранулятор 12, куда одновременно поступает также мелкая фракция готового продукта и пульпа аммофоса. Из шнека-грануля — тора гр анулированныи s ммофос поступает в сушилку барабанного типа 13. Сушку осуществляют дымовыми газами (500°) из топки 14. Высушенные гранулы рассеивают.
Фракцию с размером зерен больше 4 мм растворяют в фосфорной кислоте, идущей на аммонизацию; мелкую фракцию с частицами меньше 1 мм направляют в гранулятор; фракцию с. частицами
J_ 4 мм выпускают в качестве
Жит 51% усвояемой Р2О5 и 11 ционной фосфорной кислоты, полученной из апатитового концентрата, и 47 % усвояемой Р2О5 и 10,7% N при использовании кислоты, полученной из фосфоритов Каратау.
О других вариантах получения ортофосфатов аммония с другим аппаратурным оформлением см. 346″348.
Получение аммофоса из фосфатных руд, содержащих соединения магния (фосфориты Каратау, Кингисеппские и др.), осложнено выделением в процессе аммонизации фосфорной кислоты осадка магнийаммо- нийфосфата MgNH4P04 • Н20. Он присоединяется к осадкам фосфатов полуторных окислов и это приводит к загустеванию реакционной пульпы. Путем ступенчатой нейтрализации фосфорной кислоты газообразным аммиаком можно последовательно выделить в твердую фазу полуторные окислы и магнийаммонийфосфат 349’35°. После их отделения и выпарки оставшегося чистого раствора можно получить крупнокристаллический (или гранулированный) фосфат аммония. По такой схеме можно эффективно перерабатывать Даже очень бедные и плохо обогащаемые флотацией фосфориты, содержащие, например, меньше 20% Р205 и боль — ще 4% MgO. Отфильтрованный и высушенный магнийаммонийфосфат может применяться в качестве самостоя тельного азотно-фосфорномаг —
16 м. Е. Позин готового продукта. Продукт содер — ,5% N при использовании экстрак —
Ниевого удобрения, содержащего азот в цитратнорастворимой форме, или же в смеси с аммофосом.
Для получения хорошо фильтрующих осадков аммонизацию ведут при 80° сначала до рН 3,0—3,2, затем, после отделения осадка фосфатов железа и аммония, добавляют к фильтрату соду или сульш фат натрия с целью его обесфторивания. Это обеспечивает образе® вание хорошо фильтрующего осадка магнийаммонийфосфата прЩ последующей аммонизации до рН 6—6,5. Осадок кремнефторида ■ натрия, образующийся при обесфторивании раствора, может быть отфильтрован вместе с магнийаммонийфосфатом. Высушенный при 95—100° магнийаммонийфосфат содержит, например, 45,4% Р2О5, 17,5% MgO и 12,7% NH3.
При переработке описанным способом образца недообогащен — ного Кингисеппского фосфорита, содержащего 19,65% Р205, 4,28% MgO, 1,36% R2O3 и 1,52% фтора, основные компоненты распределялись следующим образом. В неотмытый осадок фосфатов полуторных окислов перешло 50,8% Р2О5 от его исходного количества в фосфорной кислоте, из них 40,4% в виде водорастворимого фосфата аммония и 10,4% в виде цитратнорастворимых соединений. В неотмытый осадок магнийаммонийфосфата перешло 17,4% Р2О5 и в очищенном растворе осталось 31,8% Р2О5. Следовательно, при смешении фосфатов полуторных окислов с готовым продуктом — аммофосом в него перейдет 82,6% Р205, из которых 87,4% — в водорастворимой форме (в виде фосфатов аммония) и 12,6% —в цитратнорастворимой. С магнийаммонийфосфатом удаляется 73,/% MgO от исходного количества, остальное переходит в аммофос в виде цитратнорастворимого димагнийфосфата (8,65% MgO) и водорастворимых кремнефторида и сульфата магния (16,65% MgO). В аммофос переходит 90,8% израсходованного аммиака (из них 87,4% в виде фосфатов аммония), остальные 9,2% NH3 — в магнийаммонийфосфат.
Разложение природного фосфата серной кислотой можно вести с применением в качестве реакционной среды кислого раствора моноаммонийфосфата. При этом образуется осадок гипса, фильтрующий лучше, чем при разложении в отсутствие иона аммония, и производительность фильтров значительно увеличивается. Улучшается на 1—1,5% и степень отмывки кислоты от осадка. Реакционный раствор после разложения фосфата становится более кислым, чем до разложения, и, после отделения гипса, его нейтрализуют аммиаком для перевода вновь образовавшейся кислоты в моноаммонийфосфат. Затем часть этого раствора вместе с частью суспензии гипса возвращают в первый сернокислотный экстрактор, а остальную часть после аммонизации до требуемой степени высушивают для получения аммофоса.
Аммофос может быть получен непосредственно из природных фосфатов без предварительной их переработки в фосфорную кислоту. Этот способ351 заключается в разложении фосфата концентрированным раствором фтористого аммония по реакции: 2Ca5F (Р04)3 + I8NH4F = 10CaF2 + 6 (NH4)3_X Нд. Р04 + 6*NH3
При 95—102° и трех-четырехкратном избытке 35—45%-ного раствора NH4F против стехиометрического количества апатитовый концентрат разлагается в течение 2—6 ч практически полностью. После отделения осадка CaF2 разделение содержащихся в растворе фосфатов аммония от избытка фторида аммония можно осуществить или выпаркой с кристаллизацией, или введением в раствор соединений алюминия для осаждения гексафторалюмината аммоНия—аммониевого криолита 3NH4F — A1F3 352. В последнем случае остается раствор, из которого получается аммофос, содержащий, например,
15% N. Из криолита легко регенерируется NH4F. Из CaF2 фтористый аммоний может быть регенерирован гидротермическим (стр. 1116) или гидрохимическими способами, например, конверсией в СаС03 и др. Сырьем для получения аммофоса по этой схеме являются только природный фосфат и аммиак—расход кислотного реагента (серной кислоты) полностью исключается. Потери фтора при регенерации его из фтореда кальция и криолита, а также с раствором фосфатов аммония компенсируются за счет фтора, содержащегося в природном фосфате. Остальная часть этого фтора может быть выпущена в виде фторидов— CaF2, AIF3 (см. ниже) или других. Отсутствует неорганизованное выделение фтористых газов, что улучшает санитарные условия производства; уменьшается потребность в специальных кор — розионноустойчивых материалах, так как разложение идет в нейтральной среде — величина рН конечного расТвора 6,7—6,9.
Фосфаты полуторных окислов, так же как и фосфат кальция, легко разлагаются фторидом аммония; при этом образуются фосфаты аммония и криолиты по реакции:
Поэтому этот способ позволяет вовлечь в производство удобрений природные фосфаты и фосфорные промышленные отходы с большим содержанием полуторных окислов, что расширяет сырьевую базу туковой промышленности.
При получении аммофоса по обычной схеме — с предварительным сернокислотным разложением природного фосфата — введение в реакционную пульпу NH4F увеличивает использование сырья (Р2О5) за счет выделения полуторных окислов в форме криолитов 353 Это позволяет и в этом процессе применять сырье с повышенным содержанием полуторных окислов.
Этим же методом можно получать фторид алюминия с пониженным содержанием Р205 через гексафторалюминат аммония из Газов суперфосфатного производства.
http://ru.thpanorama.com/articles/qumica/fosfato-de-amonio-frmula-propiedades-y-usos-principales.html
http://msd.com.ua/texnologiya-mineralnyx-solej-udo-brenij-pesticidov-promyshlennyx-so-lej-okislov-i-kislot/fosfaty-ammoniya/