Формула, свойства и применение хлорноватистой кислоты (HClO)
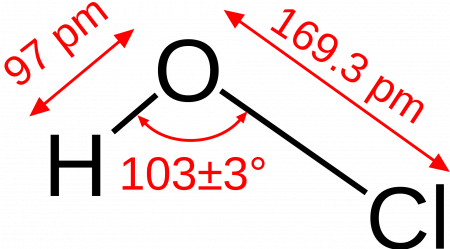
хлорноватистая кислота, также известная как моноксохлористая кислота (I), представляет собой химическое соединение формулы HClO. Это простая молекула с центральным кислородом, связанным с атомами хлора и водорода через простые связи.
Это хлорная кислота, которая имеет валентность (I). Это слабая кислота, которая обычно образуется, когда хлор растворяется в воде. Ссылка делается на несколько других названий, таких как: хлорная кислота, хлоранол, гипохлорит водорода и гидроксид хлора.
Хлорноватистая кислота вырабатывается в организме человека лейкоцитами для борьбы с инфекциями, поскольку она действует против широкого спектра микроорганизмов..
Добавление хлора к воде дает хлорноватистую кислоту вместе с соляной кислотой (HCl):
Cl2 + H2O ⇌ HOCl + HCl
Вышеуказанная реакция находится в равновесии, и нелегко выделить HOCl из этой смеси. Однако стабильные хлорноватистые соли могут быть получены растворением газообразного хлора в растворе гидроксида натрия или других водных растворах основания.
HOCl также может быть получен путем растворения монооксида дихлорида в воде (использование, свойства, структура и формула хлорноватистой кислоты, S.F.).
Cl2O + H2O → 2HOCl
- 1 Физико-химические свойства
- 2 Противомикробное действие
- 3 использования
- 3.1 Образование хлоргидрина
- 3.2 Косметическая индустрия
- 3.3 Водоподготовка
- 3.4 Лечение зуда
- 4 Ссылки
Физико-химические свойства
Хлорноватистая кислота существует только в виде водного раствора. Это бесцветный раствор, и его точные физические свойства являются переменными, поскольку они зависят от концентрации раствора. Безводную или сухую хлорноватистую кислоту невозможно приготовить, так как молекула находится в равновесии с ее ангидридом (Национальный центр биотехнологической информации., 2017).
Его молекулярная масса составляет 52,46 г / моль, а его рКа — 7,53. Растворим в воде.
HOCl является сильным окислителем и может образовывать взрывоопасные смеси. Это также восстановитель, способный окисляться до хлорной, хлорной и хлорной форм кислоты. В водных растворах, будучи слабой кислотой, он частично диссоциирует на ионы гипохлорита (OCl-) и Н+.
HOCl реагирует с основаниями с образованием солей, называемых гипохлоритами. Например, гипохлорит натрия (NaOCl), активный ингредиент в отбеливателе, образуется при взаимодействии хлорноватистой кислоты с гидроксидом натрия (Royal Society of Chemistry, 2015).
HOCl + NaOH → NaOCl + H2O
Хлорноватистая кислота также легко реагирует с различными органическими молекулами и биомолекулами..
Хлорноватистая кислота не считается вредной, поскольку она встречается в низких концентрациях в организме человека и обладает антимикробным действием..
Хлорноватистая кислота медленно реагирует с ДНК и РНК, а также со всеми нуклеотидами in vitro..
GMP является наиболее реактивным, потому что HClO реагирует как с гетероциклической группой NH, так и с аминогруппой.
Точно так же TMP только с одной гетероциклической группой NH, которая реагирует с HClO, является вторым наиболее реактивным.
AMP и CMP, которые имеют только одну медленно реагирующую аминогруппу, менее реагируют с HClO.
Сообщалось, что UMP реагирует только очень медленными темпами. Гетероциклические NH-группы более реакционноспособны, чем аминогруппы, а их вторичные хлорамины способны отдавать хлор.
Эти реакции, вероятно, влияют на спаривание оснований ДНК, и, в соответствии с этим, сообщалось об уменьшении вязкости ДНК, подверженной воздействию HClO, подобно тому, которое наблюдается при денатурации при нагревании (Prütz, 1996)..
Остатки сахара нереактивны, а основа ДНК не разрушается. NADH может реагировать с хлорированным TMP и UMP, а также с HClO. Эта реакция может регенерировать UMP и TMP и приводит к 5-гидроксипроизводному NADH.
Реакция с TMP или UMP медленно обратима для регенерации HClO. Вторая, более медленная реакция, приводящая к расщеплению пиридинового кольца, происходит, когда присутствует избыток HClO. НАД + инертен к HClO.
Антимикробное действие
За последние 15 лет самые передовые растворы хлорноватистой кислоты, основанные на электрохимии, стали безопасными и жизнеспособными средствами для очистки ран, а также дополнительными методами лечения инфекций..
Гипохлорный раствор (HOCl) является сильным окислителем и имеет тенденцию удалять электроны из другого вещества. Его натриевая соль, гидроксид натрия (NaClO) или его кальциевая соль, гидроксид кальция (Ca (ClO) 2) обычно используются в отбеливателях, дезодорантах и дезинфицирующих средствах..
HOCl существует в качестве естественного эндогенного компонента у людей и животных и является важной частью врожденной иммунной системы. HOCl продуцируется нейтрофильными гранулоцитами, наиболее распространенным типом лейкоцитов у млекопитающих. Участвует на последнем этапе окислительного маршрута в борьбе с инфекцией и вторжением чужеродных веществ.
Когда клетка обнаруживает инвазию чужеродного вещества, она подвергается фагоцитозу, во время которого нейтрофил поглощает и усваивает микроорганизмы или инородные частицы. Это фагоцитарное событие приводит к секреции активных форм кислорода и гидролитических ферментов (Kavros, S.F.).
Потребление кислорода во время генерации активных форм кислорода, называемых «реактивным взрывом», включает активацию фермента NADPH оксидазы, который производит большое количество супероксида..
Этот высокоактивный вид кислорода разлагается на перекись водорода, которая затем превращается в HOCl. HOCl проявляет бактерицидные свойства и немедленно уничтожает бактерии, проглоченные нейтрофилами. Несмотря на значительную активность HOCl против микроорганизмов, он не является цитотоксичным для клеток человека или животных. Вероятно, это связано с его эндогенным присутствием в иммунной системе клеток млекопитающих (Chanson Water Ionizers USA, Inc, 2016).
Недавно было высказано предположение, что бактериальная инактивация с помощью HOCl является результатом ингибирования репликации ДНК. Когда бактерии подвергаются воздействию HOCl, происходит резкое снижение синтеза ДНК, которое предшествует ингибированию синтеза белка и очень похоже на потерю жизнеспособности (Davies, 1988)..
Во время репликации бактериального генома источник репликации (oriC в E.coli) связан с белками, которые связаны с клеточной мембраной, и было обнаружено, что обработка HOCl уменьшает сродство мембран, экстрагированных для oriC, и эта близость уменьшается параллельно с потерей жизнеспособности.
В работе Henry Rosen (1998) они сравнили степень ингибирования HOCl репликации плазмидной ДНК с разными источниками репликации и обнаружили, что некоторые плазмиды проявляют задержку ингибирования репликации по сравнению с плазмидами, которые они содержали oriC. Группа Розена предположила, что инактивация мембранных белков, участвующих в репликации ДНК, является механизмом действия HOCl..
приложений
Образование хлоргидринов
Хлорноватистая кислота используется в органическом синтезе, превращая алкены в хлоргидрины.
Хлорноватистая кислота реагирует с ненасыщенными связями в липидах, но не в насыщенных связях, и ион ClO не участвует в этой реакции.
Эту реакцию получают путем гидролиза с добавлением хлора к одному из атомов углерода и одного гидроксила к другому. Полученное соединение представляет собой хлоргидрин. Полярный хлор разрушает липидный бислой и может увеличить проницаемость.
Когда образование хлоргидрина происходит в липидных бислоях эритроцитов, проницаемость увеличивается. Прерывание может произойти, если образуется достаточно хлоргидрина.
Добавление предварительно образованных хлоргидринов к эритроцитам также может влиять на проницаемость. Холестерин хлоргидрины также наблюдались, но не сильно влияют на проницаемость, и считается, что Cl2 ответственен за эту реакцию
Косметическая индустрия
В косметической промышленности его используют в качестве очищающего средства для кожи, которое приносит пользу коже тела, а не вызывает высыхание. Он также используется в детских продуктах, потому что кожа ребенка особенно чувствительна и может легко раздражаться.
Обработка воды
При обработке воды хлорноватистая кислота является активным дезинфицирующим средством в продуктах на основе гипохлорита (например, используемых в плавательных бассейнах)..
В сфере общественного питания и водораспределения специальное оборудование для выработки слабых растворов HClO из воды и соли иногда используется для выработки достаточного количества безопасного (нестабильного) дезинфицирующего средства для обработки поверхностей и расходных материалов для приготовления пищи. воды.
Лечение зуда
Недавно местная хлорноватистая кислота (HOCl) была предложена для лечения зуда. Предложены два механизма, с помощью которых HOCl может уменьшить зуд:
1) HOCl является бактерицидным по отношению к кожным патогенам, особенно Золотистый стафилококк при атопическом дерматите.
2) HOCl является противовоспалительным и снижает активность гистамина, лейкотриена B4 и интерлейкина-2, все они участвуют в патофизиологии зуда.
Существуют условия, при которых HOCl может фактически вызвать зуд как неблагоприятное воздействие. Например, HOCl повышает активность фактора роста нервов, что способствует зуду. Длительное воздействие или высокая доза HOCl также могут вызывать раздражающий контактный дерматит или, реже, аллергический контактный дерматит (Robert Y. Pelgrift, 2013).
Соединения хлора
Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
- при очень сильном нагревании
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
- взаимодействует с основными и амфотерными оксидами:
- реагирует с основаниями и амфотерными гидроксидами:
- Вступает в реакцию с аммиаком:
- взаимодействует с солями более слабых кислот:
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. При этом анион Cl — окисляется до свободного хлора:
2Cl — — 2e — = Cl2 0
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
- Реакция гипохлоритов с диоксидом углерода и водой :
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO –слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая кислота разлагается:
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
- Разложениегипохлоритов при нагревании:
- Кислоты, более сильные, чем хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
- Взаимодействуют с другимисолями, если продуктом является слабый электролит:
Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
- Вступает в реакциис щелочами с образованием хлоритов:
- При длительном хранении разлагается:
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
- реагируют с сильными кислотами:
- являются слабыми восстановителями и сильными окислителями в кислой среде:
Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
- Окисляет некоторые вещества:
- Разлагается при слабом нагревании:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
- Хлораты сильные окислители.
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с щелочами с образованием перхлоратов:
- Как сильный окислитель окисляет многие вещества:
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильнымиокислителями
- Взаимодействуют с сильными кислотами:
- При нагревании более 550ºС разлагаются:
Оксиды хлора
Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
- Является сильным окислителем:
- При температуре выше 20ºС или на свету разлагается:
Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
- Разлагается в концентрированной хлороводородной кислоте:
- Проявляет окислительно-восстановительные свойства:
Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
- При нагревании разлагается:
Хлорноватистая кислота
| Хлорноватистая кислота | |||
|---|---|---|---|
| |||
| Систематическое наименование | Хлорноватистая кислота | ||
| Хим. формула | HClO | ||
| Состояние | бесцветный водный раствор | ||
| Молярная масса | 52.46 г/моль | ||
| Константа диссоциации кислоты pKa | 7.497 | ||
| Рег. номер CAS | 7790-92-3 | ||
| PubChem | 24341 | ||
| Рег. номер EINECS | 232-232-5 | ||
| SMILES | |||
| ChEBI | 24757 | ||
| ChemSpider | 22757 | ||
| Пиктограммы ECB |   | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорноватистая кислота — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
Содержание
Свойства
В водных растворах хлорноватистая кислота частично распадается на катион H + и гипохлорит-анион ClO −
Неустойчива, постепенно разлагается даже в разбавленных водных растворах на хлороводород и атомарный кислород, благодаря которому является сильным окислителем:
Реагирует с соляной кислотой HCl, образуя газообразный хлор:
Как и хлорноватистая кислота, её соли — гипохлориты — являются сильными окислителями. Многие из них неустойчивы. Кристаллогидрат LiClO ⋅ H2O выдерживает длительное хранение; NaClO ⋅ H2O при 70 °C разлагается со взрывом, а KClO известен только в виде водных растворов. Ca(ClO)2 в сухом виде вполне устойчив, но в присутствии H2O и CO2 разлагается. Более стоек Mg(ClO)2.
Получение
Хлорноватистая кислота получается при растворении хлора (реакция диспропорционирования) или оксида хлора(I) в воде.
Cl2 + H2O ⟶ HClO + HCl Cl2O + H2O ⟶ 2HClO
В промышленном масштабе производятся гипохлориты кальция, натрия, калия, лития хлорированием известкового молока и соответствующих щелочей.
Применение
Хлорноватистая кислота и гипохлориты легко разлагаются с выделением атомарного кислорода и поэтому широко используются для отбелки целлюлозы и тканей, а также для санитарных целей.
http://zadachi-po-khimii.ru/neorganicheskaya-ximiya/soedineniya-xlora.html
http://chem.ru/hlornovatistaja-kislota.html