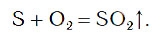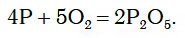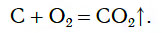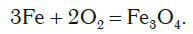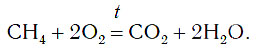Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Химические свойства кислорода — характеристика, строение и основные реакции
В 1772 году шведский химик Шееле открыл элемент кислород. Химические свойства этого вещества оказались воистину уникальными: он реагирует практически со всеми металлами (кроме золота и платины), взаимодействует с неметаллами, органическими и неорганическими веществами. Позднее, в 1774 году, это же доказал и английский ученый Пристли.
Нахождение в природе и физические свойства
Кислород (формула O2) — элемент, который наиболее распространен в земной коре (его весовое содержание составляет 49,13%). Также он содержится в воздухе, где его 23%, входит в состав воды (88,9%), во всех оксидах и кислородосодержащих солях. Общая характеристика кислорода при обычных условиях:
- бесцветный газ;
- не имеет запаха;
- плохо растворим в воде (как и в других растворителях);
- сжижается при -183°C, а затвердевает при -219°C.
Примечательно, что в жидком и твердом состоянии O2 приобретает цвет: он становится голубым. А еще он притягивается магнитом.
В таблице периодической системы находится в главной подгруппе (классе) VI группы. Элементы, расположенные здесь, на внешнем электронном слое имеют по 6 электронов, поэтому могут либо присоединять 2 электрона, либо (кроме кислорода) отдавать 4 или 6 электронов. Именно этим и объясняются их физ. и хим. свойства.
При нормальных условиях чистый кислород малоактивен, но в присутствии воды его реакционная способность усиливается. Реакции, которые протекают с участием этого вещества, называются горением. К этому процессу относится и ржавление, а также дыхание (медленное горение).
Примечание: химическая сущность дыхания состоит в соединении углерода и водорода органических веществ с кислородом.
Химические характеристики и соединения
С точки зрения химии, этот элемент — типичный активный неметалл. Во всех соединениях он проявляет степень окисления -2 (исключение — реакции с фтором). Как может протекать взаимодействие веществ с кислородом:
- Уравнения взаимодействия с металлами. 2Ca + O2 → 2CaO (оксид кальция или негашеная известь); 4Al + 3O2 → 2Al2O3.
- Реакции с неметаллами — в результате образуются несолеобразующие оксиды. S+O2 → SO2 (сернистый газ); N2 + O2 → 2NO (окись азота).
Кроме этих веществ, кислород хорошо вступает в реакции с органическими и неорганическими соединениями (с серой, углеродом, сульфидами металлов — то есть с соединениями, которые горючи в атмосфере O2). Со сложными веществами взаимодействие будет протекать по плану (реакции горения):
- CH4 + 2O2 → CO2 + 2H2O.
- 4Fe (OH)2 + O2 + 2H2O → 4Fe (OH)3.
Справка: в атомарном состоянии элемент более активен, чем в молекулярном. Именно на этом свойстве основано применение кислорода в качестве отбеливающего агента — так легче разрушаются окрашивающие органические вещества.
В молекулярном состоянии кислород может существовать в виде O2 и озона O3, то есть для него характерно явление аллотропии (существование нескольких простых веществ одного и того же химического элемента).
Оксиды и пероксиды
Если говорить кратко, можно сказать, что кислород образует два типа соединений: оксиды и пероксиды. При этом первые из названых можно рассматривать как производные воды (схема): H-O-H, Na-O-Na. Вторые же можно охарактеризовать как пероксидов водорода (тоже схематично): H-O-O-H, Na-O-O-Na.
Получить оксиды можно несколькими способами. Первый — это непосредственным взаимодействием с элементами, а второй — разложение при нагревании гидроксидов или солей. Примеры:
- Непосредственное взаимодействие. 2Mg + O2 → 2MgO.
- Разложение. Cu (OH)2 → CuO + H2O; CaCO3 → CaO + CO2.
С кислородом не будут прямо соединяться галогены, некоторые газы и благородные металлы. Щелочные металлы, за исключением лития, при взаимодействии будут образовывать пероксиды или супероксиды: 2Na +O2 → Na2O2; K + O2 → KO2 (супероксид).
Ряд окислов может соединяться с водой, образуя гидроксиды кислот — такие будут называться кислотными оксидами или ангидридами. К таким относятся SO2 (сернистый ангидрид), CO2 (угольный ангидрид). Те кислородные соединения, которые с водой образуют основания, именуют основными.
Часть оксидов обладает амфотерными свойствами. Гидроксиды таких соединений могут выступать кислотами или основаниями.
Высшие оксиды металлов (то есть те, где он находится в высшей степени окисления) всегда обладают кислотными свойствами: V2O5, Cr2O3. Известна также группа индифферентных (несолеобразующих) окислов: CO, SiO, NO.
Большинство бинарных кислородных соединений устойчивы к нагреванию. А вот оксиды благородных металлов при повышении температуры легко разлагаются.
Озон (O3) — аллотропная модификация
Это соединение образуется при медленном окислении влажного белого фосфора, а также при разложении концентрированной серной кислоты, перманганата калия, бихромата калия и некоторых других соединений (в этом случае O3 — примесь).
В природе озон образуется при окислении смолы хвойных деревьев, ультрафиолетовом облучении кислорода в верхних слоях атмосферы. Качественная реакция на присутствие O3 в воздухе:
O3 + 2KI + H2SO4 → I2 + K2SO4 + H2O + O2.
В промышленности его получают при действии тихого электрического заряда на O2: 3O2 → 2O3. Реакция протекает в специальном приборе — озонаторе, чистое вещество отделяется сжижением.
По внешнему виду — синяя жидкость, взрывоопасная. От соприкосновения с ним эфиры, спирты, скипидар воспламеняются. Озон разрушает многие органические вещества, а микроорганизмы вообще убивает. Какие химические свойства характерны для него:
- при воздействии на ненасыщенные органические вещества O3 присоединяется к ним по месту двойной связи, в результате чего образуются озониды;
- это сильный окислитель.
Благодаря своим бактерицидным свойствам озон широко применяется в промышленности: в пивоваренном производстве, для обеззараживания воды.
Получение кислорода
Один из методов получения — рефракционная перегонка воздуха, но такой кислород содержит около 3% инертных газов (в основной это аргон). Другой вариант — ректификация жидкого воздуха. Этот процесс можно кратко описать так:
- воздух сжимают при давлении 100−200 атм;
- нагревают, после чего охлаждают в специальных аммиачных холодильниках;
- охлажденную смесь пропускают через дроссель, при выходе из которого давление резко падает.
При расширении газов температура понижается, и воздух сжижается. Эта операция повторяется многократно для увеличения выхода конечного продукта.
Сжиженный воздух — смесь газов (в основном это азот и кислород, остальных там меньше 1%). Из-за разницы температур кипения (у N2 она -195,8°C, кислород закипает при -183°C) из жидкого воздуха отгоняется азот, а затем O2.
Полученный этим методом кислород содержит примеси азота, поэтому его подвергают дополнительной очистке.
В лаборатории его можно получить несколькими способами. Основные из них:
- Разложение бертолетовой соли. Реакция протекает при повышенной температуре и в присутствии катализатора, в роли которого используют диоксид марганца: 2KClO3 → 2KCl + 3O2.
- Процесс разложения перманганата калия при нагревании: 2KMnO4 → K2MnO4 + MnO2 + O2.
- Выделяют из нитратов щелочных металлов: 2NaNO3 → 2NaNO2 + O2.
- В процессе распада оксида ртути: 2HgO → 2Hg + O2.
Еще один способ синтеза — электролизация воды в присутствии гидроксидов щелочных металлов, например, KOH. Эти вещества добавляются для увеличения электропроводности.
Применение и промышленное значение
Благодаря своим свойствам кислород широко применяется в технике. В присутствии этого элемента окислительные процессы протекают гораздо интенсивнее, чем в простом воздухе. При этом повышается температура пламени. Поэтому O2 активно применяется для интенсификации окисления в химической и металлургической промышленности (выплавка чугуна и стали, обжиг сульфидных руд, резка металлов и прочее).
Смеси жидкого кислорода с горючими веществами (углерод, сера, древесные опилки) под названием оксиликвиты используются как взрывчатое вещество в горной и горнодобывающей промышленности (при проведении горно-взрывных работ). Чистый O2 применяется в медицине (при лечении бронхиальной астмы, органов ЖКТ — приготовление специальных коктейлей, и прочее), в кислородных приборах при работе под землей и под водой, на больших высотах. Незаменим он и в процессе производства ракетного топлива (окислитель).
Урок 18. Физические и химические свойства кислорода
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.
Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм 3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку : При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
http://kupuk.net/uroki/himiya/himicheskie-svoistva-kisloroda-harakteristika-stroenie-i-osnovnye-reakcii/
http://himi4ka.ru/arhiv-urokov/urok-18-fizicheskie-i-himicheskie-svojstva-kisloroda.html