Химические свойства основных классов неорганических соединений
Кислотные оксиды
Кислотный оксид + вода = кислота (исключение — SiO 2 )
SO 3 + H 2 O = H 2 SO 4
Cl 2 O 7 + H 2 O = 2HClO 4
Кислотный оксид + щелочь = соль + вода
SO 2 + 2NaOH = Na 2 SO 3 + H 2 O
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
Кислотный оксид + основный оксид = соль
CO 2 + BaO = BaCO 3
SiO 2 + K 2 O = K 2 SiO 3
Основные оксиды
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H 2 O = Ca(OH) 2
Na 2 O + H 2 O = 2NaOH
Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl 2 + H 2 O
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Основный оксид + кислотный оксид = соль
MgO + CO 2 = MgCO 3
Na 2 O + N 2 O 5 = 2NaNO 3
Амфотерные оксиды
Амфотерный оксид + кислота = соль + вода
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K 2 ZnO 2 + H 2 O (Правильнее: ZnO + 2KOH + H 2 O = K 2 [Zn(OH) 4 ])
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O (Правильнее: Al 2 O 3 + 2NaOH + 3H 2 O = 2Na[Al(OH) 4 ])
Амфотерный оксид + кислотный оксид = соль
ZnO + CO 2 = ZnCO 3
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na 2 O = Na 2 ZnO 2
Al 2 O 3 + K 2 O = 2KAlO 2
Cr 2 O 3 + CaO = Ca(CrO 2 ) 2
Кислоты
Кислота + основный оксид = соль + вода
2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
3H 2 SO 4 + Fe 2 O 3 = Fe 2 (SO 4 ) 3 + 3H 2 O
Кислота + амфотерный оксид = соль + вода
3H 2 SO 4 + Cr 2 O 3 = Cr 2 (SO 4 ) 3 + 3H 2 O
2HBr + ZnO = ZnBr 2 + H 2 O
Кислота + основание = соль + вода
H 2 SiO 3 + 2KOH = K 2 SiO 3 + 2H 2 O
2HBr + Ni(OH) 2 = NiBr 2 + 2H 2 O
Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH) 3 = CrCl 3 + 3H 2 O
2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO 3 = CaBr 2 + H 2 O + CO 2
H 2 S + K 2 SiO 3 = K 2 S + H 2 SiO 3
2HCl + Zn = ZnCl 2 + H 2
H 2 SO 4 (разб.) + Fe = FeSO 4 + H 2
Важно: кислоты-окислители (HNO 3 , конц. H 2 SO 4 ) реагируют с металлами по-другому.
Амфотерные гидроксиды
Амфотерный гидроксид + кислота = соль + вода
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 6H 2 O
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH) 2 + 2NaOH = Na 2 ZnO 2 + 2H 2 O
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O
Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
Sn(OH) 2 + 2NaOH = Na 2 [Sn(OH) 4 ]
Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ]
Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]
Щелочи
Щелочь + кислотный оксид = соль + вода
Ba(OH) 2 + N 2 O 5 = Ba(NO 3 ) 2 + H 2 O
2NaOH + CO 2 = Na 2 СO 3 + H 2 O
Щелочь + кислота = соль + вода
3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O
Bа(OH) 2 + 2HNO 3 = Ba(NO 3 ) 2 + 2H 2 O
Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na 2 ZnO 2 + H 2 O (Правильнее: 2NaOH + ZnO + H 2 O = Na 2 [Zn(OH) 4 ])
Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH) 2 = Na 2 [Zn(OH) 4 ]
NaOH + Al(OH) 3 = Na[Al(OH) 4 ]
Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH) 2 + Cu(NO 3 ) 2 = Cu(OH) 2 + Ca(NO 3 ) 2
3KOH + FeCl 3 = Fe(OH) 3 + 3KCl
Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H 2 O = Na 2 [Zn(OH) 4 ] + H 2
2KOH + 2Al + 6H 2 O = 2K[Al(OH) 4 ] + 3H 2
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na 2 SiO 3 + 2HNO 3 = 2NaNO 3 + H 2 SiO 3
BaCO 3 + 2HCl = BaCl 2 + H 2 O + CO 2 (H 2 CO 3 )
Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO 3 ) 2 + K 2 S = PbS + 2KNO 3
СaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl
Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO 3 ) 2 + 2NaOH = 2NaNO 3 + Cu(OH) 2
2FeCl 3 + 3Ba(OH) 2 = 3BaCl 2 + 2Fe(OH) 3
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO 4 = ZnSO 4 + Cu
Cu + 2AgNO 3 = Cu(NO 3 ) 2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Химические свойства неорганических веществ уравнения
1. Основные классы неорганических соединений
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Горение простых веществ:
Горение (обжиг) сложных веществ:
Разложение сложных веществ:
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ? (оксиды остальных металлов нерастворимы)
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ? (амфотерные оксиды нерастворимы в воде)
ZnO + 2NaOH >t> Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
– растворимые (щелочи) NaOH, KOH;
– однокислотные NaOH, KOH;
Получение нерастворимых и амфотер-ных оснований:
NaOH > Na + + OH? (? = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
Свойства нерастворимых оснований:
Fe(OH)2 — FeOH + + OH? (? + — Fe 2+ + OH? (? t> FeO + H2O
Свойства амфотерных оснований:
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:
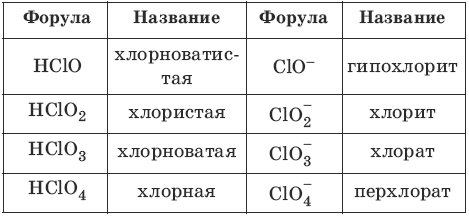
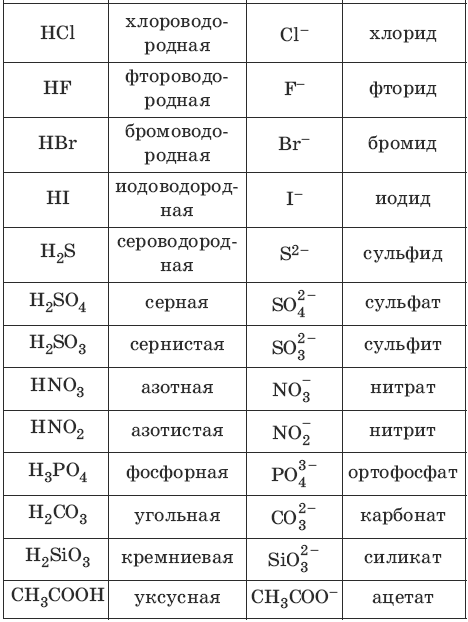
Химические свойства кислот
HCl > H + + CI? (? =1) (лакмус – красный)
HCO3? — H + + CO3 2- (? MgOH + + CI? (? = 1)
MgOH + — Mg 2+ + OH? (? Na + + Н + + SO4? (? = 1)
CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений)
Pb + ZnCl2 ? (Pb после Zn в ряду напряжений)
Разложение некоторых солей при нагревании
CaCO3 >t> CaO + CO2 (роме устойчивых карбонатов щелочных металлов)
2NaNO3 >t> 2NaNO2 + O2 (металл до Mg в ряду напряжений)
2Pb(NO3)2 >t> 2РbO + 4NO2 + O2 (металл от Mg до Cu в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металл после Cu в ряду напряжений)
NH4Cl >t> NH3 + HCl (при охлаждении идет в противоположном направлении)
4KClO3 >400 °C> KCl + 3KClO4
Связь между классами соединений
Металл — основный оксид — основание — соль
Неметалл — кислотный оксид — кислота — соль
Атомы этих элементов имеют электронную формулу ns 1 . Они являются сильными восстановителями. Их активность растет от лития к цезию. Для них характерна степень окисления +1. В природе щелочные металлы находятся в виде хлоридов, сульфатов, карбонатов, силикатов и т. д.
Щелочные металлы мягкие, легко режутся ножом, на свежем срезе имеют серебристую окраску. Все они легкие и легкоплавкие металлы с хорошей электропроводностью. В парообразном состоянии атомы щелочных металлов образуют молекулы Э2, например Na2.
2.1. Получение и химические свойства щелочных металлов
2NaCl >электролиз расплава> 2Na + Cl2
KCl + Na >800?С> К + NaCl
Горение в кислороде
Реакции с другими неметаллами
Реакции с водой и разбавленными кислотами
2Na + 2HCl = 2NaCl + H2^
2.2. Получение и химические свойства соединений щелочных металлов
Оксиды. Оксиды щелочных металлов являются активными основными оксидами.
Гидроксиды. Гидроксиды щелочных металлов – растворимые основания, щелочи. Их степень диссоциации увеличивается от LiOH к CsOH.
NaOH > Na + + OH? (? ? 1)
Гидриды. Гидриды щелочных металлов – восстановители.
NaH + HCl = NaCl + H2
Пероксиды и надпероксиды. Являются окислителями.
Соли. Хорошо растворяются в воде. Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия – в желтый цвет, соли калия – в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
Элементы IIА-группы имеют электронную формулу ns 2 . Все они являются металлами, сильными восстановителями, несколько менее активными, чем щелочные металлы. Для них характерна степень окисления +2 и валентность II. Щелочноземельные металлы: Са, Sr, Ba, Ra. В природе элементы IIА-группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Элементы IIА-группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
3.1. Получение и химические свойства простых веществ
Элементы IIА-группы – менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Са, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
3.2. Получение и химические свойства соединений
Оксид бериллия – амфотерный оксид. Оксид магния – нерастворимый основный оксид. Оксид кальция – растворимый основный оксид.
Гидроксид бериллия – амфотерное основание. Гидроксид магния – нерастворимое основание. Гидроксиды щелочноземельных металлов – щелочи.
Имеют восстановительные свойства.
Содержание ионов Са 2+ и Mg 2+ обуславливает жесткость воды: временную, если есть гидрокарбонаты Са и Mg, и постоянную, если в воде есть хлориды или сульфаты Са и Mg.
Элементы IIIА-группы имеют электронную формулу ns 2 np 1 . Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3 и валентность III. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.
Соединения Тl 3+ являются сильными окислителями и восстанавливаются до соединений Тl + .
4.1. Химические свойства бора и его соединений
4.2. Химические свойства алюминия и его соединений
4Al + 3O2 = 2Al2O3 (металл покрыт оксидной пленкой)
2Al + 6Н2O = 2Al(OH)3 + ЗН2 (без оксидной пленки)
Оксид алюминия – амфотерный оксид
Гидроксид алюминия – амфотерный гидроксид.
Соли алюминия гидролизуются. Некоторые из них (Al2S3, Al2(CO3)3) полностью разлагаются водой.
Элементы IVA-группы имеют электронную формулу ns 2 np 2 . Углерод и кремний являются неметаллами, германий, олово, свинец – металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность IV. В возбужденном состоянии атомы имеют конфигурацию ns 1 np s , в этом состоянии для них характерна sp 3 -гибридизация.
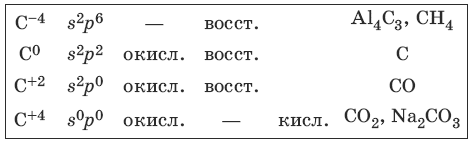
5.1. Свойства углерода и его соединений
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
С + CuO >t> Cu + CO
Свойства оксида углерода (II) – угарного газа
CO + NaOH >t, p> HCOONa
Свойства оксида углерода(IV) – углекислого газа
Свойства карбонатов и гидрокарбонатов
5.2. Получение и свойства кремния и его соединений
SiH4 + 2O2 = SiO2 + 2Н2O (самовоспламенение на воздухе)
Кремниевая кислота и силикаты. Кремниевая кислота имеет полимерное строение и состав xSiO2 • yH2O. H2SiO3 – условная формула, такого соединения не выделено.
5.3. Получение и свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфо-терные свойства. При этом в степени окисления элемента +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 – кислотные. Соединения Sn 2+ имеют восстановительные свойства, а соединения РЬ 4+ – окислительные:
Элементы VA-группы имеют электронную формулу ns 2 np s . Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2O5 имеют кислотные свойства, свойства оксидов Э2O3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi.
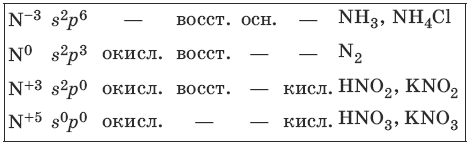
6.1. Получение и свойства азота и его соединений
Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
HNO3(конц.) пассивирует на холоду Al, Fe, Cr.
2KNO3 >t> 2KNO2 + O2 (металлы до Mg в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металлы после Cu в ряду напряжений)
6.2. Получение и свойства фосфора и его соединений
Простое вещество (Р4 – белый фосфор, Р – красный фосфор)
VIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns 2 np 4 . Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d-орбитали, поэтому его валентность равна двум. Наличие d-орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
7.1. Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства кислорода
Кислород может быть получен при сжижении и разделении воздуха.
Получение и свойства озона O3
Свойства пероксида водорода
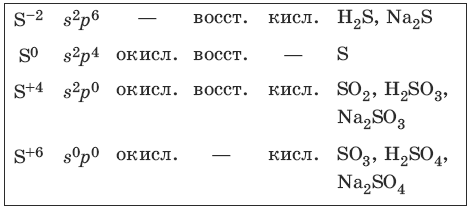
7.2. Сера и ее соединения
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2.
Получение и свойства серы
Получение и свойства соединений серы (-2)
H2S — H + + HS? — 2H + + S 2-
Получение и свойства соединений серы (+4)
Получение и свойства соединений серы (+6)
Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr.
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns 2 np 5 . Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
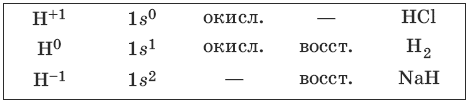
Электронная формула атома водорода 1s 1 . С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s 2 . Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
8.1. Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Кислород в молекуле воды находится в состоянии sp 3 -гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
8.3. Фтор и его соединения
Фтор является наиболее активным неметаллом, сильным окислителем.
8.4. Хлор и его соединения
Хлор – тяжелый газ желто-зеленого цвета, с резким запахом.
2NaCl + 2Н2O >электролиз раствора> Н2 + Cl2 + 2NaOH
Cl2 + Н2O = HCl + HClO (реакция диспропорционирования)
HClO = HCl + О (атомарный кислород – окислитель)
Смесь CaCl2 и Са(ClO)2 – хлорная, или белильная, известь.
KClO3 – хлорат калия, или бертолетова соль.
Сила кислот растет в ряду:
8.5. Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор > бром > иод.
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
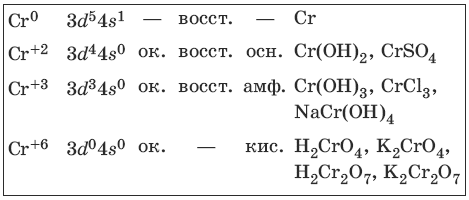
9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства хрома
FeO • Cr2O3 + 4CO >t> Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
Свойства соединений хрома (+6)
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
Дихромат калия – окислитель в кислой среде.
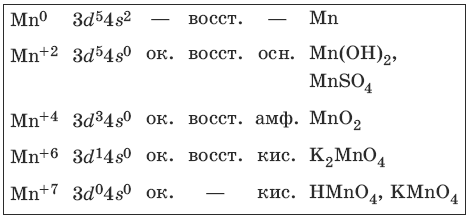
9.2. Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства марганца
FeO • Mn2O3 + 4CO >t> Fe + 2Mn + 4CO2 (Fe + 2Mn) – ферромарганец
Свойства соединений марганца (+2)
Свойства соединений марганца (+4)
MnO2 – устойчивый амфотерный оксид, сильный окислитель.
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
Свойства соединений марганца (+7)
Сильные окислители в кислой среде.
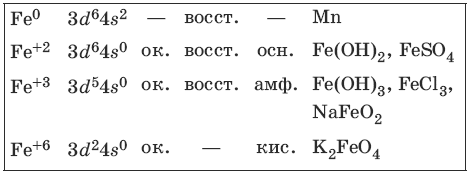
9.3. Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Соединения железа (+8) малохарактерны.
Получение и свойства железа
4Fe + 3O2 + 2Н2O = 4FeO(OH)v (коррозия на воздухе)
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
Свойства соединений железа (+2)
Гидроксид железа(II) сразу окисляется кислородом воздуха.
Свойства соединений железа (+3)
Fe(OH)3v + NaOH ? не идет в разбавленном растворе
Свойства соединений железа (+6)
Феррат калия – окислитель.
9.4. Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
Свойства соединений меди(I)
Свойства соединений меди(II)
Cu(OH)2v + NaOH ? не идет в растворе
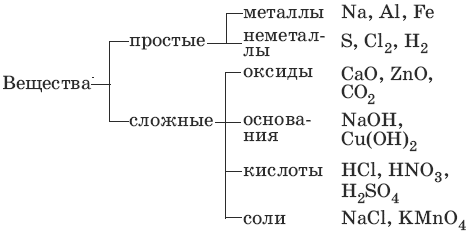
Классификация неорганических веществ
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Амфотерные (греч. ἀμφότεροι — двойственный)
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)
Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь 🙂
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Блиц-опрос по теме Классификация неорганических веществ
http://www.telenir.net/himija/sbornik_osnovnyh_formul_po_himii_dlja_vuzov/p2.php
http://studarium.ru/article/161