Химические свойства кислот — формулы, уравнения и примеры взаимодействия
Склонность к диссоциации
В водных растворах кислоты свободно диссоциируют на катионы водорода и кислотные остатки. Этот процесс не занимает много времени. Все кислоты делятся на малодиссоциирующие и диссоциирующие. Для корректного построения уравнения сильных одноосновных соединений может быть использована одна направленная вправо стрелка (→), либо знак равенства (=). Таким способом можно показать необратимость такой диссоциации. К примеру, самое элементарное уравнение диссоциации соляной кислоты можно записать двумя способами: HCl → H + + CL — или HCl = H + + CL — . Оба варианта являются правильными.
Используемая стрелка нужна для того, чтобы наглядно показать, что обратный процесс объединения кислотных остатков с катионами водорода практически не происходит. Если по условиям задачи нужно будет написать уравнение диссоциации одноосновного слабого соединения, тогда будет использоваться уже 2 стрелки (↔), которые будут направлены в разные стороны. Этот приём используется в химии для того, чтобы показать обратимость диссоциации слабых соединений. Такой подход особенно актуален в том случае, когда ярко выражен обратный процесс объединения имеющихся катионов водорода с кислотными остатками.
Химический процесс может происходить ступенчато. В этом случае речь касается многоосновных веществ, у которых катионы водорода отрываются от молекул не одновременно, а по очереди. Для выражения диссоциации понадобиться уже несколько уравнений, итоговое количество которых будет соответствовать основности кислот. Для лучшего понимания этого правила следует рассмотреть пример. При использовании трехосновной фосфорной кислоты диссоциация протекает сразу в три ступени с поочерёдным открытием катионов Н + :
- Н3РО4 ↔ Н + + Н2РО4 — .
- Н2РО4 — ↔ Н + + НРО4 2- .
- НРО4 2- ↔ Н + + РО4 3- .
Для правильного решения аналогичных задач нужно понимать, что каждая последующая степень диссоциации всегда протекает в меньшей степени, нежели предыдущая. Такое явление основано на увеличении заряда кислотных остатков, из-за чего прочность связи между ними и положительными ионами только возрастает.
Среди многоосновных веществ в категорию исключений входит только H2SO4. Это связано с тем, что это соединение диссоциирует сразу по двум ступеням.
Специфическое окисление
Из уроков химии достоверно известно, что сила концентрации H2SO4 и HNO3 способна удивлять. Эти вещества воздействуют не только на металлы, которые расположены до водорода в ряду активности, но и на другие элементы после него (за исключением золота, платины).
Кислородсодержащие азотные и серные кислоты могут окислить не только серебро и медь, но и ртуть. Но нужно понимать, что некоторые металлы (Fe, Al, Cr) являются довольно активными, так как расположены до водорода, но они не реагируют на HNO3, H2SO4 без предварительного нагревания. Это связано с пассивацией. На поверхности таких металлов образуется защитная плёнка, состоящая из твёрдых продуктов окисления. Благодаря этому молекулы H2SO4 и HNO3 не могут проникать вглубь металла для активации химической реакции. Но если температура будет высокой, тогда окисление произойдёт.
Если речь идет о взаимодействии кислот с металлами, тогда обязательными продуктами будет соль и вода. Дополнительно выделяется третий продукт, формула которого зависит от активности металлов, температуры химической реакции. Каждая ситуация является индивидуальной.
Азотная и серная кислоты отличаются высокой окислительной способностью, что позволяет им вступать в химическую реакцию практически со всеми металлами ряда активности, а также с твёрдыми неметаллами. Например, фосфор, углерод, сера. Наглядно увидеть список продуктов взаимодействия H2SO4, HNO3 с металлами можно увидеть в таблице кислот. В 8 классе химия изучается не углублённо, но выучить названия химических элементов и их свойства нужно обязательно.
Восстановительные реакции
Окислители представляют собой частицы (атомы, ионы, молекулы), которые во время химической реакции принимают электроны. При этом степень окисления постепенно понижается, а окислители восстанавливаются.
Все известные бескислородные кислоты (за исключением HF) под воздействием различных окислителей проявляют восстановительные свойства, но это только благодаря химическому элементу, который входит в состав аниона. К примеру, дихроматом калия, диоксидом марганца, перманганатом калия окисляются все галогеноводородные соединения. В категорию исключений входит только HF. А вот галогенид-ионы могут окисляться только до свободных галогенов. Химическую реакцию можно оформить следующим образом:
- 4HCl + MnJ2 → MnCl2 + Cl2↑ + 2H2O.
- 16Br + 2KMnO4 → 2KBr + 2MnBr2 + 8H2O + 5Br2.
- 14Hl + K2Cr2O7 → 3l2↓ + 2Crl3 + 2Kl + 7H2O.
Иодоводород среди всех галогеноводородных соединений обладает наибольшей восстановительной активностью. Окислить его могут даже оксид и соли трёхвалентного железа. Не меньшей восстановительной активностью обладает сероводород H2S.
Для получения кислот электролизу подвергают растворы солей, образовавшиеся благодаря кислотному остатку. К примеру, электролиз раствора сульфата меди.
Химические свойства
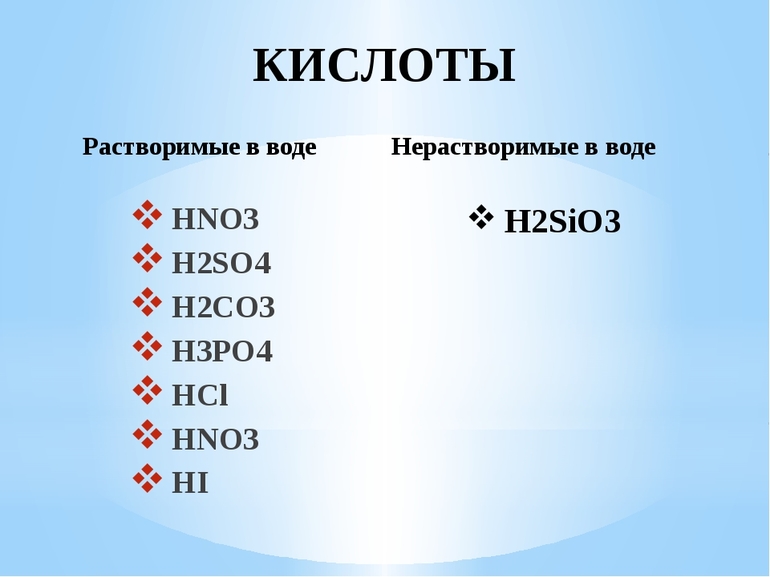
Все существующие кислоты можно поделить на две категории: растворимые и нерастворимые. Некоторые из этих веществ могут самопроизвольно разлагаться и в водном растворе практически исчезают. Речь касается неустойчивых соединений. Эту тему подробно изучают на уроках химии в 8 классе. Все кислоты обладают определёнными физическими и химическими свойствами, которые нужно выучить для сдачи ЕГЭ:
- Многие виды кислот могут растворяться в воде, существенно повышая её кислотность. Для определения химического соединения в конкретном растворе используются специальные индикаторы: лакмусовая бумажка окрашивается в красный цвет.
- Кислоты взаимодействуют с атмосферными основаниями и оксидами, из-за чего образуется вода и соли. Из-за электролита такие реакции всегда проходят до конца. Растворению подвергаются многие оксиды.
- Кислоты могут вступать в реакцию с солями, но это только при условии образования газообразных либо малорастворимых веществ.
- Сильные кислоты взаимодействуют со щелочами. Реакция нейтрализации происходит на фоне того, что не только кислая, но и щелочная среда в сумме образуют нейтральную среду воды. Это интересная химическая реакция, которую можно записать следующим образом: Н + + ОН- → Н2О.
Кислоты взаимодействуют с металлами, но для этого должны быть соблюдены определённые условия. В процессе химической реакции образуется соль и выделяется водород. В категорию исключений входят только те ситуации, когда металлы взаимодействуют с H2SO4 и HNO3.
Сферы применения
Химические вещества используются практически во всех отраслях современной промышленности. Но в настоящее время минеральные и органические кислоты применяются в следующих сферах:
- Борная кислота (H3BO3). Получила большой спрос в медицине как надёжное антисептическое средство. H3BO3 используется при пайке различных металлов, это вещество также добавляют в удобрения и применяют для борьбы с тараканами.
- В домашних условия при выпечке сдобных изделий не обойтись без лимонной и уксусной кислот, их также используют для удаления накипи с кранов, чайников.
- Хорошо всем известная аскорбиновая кислота, которая также известна как витамин С, применяется при простудных заболеваниях.
- Серная кислота (H2SO4). Активно используется в химической промышленности. H2SO4 используется для производства эффективных минеральных удобрений, лакокрасочных материалов. Часто используется в пищевой промышленности (например, пищевая добавка Е513), а также в качестве электролита, когда речь касается производства аккумуляторных батарей.
- Специальная хромовая смесь (раствор двухромовокислого калия в H2SO4) применяется в лабораторных условиях для очистки химической посуды. Это вещество является сильным окислителем, благодаря чему помогает максимально быстро и качественно удалить следы загрязнения органическими веществами. Хромовая смесь также используется в органическом синтезе.
- Азотная кислота (HNO3). Благодаря своим уникальным свойствам получила спрос в производстве взрывчатых веществ. Именно HNO3 используют при производстве востребованных в сельскохозяйственной отрасли азотосодержащих удобрений (например, калиевая и аммиачная селитра), а также для изготовления медикаментозных средств («Нитроглицерин»).
При использовании любой из кислот нужно соблюдать правила безопасности, так как такие вещества могут нанести серьёзный вред здоровью.
В 8 классе на уроках химии даётся общая информация по кислотам. Но учащимся нужно запомнить, что это сложные соединения, в составе которых содержатся атомы водорода, замещающиеся атомами металлов и кислотных остатков. Изучаемые химические элементы наделены определёнными свойствами. Например, могут взаимодействовать с оксидами, солями и металлами.
Химические свойства простых веществ. Химические свойства сложных вещест
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
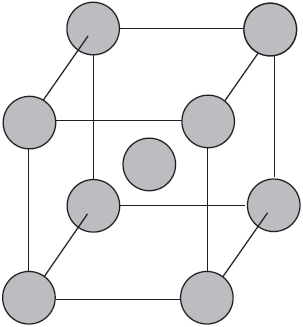
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
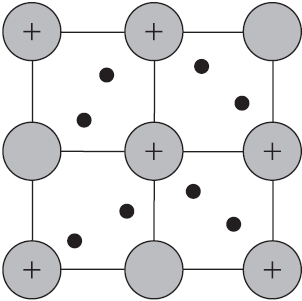
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
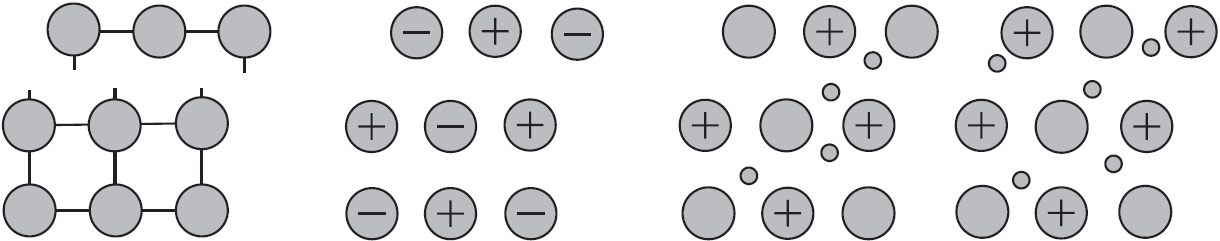
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
Химические реакции: типы, свойства, уравнения
Содержание:
Характеристика реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Видео
И в завершение интересно видео про самые удивительные химические реакции.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Reactions.
Похожие посты:
4 комментария
Спасибо за статью, хотелось бы также больше узнать про химические реакции ферментов и необратимые химические реакции.
Пожалуй эти темы заслуживают отдельной статьи.
1. Вы пишете: “Зная константу равновесия можно определить направление протекания химической реакции.” Одного знания константы равновесия бывает недостаточно. В общем случае, необходимо знать еще концентрации веществ.
2. Про тепловой эффект реакции сразу видно, что переписан без пояснений соответствующий абзац из учебника. Может даже не школьного. Но народу будет не до конца понятно.
3. В начале статьи вы заикаетесь о биохимических реациях и далее даже говорите о том, что есть сложные реакции. И далее не слова про них. Интуитивно понятно, что сложные реакции это совокупность нескольких. Но по хорошему надо бы хотя бы обозначить определение. И пару предложений сказать про биохимические реакции
4. Вы пишете: “К факторам скорости химической реакции можно отнести:
природу реагирующих веществ,
наличие катализатора,
температуру,
давление,
площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.” Перфекционисту, такое утверждение будет резать слух. Например, вы ничего не говорите о концентрациях, а также не разделяете гомогенные и гетерогенные реакции-для них немного разный набор влияющих факторов. Некоторые из указанных вами факторов не так сильно влияют на скорость (если влияют вообще).
4. Указывая признаки протекания химической реакции вы выделяете яркие, заметные но не всегда проявляемые факторы, а также не эти признаки являются фундаментальным признаком протекания химической реакции. Таковым является изменение количества(концентрации) реагирующих веществ. И именно эти изменения фиксируют, т.н. кинетические кривые, снимаемые по ходу реакции графики зависимости какого-либо параметра от количества вещества.
5. Если уж вас спросили в комментариях, и вы сами вкратце касаетесь понятия химического равновесия и т.н. константы равновесия можете в дальнейшем указать, что необратимые это те реакции, у которых очень большое значение константы равновесия.
И еще предложение “При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.” Перечитайте! Кто отличает ядерные реакции от химических (условно говоря, 90% школьников) им это предложение ни к чему. А кто захочет разобраться (те самые 10% кто не различает ядерные и химические реакции) они ничего не поймут!
http://examer.ru/oge_po_himii/teoriya/himicheskie_svojstva_prostyh_veshhestv
http://www.poznavayka.org/himiya/himicheskie-reaktsii-tipyi-svoystva-uravneniya/