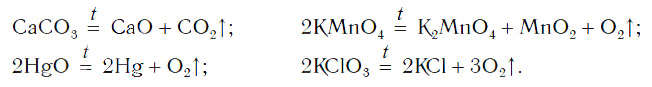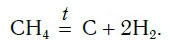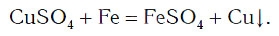Урок химии по теме «Реакции замещения». 8-й класс
Разделы: Химия
Класс: 8
Тип урока: изучение нового материала.
Цели и задачи урока: Дать понятие о сущности реакции замещения. Продолжить формирование умения записывать уравнения химических реакций, начать формировать умение предсказывать продукты реакций замещения. Дать первоначальное понятие об электрохимическом ряде напряжений.
Оборудование: прибор для получения газов, Zn, Мg, А1, Сu, Са — металлы, растворы НС1, СиSО4, АgNO3, медная монета.
План урока.
- Химические реакции
- Признаки химической реакции
- Уравнение реакции.
- Типы химических реакций
- Понятие о реакциях замещения на примере взаимодействия кислот с металлами. Демонстрация взаимодействия металлов с кислотами и выделение водорода.
- Электрохимический ряд напряжений металлов и два его правила. Эксперимент (взаимодействие металлов с кислотами).
- Схема эксперимента и выводы из опыта.
- Доказательство через уравнения реакций.
- Выполнение упражнений для закрепления полученных знаний.
- Домашнее задание.
Ход урока
1 этап урока – подготовка к изучению нового материала, актуализация знаний и опыта.
Ставятся вопросы для уточнения содержания основных понятий.
- Дайте определение химическим реакциям
- По каким признакам мы определяем, что процесс относится к химическим?
- что называют уравнением химической реакции?
- Какие типы реакций вам известны?
2 этап урока – проблемно-поисковый.
Сегодня мы познакомимся еще с одним типом реакций. Попробуем научиться предсказывать продукты химических реакций. Для этого повторим опыт лорда Генри Кавендиша (получение водорода Zn + 2HCl = ZnCl2 + H2).
В результате данной реакции выделяется водород.
Вопрос. Почему я собираю этот газ в перевернутую вверх дном пробирку? (если у ребят возникают затруднения поясняем способ собирания газа)
Подносим пробирку к пламени спиртовки. Раздается “лающий” звук. Закрываем газоотводную трубку и через 5 -10 с подносим к пламени раздается легкий хлопок. Почему мы наблюдаем разные результаты? (версии учащихся).
Объяснение проверки водорода на чистому. Правила техники безопасности выполнения эксперимента.
Запишем уравнение реакции:
Кроме водорода будут ли другие продукты реакции?
Проведем следующий опыт: На предметное стекло поместим каплю раствора из пробирки-реактора, выпариваем, на стекле белое пятно – это соль ZnCl2.Учащему, предлагается дописать уравнение реакции и расставить коэффициенты. Следовательно, из исходных простого и сложного вещества образовались новое простое и новое сложное. Определение реакции замещения (записываем в тетрадь). Предлагается записать уравнение реакции магния с соляной кислотой, и более сложный вариант: алюминия с серной кислотой.
Вопрос. А любой ли металл способен вступать в реакцию замещения с кислотой?
Демонстрация: в четырех пробирках находится соляная кислота. В первую опускаем Ca, вторую – Mg, третью – Zn, четвертую – Cu. Почему выделение водорода происходит с разной скоростью, а в четвертой пробирке не выделяется вообще? Для ответа можно воспользоваться еще одной узаконенной “шпаргалкой” – электрохимическим рядом напряжения металлов ( его можно также назвать рядом активности металлов).
Если металл стоит в этом ряду до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет (записываем в тетрадь).
Это и есть 1-е правило ряда напряжений. Ca, Мg, А1 давали реакцию замещения с кислотами (они находятся в ряду напряжений до Н), а Сu нет (она после Н). Этот ряд имеет и еще одно правило, оно тоже относится к реакциям замещения металлов, но только с растворами солей:
если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли (2-е правило ряда напряжений) (записываем в тетрадь).
Проводится лабораторный опыт “Замещение меди в растворе сульфата меди (II) железом”, и учащиеся записывают соответствующее уравнение:
По аналогии составляется уравнение реакции между алюминием и раствором хлорида меди (II):
Необходимо показать, что здесь положение металла до или после Н уже не имеет значения, важно, чтобы вступающий в реакцию металл предшествовал металлу, образующему соль:
Серебро на медной монетке получается неэффектное — темный налет, но если его натереть мягкой тряпочкой — монета заблестит, она стала посеребренной.
Учащиеся формулируют выводы:
1) более активный металл вытесняет менее активный из раствора его соли с образованием другого металла и другой соли;
2) металлы расположенные в ряду напряжения до водорода вытесняют водород из растворов кислот;
3) все рассмотренные реакции относятся к реакциям замещения.
3 этап урока – закрепления изученного материала.
Учащиеся попарно выполняют задания по карточке.
- Напишите уравнения возможных реакций между серной кислотой и металлами: а) Zn, б) Сu, в) Fе, г) Ва.
- Напишите уравнения возможных реакций между сульфатом меди (II) и металлами: а) Аg, б) Zn, в) Mg.
Учащимся выдаются правильные ответы, заранее подготовленные учителем.
Дети проверяют и ставят себе оценку.
Объективно выставленные оценки заносятся в журнал.
4 этап – подведение итогов.
Делается вывод о достижении поставленных целей в результате проведенных исследований учащимися совместно с учителем. Результат – наличие положительного мотива к исследовательской деятельности.
Домашнее задание:§31, упр.2 стр.164.
Литература:
- Сгибнеа Е.П., Скачков А.В. Современные открытые уроки химии 8 – 9 классы. [Текст] / Е.П. Сгибнеа, А.В. Скачков – Ростов, 2002 г.
- Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. [Текст] / – О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова . – М., 2003 г.
- Андрейченко Е.И. Проблемно-поисковая (исследовательская) технология в обучении химии.[Текст] / Е.И. Андрейченко // Химия. Приложения 1 сентября.– 2008 – №16.
- Павлова Н.С. Дидактические карточки-задания по химии: 8 класс: .к учебнику О.С.Габриеляна “Химия.8 класс” .[Текст] / Н.С. Павлова. – М., 2004 г.
- Габриелян О.С. Химия 8 класс .[Текст] / О.С. Габриелян. – М.,2006 г.
Урок по химии в 8 классе «Типы химических реакций. Реакции замещения и обмена»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Урок по химии в 8 классе
Тема: «Типы химических реакций. Реакции замещения и обмена».
Образовательные: рассмотреть типы реакций по составу и сложности веществ – реакции замещения и обмена; обобщить сведения о типах химических реакций; закрепить умение составлять химические уравнения, описывать признаки реакций.
Развивающие: продолжить развитие умений наблюдать, сравнивать, обобщать, делать выводы, работать с химическими реактивами и оборудованием.
Воспитательные: воспитывать толерантность, уважение к научному познанию, умение работать в группе; совершенствовать коммуникативные умения в ходе выполнения опытов, развивать самостоятельность.
Требования к знаниям и умениям учащихся:
Должны знать и понимать: сущность понятия «химическая реакция» (взаимодействие, превращение), признаки и условия протекания химических реакций, типы реакций, правила написания химических уравнений, закон сохранения массы в современной формулировке, правила безопасной работы с веществами.
Должны уметь: определять тип химической реакции по данному уравнению, расставлять коэффициенты в данной схеме уравнения, доказывать закон сохранения массы по выведенному уравнению химической реакции, записывать уравнения реакций, самостоятельно производить несложные химические эксперименты, соблюдая правила безопасной работы.
Постановка учебной задачи, сообщение плана работы (слово учителя) –2 мин
Фронтальный опрос – 11 мин
Изучение нового материала, выполнение демонстрационного и лабораторных опытов учащимися – 25 мин
Повторение и проверка степени усвоения материала – 5 мин;
Подведение итогов и домашнее задание – 2 мин
Средства обучения: оборудование и реактивы для демонстрационных и лабораторных опытов учащихся, справочная таблица «Растворимость оснований, кислот и солей в воде», ряд активности металлов, учебник «Химия – 9» О,С,Габриелян (издательство ДРОФА,2012 г.), рабочая тетрадь к учебнику.
Тип урока – комбинированный.
Вид урока – беседа с демонстрационными и лабораторными опытами.
Оборудование (для учителя и учащихся): пробирки, штативы для пробирок, спиртовка, лучинка, спички, универсальная индикаторная бумага, предметное стекло, пипетка, держалка.
Реактивы: цинк (гранулы), алюминий, медь, стальные скрепки, растворы – гидроксид натрия, серная кислота, соляная кислота, сульфат меди ( II ), хлорид железа ( III ), карбонат натрия, хлорид калия, фенолфталеин.
Приветствие. Постановка учебной задачи, сообщение плана работы. Девиз урока:
«Скажи мне, и я забуду,
Покажи мне, и я запомню.
Дай мне действовать самому,
И я научусь!» (Древнекитайская мудрость)
Проверка домашнего задания.
1) Во время проверки домашнего задания учитель проверяет теоретические знания по пройденному материалу:
— какие классификации реакций вы знаете? (по тепловому эффекту и по составу и количеству веществ)
— на какие типы делятся реакции по тепловому эффекту? (эндотермические – идущие с поглощением тепла; экзотермические – идущие с выделением тепла)
— какие типы реакций вы знаете по количеству и составу веществ? (соединения и разложения)
— какие реакции называются реакциями разложения? (реакции, в результате которых из одного сложного вещества образуется несколько новых веществ)
— какие реакции называются реакциями соединения? (реакции, в результате которых из нескольких веществ образуется одно сложное вещество);
2) Визуально проверяет выполнение упр. 1 стр. 177 и упр. 1,2 стр.182;
3) Разбираются реакции, вызвавшие затруднения;
4) Проводится выполнение упр. 7,6 стр. 110 (РТ):
Упр.7 стр. 110 (РТ) (под диктовку с места):
а) 2 Na + Cl 2 → 2 NaCl (соединение)
в) 2 Fe ( OH )3 → Fe 2 O 3 + 3 H 2 O (разложение)
г) 4 Al + 3 O 2 → 2 Al 2 O 3 (соединение)
д) 2 AgBr → 2 Ag + Br 2 (разложение)
е) Na 2 O + H 2 O → 2 NaOH (соединение)
Упр. 6 стр. 110 (РТ) (по одному ученики вызываются к доске):
Во время написания уравнений проверяется умения записывать формулы по названиям веществ, называть вещества по формулам, расставлять стехиометрические коэффициенты в уравнении реакций; знания классов неорганических веществ и выученных типов химических реакций.
На доску вывешиваются карточки – подсказки по типам реакций.
Изучение нового материала.
1) Реакции замещения. Проведение лабораторного опыта №1 «Взаимодействие металлов с соляной кислотой». Повторение правил техники безопасности при проведении опытов. Повторение признаков химических реакций (выпадение или исчезновение осадка, выделение газа, появление запаха, изменение цвета, выделение тепла и света, поглощение тепла). Класс работает по вариантам:
1 – взаимодействие цинка с кислотой ( Zn + 2 HCl → ZnCl 2 + H 2↑);
2 – взаимодействие алюминия с кислотой (2 Al + 6 HCl → 2 AlCl 3 + 3 H 2↑);
3 
Ученики, согласно инструкции выполняют лабораторные опыты, отмечают признаки химических реакций, записывают уравнения соответствующих химических реакций.
— как вы думаете, какой газ это выделяется?
— у меня есть пробирка, как собрать в неё выделяющийся водород? Почему?
— чтобы проверить водород, поднесем к отверстию зажженную лучинку – раздастся хлопок.
На примере первых двух реакций формулируется определение реакций замещения – реакций между простым и сложным веществами, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
На доску вывешивается карточка подсказка.
Почему же в третьем случае реакция не идет? Чтобы объяснить причину этого обратимся к ряду активности металлов. Работа с рядом активности металлов (почему водород расположен в этом ряду, как изменяется активность металлов).
Вывод: с кислотами взаимодействуют металлы, стоящие в ряду активности до водорода.
Используя этот ряд можно еще для прогнозирования возможности протекания реакций вытеснения одних металлов из растворов их солей другими. Проведение демонстрационного эксперимента №1: взаимодействие сульфата меди с железом и хлорида железа ( III ) с медью.
F
Вывод: чтобы реакция между металлом и раствором соли была практически осуществима, необходимо, чтобы металл в ряду активности находился левее, т.е. был активнее металла соли.
О
а) 2 Al + 3 CuCl 2 → 2 AlCl 3 + 3 Cu б) AlCl 3 + Cu →
в 
2) Реакции обмена. Проведение лабораторного опыта №2 «Взаимодействие растворов двух сложных веществ».
1 вариант – взаимодействие гидроксида натрия и сульфата меди ( II )
(щёлочь + соль1 → основание + соль2)
2 вариант – взаимодействие карбоната натрия и соляной кислоты
3 вариант – взаимодействие гидроксида натрия с соляной кислотой
NaOH + HCl → NaCl + H 2 O
(щёлочь + кислота → соль + вода)
реакция нейтрализации (объяснить почему такое название: кислота – среда кислая, щелочь – щелочная, в результате реакции – среда нейтральная)
Ученики, согласно инструкции выполняют лабораторные опыты, отмечают признаки химических реакций, записывают уравнения соответствующих химических реакций. При составлении первой реакции используется таблица растворимости.
На примере этих реакций формулируется определение реакций обмена – реакций между сложными веществами, при протекании которых их молекулы обмениваются своими составными частями.
На доску вывешивается карточка подсказка.
Проведение демонстрационного эксперимента №2: взаимодействие хлорида калия и гидроксида натрия.
N
Вопросы: наблюдаете ли вы признаки химической реакции? Какой можно сделать вывод? Когда же реакции ионного обмена идут до конца?
Вывод: реакции ионного обмена идут до конца, если выпадает осадок, выделяется газ или образуется вода.
Проведение демонстрационного эксперимента №3: взаимодействие серной кислоты и гидроксида меди ( II ).
Вопросы: наблюдаете ли вы признаки химической реакции? Какой можно сделать вывод?
Вывод: реакции нейтрализации между любым основанием и любой кислотой протекают до конца.
Отработка навыков – упр. 6 стр. 113 (РТ).
в 
Уравняйте реакции и укажите тип реакций по признаку «число и состав исходных веществ и продуктов реакции». (Во время работы учитель проверяет усвоение изученного материала, исправляет ошибки и корректирует работу учеников)
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
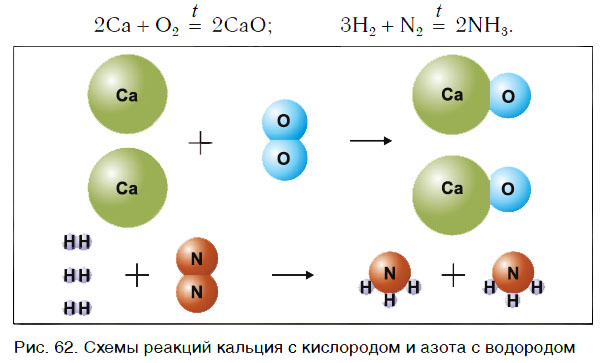
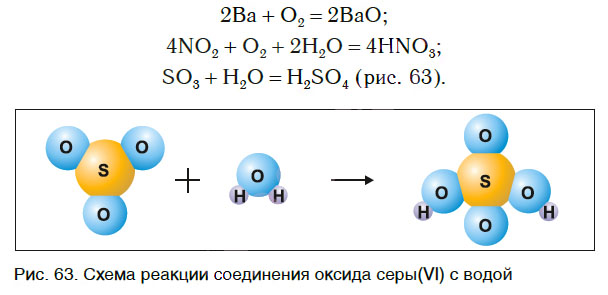
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
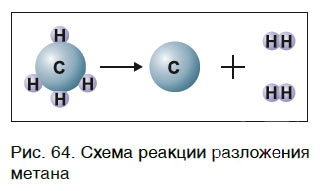
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
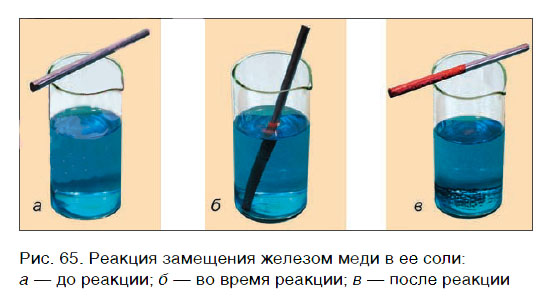
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
http://infourok.ru/material.html?mid=38603
http://himi4ka.ru/arhiv-urokov/urok-13-tipy-himicheskih-reakcij.html