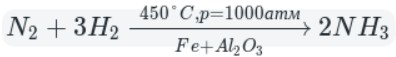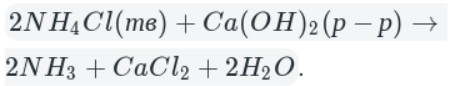Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
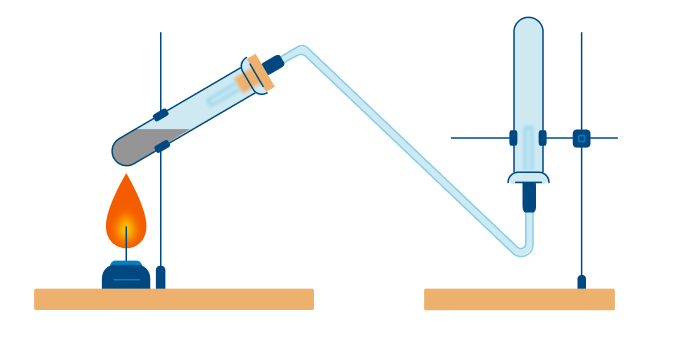
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
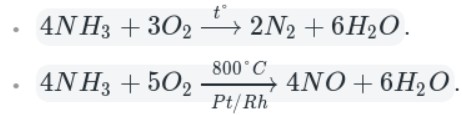
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Химические уравнения азота и аммиака
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 3 :
- N — 2s 2 2p 3
- P — 3s 2 3p 3
- As — 4s 2 4p 3
- Sb — 5s 2 5p 3
- Bi — 6s 2 6p 3
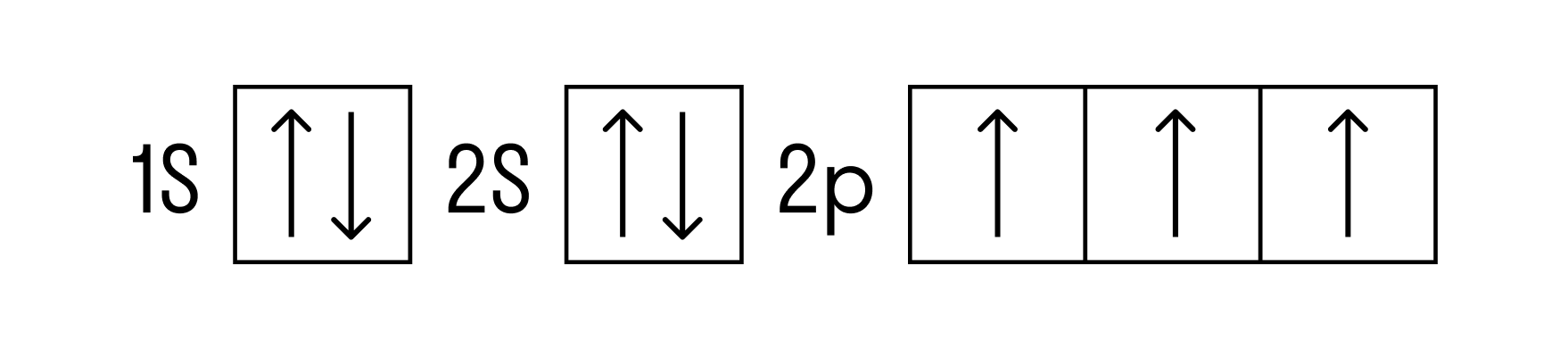
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
- Реакция с металлами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Реакция с неметаллами
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.
Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
Реакции с щелочами
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
Реакции с солями
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры — 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2 — ). Реагирует с водой, основаниями.
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
Реакции с водой и щелочами
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические уравнения азота и аммиака
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
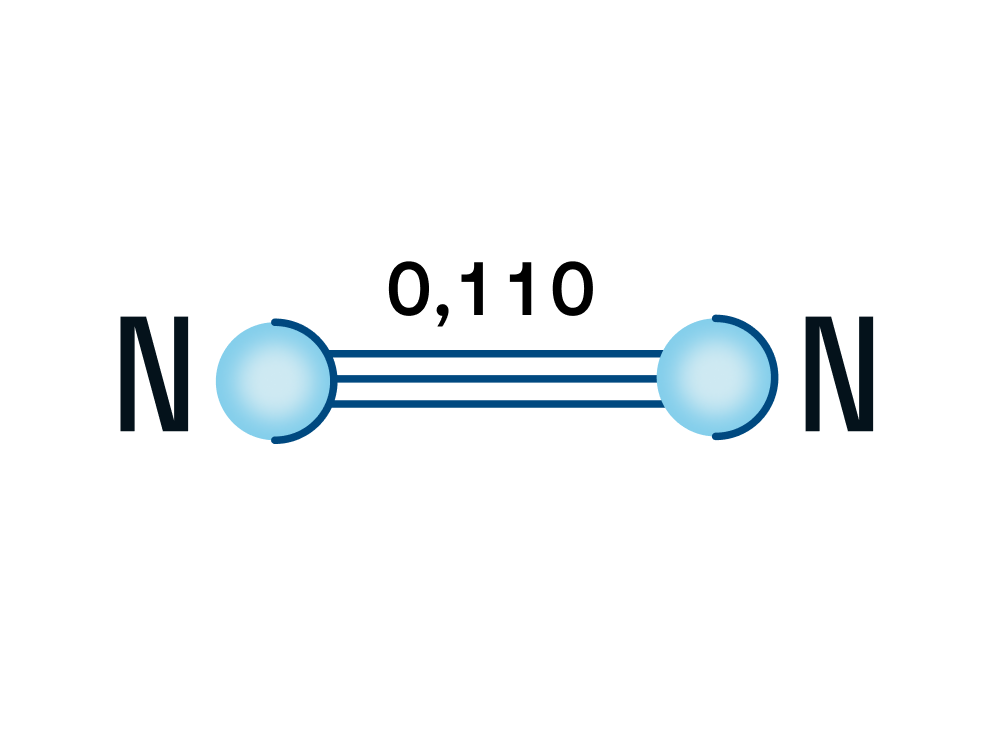
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
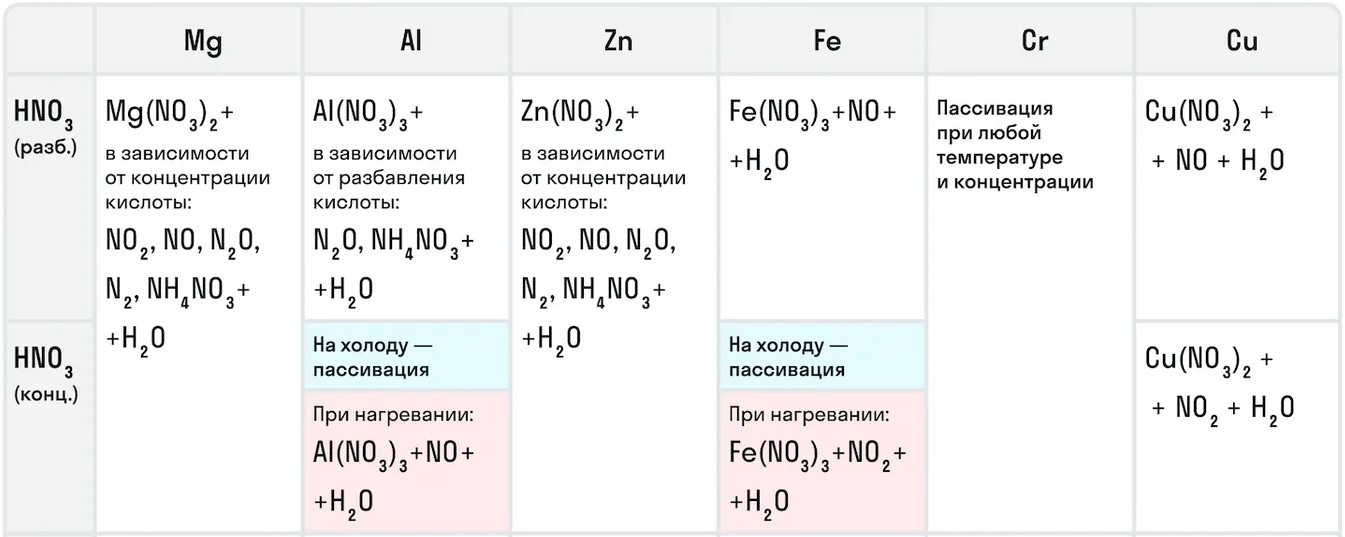
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
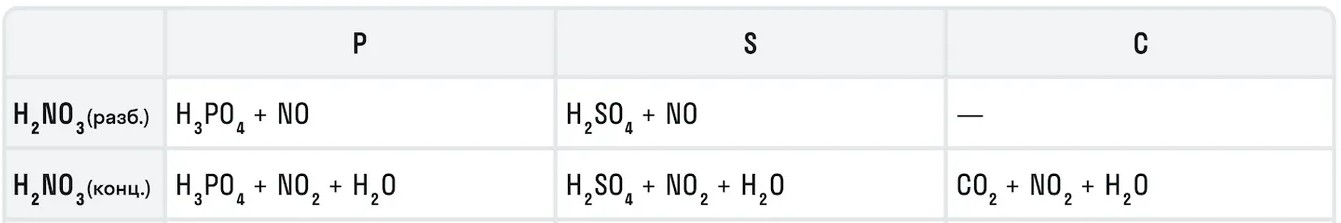
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
http://studarium.ru/article/168
http://skysmart.ru/articles/chemistry/azot