Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
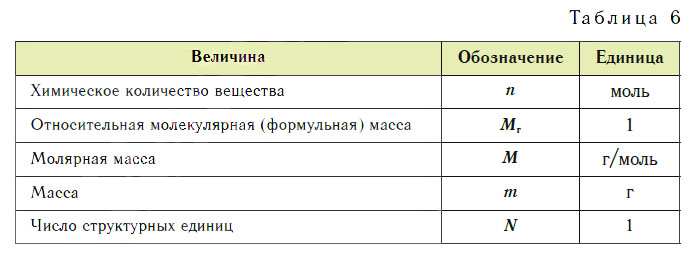
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Химические уравнения и расчеты по ним

Зная состав молекул вступающих в реакцию веществ и веществ, образующихся в результате реакции, мы можем выразить любую реакцию химическим уравнением.
Что такое химические уравнения
Химическое уравнение — это сокращенная запись реакции при помощи химических формул. В таком уравнении слева от знака равенства пишут формулы взятых для реакции веществ, а справа — формулы продуктов реакции. Так как общее число атомов при реакции остается неизменным, то в правильно составленном уравнении число атомов каждого элемента слева и справа от знака равенства должно быть одинаковым.
Чтобы составить уравнение реакции, необходимо точно знать, какие вещества вступают в реакцию и какие образуются в результате реакции. Химическое уравнение является выражением фактов, установленных экспериментальным путем.
Нельзя, написав в левой части уравнения формулы молекул взятых веществ, по своему усмотрению комбинировать из них в правой части уравнения любые новые молекулы.
В тех случаях, когда аналогичные реакции уже хорошо изучены, можно заранее предвидеть, каковы будут продукты взаимодействия взятых веществ.
Известно, например, что при взаимодействии кислоты со щелочью или с окисью металла всегда получаются соль и вода, что при действии кислоты на соль обычно получается новая соль и новая кислота и т. д. Однако и здесь возможны неожиданности.
Так, при действии соляной и разбавленной серной кислот на многие металлы выделяется водород и получаются соли взятых металлов, например:
Но если бы мы на этом основании составили аналогичное уравнение для реакции взаимодействия азотной кислоты с цинком, то сделали бы грубую ошибку, так как при действии азотной кислоты на металлы водород, как правило, не выделяется.
Этот пример показывает, что выводы «по аналогии» не всегда надежны и поэтому их следует, по возможности, избегать.
При составлении уравнений необходимо всегда помнить, что, уравнивая число атомов в левой и правой половинах равенства, мы не имеем права изменять формулы веществ. Уравнивание достигается только правильным подбором коэффициентов.
Иногда вместо полного уравнения реакции дается только схема ее, указывающая, какие вещества вступают в реакцию и какие получаются в результате реакции. В таких случаях мы будем заменять знак равенства стрелкой, направленной в сторону образующихся при реакции веществ. Например, схема реакции горения сероводорода имеет следующий вид:
Для чего нужны химические уравнения
Химические уравнения служат на практике для производства различных расчетов, связанных с той или иной реакцией. Напомним, что каждая формула в химическом уравнении изображает не только одну молекулу, но и определенное весовое количество вещества, отвечающее его молекулярному весу, например одну граммолекулу.
Заменяя формулы граммолекулярными количествами веществ, мы узнаем весовые соотношения между всеми участвующими в реакции веществами. Так, например, уравнение реакции образования воды из водорода и кислорода можно расшифровать следующим образом:
Из уравнения видно, что 4 г водорода, соединяясь с 32 г кислорода, дают 36 г воды.
Таким образом, составив уравнение реакции и определив по нему граммолекулярные количества реагирующих веществ, мы можем делать всевозможные расчеты, необходимые для воспроизведения данной реакции в лаборатории или на производстве.
В тех случаях, когда в реакции участвуют газообразные вещества, уравнение реакций дает представление не только о весовых количествах, но и об относительных объемах реагирующих газов, что видно из следующего примера:
Поэтому, если по условиям задачи требуется узнать объем вступающего в реакцию или образующегося в результате реакции газа, то нет необходимости предварительно вычислять его вес. По уравнению реакции мы можем непосредственно рассчитать требуемый объем.
Пример решения химического уравнения
Сколько литров кислорода можно получить, разлагая 100 г бертолетовой соли?
Составляем уравнение реакции и отмечаем под формулой бертолетовой соли ее удвоенный граммолекулярный вес, а под формулой кислорода его объем в литрах:
Затем, как обычно, составляем пропорцию и находим из нее искомый объем, минуя вычисление веса полученного кислорода и перевод его в литры:
Полученный объем относится, конечно, к 0° и 760 мм давления; если в задаче указана иная температура и иное давление, то необходимо сделать соответствующий пересчет.
Статья на тему Химические уравнения и расчеты по ним
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
http://znaesh-kak.com/x/x/%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B8-%D1%80%D0%B0%D1%81%D1%87%D0%B5%D1%82%D1%8B-%D0%BF%D0%BE-%D0%BD%D0%B8%D0%BC
http://urok.1sept.ru/articles/612236