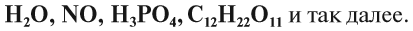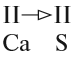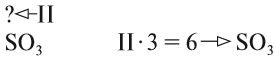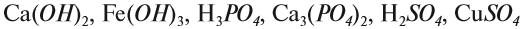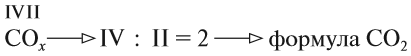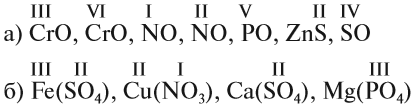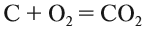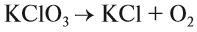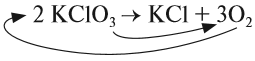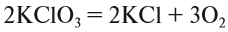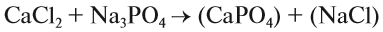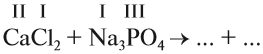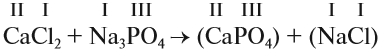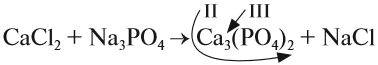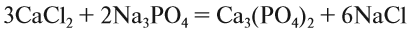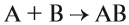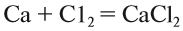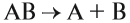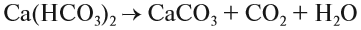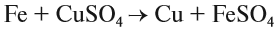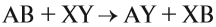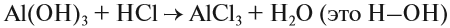Основные понятия и законы химии
Химия – это наука, которая сопутствует нам, где бы мы не находились: дома, в офисе, на природе или в городе. Трудно переоценить ее вклад в нашу жизнь, необходимость понимания и знания основных понятий и законов химии.
Итак, какие же основные понятия и законы включает химия? Сначала дадим определение науке: Химия — наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении.
Основные понятия химии
Основными в химии являются такие понятия, как атом, молекула, элемент, вещество, аллотропия и др.
У истока основных понятий химии стоит атомно-молекулярное учение, которое дает определение молекулы и атома:
Молекула
Это наименьшая частица определенного вещества, которая обладает его химическими свойствами. Состав и химическое строение молекулы определяют ее химические свойства. Все вещества состоят из молекул, а молекулы из атомов.
Атом
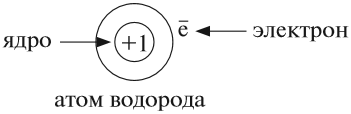
Это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ, это электронейтральная частица, которая состоит из положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра.
Молекулы и атомы находятся в постоянном движении.
Химический элемент
В настоящее время известно 118 элементов, 89 из которых найдены в природе, остальные получены искусственно (см. Интересные факты о химических элементах). Что же такое Химический элемент? Это такой вид атомов, который имеет определенный заряд ядра и строение электронных оболочек.
Теперь рассмотрим строение атомного ядра и следующее основное понятие химии.
Атомное ядро
Атомное ядро состоит из протонов (Z) и нейтронов (N), имеет положительный заряд, равный по величине количеству протонов (или электронов в нейтральном атоме) и совпадает с порядковым номером элемента в периодической таблице. Суммарная масса протонов и нейтронов атомного ядра называется массовым числом A = Z + N. Существуют химические элементы (изотопы), имеющие одинаковый заряд ядер, но при этом различные массовые числами, что достигается за счет разного числа нейтронов в ядре.
Вещество
Некая совокупность атомов и молекул, их ассоциатов и агрегатов, которые могут находиться в любом из трех агрегатных состояний, образуют вещество.
Простые вещества состоят из атомов одного вида, а сложные вещества (химические соединения) состоят из атомов разного вида и образуются при химическом взаимодействии атомов разных химических элементов.
Аллотропия
Встречается явление, при котором один химический элемент может образовывать нескольких простых веществ, различных по свойствам и строению. Это явление называется Аллотропией. Аллотропные модификации характерны, например, для кислорода (O2 и O3), фосфора (белый, красный, черный фосфор), углерода (алмаз, графит), серы (моноклинная, ромбическая, пластическая), олова (белое, серое, ромбическое олово).
Химическая формула
В 1814 г Й. Берцелиус предложил использовать химическую формулу — запись состава веществ с помощью химических знаков и индексов.
Химическое вещество характеризуется атомной массой, а молекулы — молекулярной массой.
Относительная атомная масса (Ar)
Это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1 /12 массы атома 12 C.
Относительная молекулярная масса (Mr)
Это величина, показывающая, во сколько раз масса молекулы данного вещества больше 1 /12 массы атома углерода 12 C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.
Моль вещества (n)
Это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12 C.
Число структурных единиц, содержащихся в 1 моле вещества равно 6,02 • 10 23 .Эточисло называется числом Авогадро (NA)
Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
Химический эквивалент
Для более удобного сравнения способности различных элементов к соединению введено понятие химического эквивалента. Это одно из важнейших понятий химии, дадим ему определение:
Химическим эквивалентом вещества (Э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Масса 1 эквивалента вещества называется эквивалентной массой (mэкв). Масса одного моля эквивалента элемента — это молярная масса эквивалента MЭ(X).
Молярную массу эквивалента химического элемента, простых и сложных веществ (Mэкв(X)) рассчитывают по формуле:
где M(X) – молярная масса; вал – суммарная валентность.
Например, молярная масса эквивалента алюминия составляет Mэкв(Са) = 40/2 = 20 г/моль.
Молярные массы эквивалента кислорода и водорода постоянны и составляют:
Эквивалентную массу соединения можно определить по его химической формуле, например,
М экв(оксида) = М(оксида)/(число атомов кислорода ∙ 2);
М экв(основания) = М(основания)/число гидроксильных групп;
М экв(кислоты) = М(кислоты)/число протонов;
М экв(соли) = М(соли)/(число атомов металла ∙ валентность металла).
Пример, определим эквивалент (Э) и эквивалентную массу Мэкв (Х) фосфора, серы и брома в соединениях PHз, Н2S и HBr.
В PHз 1 моль атомов водорода соединяется с 1/3 моль фосфора, поэтому эквивалент фосфора равен Э(N) = 1/3 моль
В Н2S 1 моль атомов водорода соединяется с 1/2 моль серы, поэтому эквивалент серы равен Э(S) = 1/2 моль
В HBr 1 моль атомов водорода соединяется с 1 моль брома, поэтому эквивалент брома равен Э(Br) = 1 моль.
Найдем эквивалентные массы:
Мэкв (Р) = 31/3 = 10,33 г/моль;
Мэкв (S) = 32/2 = 16 г/моль;
Мэкв (Br) = 80/1 = 80 г/моль.
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который рассмотрен немного ниже.
Основные законы химии
Нижеперечисленные законы принято считать основными законами химии.
Закон эквивалентов
По закону эквивалентов химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
где m1 и m2 — массы реагирующих или образующихся веществ, М экв1 и М экв2 — эквивалентные массы этих веществ.
Примеры расчета молярной массы эквивалента представлен в задачах 5-7 раздела Задачи к разделу Основные понятия и законы химии
Закон сохранения вещества
В 1756 г. М.В. Ломоносов, после длительных испытаний, пришел к важному открытию: вес всех веществ, вступающих в химическую реакцию, равен весу всех продуктов реакции.
Этот закон отражается в законе сохранения массы, который заключается в следующем: масса веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Вещества не исчезают и не возникают из ничего, а происходит химическое превращение. Закон является основой при составлении химических реакций и количественных расчетов в химии.
Закон постоянства состава
В 1808 Ж. Пруст сформулировал закон, который гласит, что независимо от способа получения все индивидуальные вещества имеют постоянный количественный и качественный состав.
Закон кратных отношений
В 1803 г Д. Дальтон открыл закон, заключающийся в том, что если два химических элемента образуют несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
Закон объемных отношений
В 1808 г Гей-Люссак сформулировал закон, который гласил:
«Объемы газов, вступающих в химические реакции, и объемы газов, являющихся продуктами реакции, соотносятся между собой как небольшие целые числа».
Газовые законы
Важную роль в развитии химической науки сыграли газовые законы (справедливы только для газов).
В 1811 г. Авогадро ди Кваренья (Закон Авогадро) доказал, что- в равных объемах любых газов при постоянных условиях (температуре и давлении) содержится одинаковое число молекул. В одинаковых условиях одно и то же число молекул занимают равные объемы, а 1 моль любого при T=273°К и p=101,3 кПа газа занимает объем 22,4 л, который называется молярным объемом газа (Vm).
Независимо друг от друг трое ученых вывели следующие законы:
закон Бойля-Мариотта при Т= const: P1V1 = P2V2;
закон Шарля при V = const:P1 / T1 = P2 / T2
При объединении этих трех законов получаем:
Если условия отличаются от нормальных, то применяют уравнение Клапейрона – Менделеева:
pV = nRT = (m/M)RT, где
p — давление газа, V — его объем, n — количество молей газа, R — универсальная газовая постоянная (8,314 Дж/(моль*К).
Количество газа при нормальных условиях рассчитывают по формуле:
Плотность газов при заданных давлении и температуре прямо пропорциональна их молярной массе:
ρ = m/V = pM/(RT) = (p/RT)M.
Относительная плотность газов показывает, во сколько раз один газ тяжелее другого. Плотность газа В по газу А определяется следующим образом:
Это основные законы химии. В заключение приведем Закон парциальных давлений (закон Дальтона). Парциальное давление в смеси равно тому давлению газа, которым он обладал бы, если бы занимал такой же объем, какой занимает вся смесь при той же температуре. При условии, что в газовой смеси нет химического взаимодействия, общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь:
Состав газовых смесей может выражаться количеством вещества (n), массовыми (ωn), объемными (φn) и молярными (χ) долями:
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
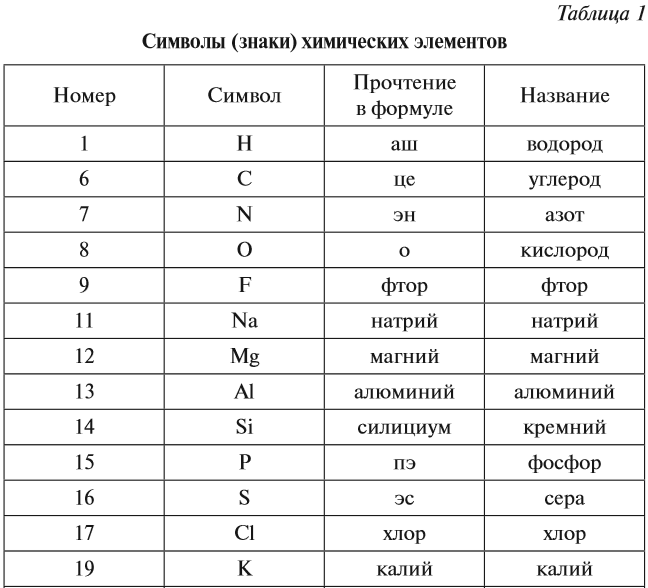
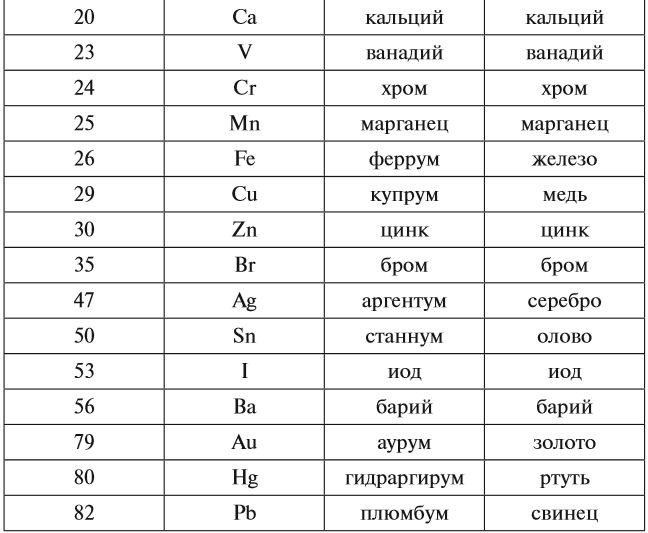
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
- Н — атом водорода;
- О — атом кислорода.
Число атомов в молекуле обозначают при помощи индекса:
- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
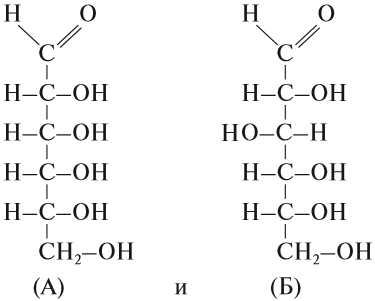
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
- Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
- Графит — атомы углерода находятся в одной плоскости;
- Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
- Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
- Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
- В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
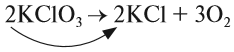
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
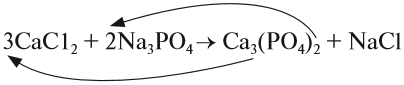
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Лекция на тему : » Основные химические понятия и законы. Расчёты по химическим формулам и уравнениям.»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Занятие №1. Основные химические понятия и законы. Расчёты по химическим формулам и уравнениям.
Место и значение химии в системе наук.
Современная химия представляет собой систему научных дисциплин: общей,
неорганической, аналитической, органической физической, коллоидной химии,…Основой химической науки являются атомно-молекулярное учение, закон сохранения материи, периодический закон, теория химической связи и учение о химическом процессе.
Как всякая наука, химия изучает некоторую часть явлений окружающего мира. Химия играет значительную роль в научно-техническом прогрессе. Нет ни одной отрасли не связанной в той или иной мере с применением химии.
Основные понятия и законы химии
Химия – наука о свойствах вещества и его превращениях, она включает в себя законы и принципы, описывающие эти превращения, а так же представления и теории, позволяющие дать им объяснение.
Атомно-молекулярное учение заключается в следующем:
1. Все вещества состоят из молекул.
2. Молекулы состоят из атомов.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Рассмотрим следующие определения:
Вещество – вид материи, которая обладает массой покоя.
Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Такие вещества принято подразделять на простые и сложные (хим. соединения). Простые вещества образованы
атомами одного хим. элемента и потому являются формой его существования в свободном состоянии, напр. Сера, железо, озон, алмаз. Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды ) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды ).
Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства.
Различным элементам соответствуют различные атомы, обозначаемые символом данного элемента (Ag, Fe, Mg).
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
В настоящее время известно 118 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов
вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая
подчиняется законам, характерным для микросистем.
Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд.
Положительные ионы называют катионами (от греч. kation , буквально – идущий вниз), отрицательные – анионами (от греч. anion , буквально идущий вверх). В свободном состоянии существуют в газовой фазе (в плазме).
Валентность (от лат. valentia – сила), способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Реакции химические (от лат. re- – приставка, означающая обратное действие, и actio –действие), превращения одних веществ (исходных соединений) в другие (продукты реакции) при неизменяемости ядер атомов.
Исходные вещества иногда называют реагентами, однако чаще (особенно в органической химии) термин «реагент» используют по отношению к одному, наиболее активному исходному соединению, определяющему направление химической реакции.
Химическая формула — это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс — цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле).
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества — молекулы, состоят из атомов одного и того же элемента.
Cложные вещества — молекулы, состоят из атомов различных химических элементов.
Аллотропия — явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Международная единица атомных масс равна 1/12 массы изотопа 12C — основного изотопа природного углерода.
1 а.е.м = 1/12 • m (12C) = 1,66057 • 10-27 кг
Относительная атомная масса (Ar) — безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м. Ar(Mg) = 24,312
m(Mg) = 24,312 • 1,66057 • 10-24 = 4,037 • 10-23 г
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = mг / (1/12 mа(12C))
mr — масса молекулы данного вещества;
mа(12C) — масса атома углерода 12C.
Mг = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных
атомных масс всех элементов с учетом индексов.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения — моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов).
Обозначается n, измеряется в моль. Моль — количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность — моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества и численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая — безразмерная.
M = NA • m(1 молекула) = NA • Mг • 1 а.е.м. = (NA • 1 а.е.м.) • Mг = Mг
Это означает, что если масса некоторой молекулы равна, например, 80 а.е.м. (SO3), то масса одного моля молекул равна 80 г. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Все утверждения относительно молекул остаются справедливыми для молей (при замене, в случае необходимости, а.е.м. на г)
Например, уравнение реакции: 2Na + Cl2 ® 2NaCl, означает, что два атома натрия реагируют с одной молекулой хлора или, что одно и то же, два моль натрия реагируют с одним молем хлора.
Закон сохранения массы веществ (М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.) Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов
реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и
по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава впервые сформулировал Ж.Пруст (1808 г)
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
CuS — сульфид меди . m(Cu) : m(S) = Ar(Cu) : Ar(S) = 64 : 32 = 2 : 1
Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в массовых
отношениях 2 : 1.
Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке.
Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию. Вещества немолекулярного строения не обладают строго постоянным составом.
Их состав зависит от условий получения.
Закон Авогадро ди Кваренья (1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразных веществ.)
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Проверьте себя, я задам эти вопросы устно (ответы в скобках – выучить!) Каждый правильный ответ оценивается в 1 балл.
(Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства)
Что такое молекула?
( Молекула — наименьшая частица вещества, обладающая его химическими свойствам).
Что такое атомная масса?
( Относительная атомная масса (Ar) — безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C)
Что такое относительная молекулярная масса? Как ее найти?
( Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Чтобы ее посчитать, необходимо сложить атомные массы с учетом их стехиометрических коэффициентов)
Что такое молярная масса вещества? В каких единицах она выражается? (Молярная масса показывает массу одного моля вещества. Выражается в граммах на моль – г/моль.
Как вычислить количество вещества, зная массу, объём или число структурных единиц?
Как формулируется закон Авогадро?
(В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул)
Что называется относительной плотностью одного газа по другому? (Отношение масс двух газов, занимающих равные объёмы при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D
Сформулируйте закон постоянства состава.
(Состав соединений молекулярной структуры является постоянным независимо от способа получения. Состав соединений с немолекулярной структурой (атомной, ионной и металлической кристаллической решеткой) не является постоянным и зависит от способа получения).
Сформулируйте закон сохранения массы веществ.
(Масса веществ, вступивших в реакцию, равна массе образующихся продуктов)
http://himi4ka.ru/samouchitel-po-himii/urok-1-osnovnye-ponjatija-i-zakony-predmeta-himija.html
http://infourok.ru/lekciya-na-temu-osnovnie-himicheskie-ponyatiya-i-zakoni-raschyoti-po-himicheskim-formulam-i-uravneniyam-1714140.html