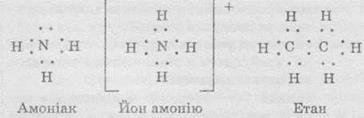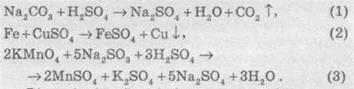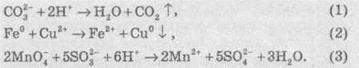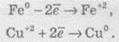Химические знаки формулы химические уравнения
К химической символики относят символы химических элементов, химические формулы и уравнения.
Символы химических элементов состоят из одной или двух букв латинского алфавита с числа тех, которые входят в состав латинского названия элемента. Большинство названий и, соответственно, символов химических элементов сложились исторически и присваивались первооткрывателями этих элементов. В последнее время в Периодической системе можно встретить такие символы, как Unn . Подобные символы присваивают недавно открытым элементам, для которых еще не утверждено название международным обществом фундаментальной и прикладной химии ( IUPAC ). Для таких элементов в названии и символе зашифровывают порядковый номер элемента на основании латинского названия цифр. Например, элемент с порядковым номером 110 будет иметь название унуннілій (ун — 1, нил — 0) и символ Uun , а элемент с порядковым номером 118 — название унуноктий (ун — 1, окта — 8) и символ Uuo .
Химическими символами обозначают: химический элемент; простое вещество с атомной или металлической кристаллической решеткой ( Al , Fe , С, Si ); один атом химического элемента.
Химические формулы — это обозначение состава вещества с помощью знаков химических символов и индексов.
Индекс — это цифра, которую располагают справа внизу от символа химического элемента, он указывает на число атомов этого элемента в молекуле вещества.
Различают несколько видов химических формул (по рекомендациям IUPAC ): эмпирические, молекулярные, электронные, структурные и дисплейные.
Молекулярные формулы отражают качественный (из атомов каких элементов состоит вещество) и количественный состав молекулы вещества. Например, запись СО2 означает, что:
— в состав углекислого газа входят атомы элементов Углерода и Кислорода;
— одна молекула углекислого газа состоит из одного атома Углерода и двух атомов Кислорода.
Молекулярные формулы можно применять только для веществ молекулярного строения. У веществ ионной или атомной строения нельзя выделить отдельные молекулы, поэтому для них применяют эмпирические формулы.
Эмпирические формулы отражают качественный состав вещества и количественное соотношение между атомами элементов в веществе (стехиометрическое соотношение).
Эмпирические формулы применяют для веществ ионной или атомной строения, а также для отображения результатов элементного анализа вещества.
Например, натрий хлорид имеет ионное строение. Кристалл (надмолекула) натрий хлорида состоит из большого количества положительно заряженных ионов Натрия и отрицательно заряженных ионов Хлора. Причем в кристаллической решетке каждый ион Натрия окружен шестью ионами Хлора, а каждый ион Хлора окружен шестью ионами Натрия, поэтому отдельную частицу, которую можно назвать молекулой натрий хлорида, выделить невозможно. Однако в целом в кристалле соотношение между ионами Натрия и Хлора равно 1:1. Следовательно, надмолекулу натрий хлорида необходимо записать так: < Na + Cl - > m . Но вместо этого удобнее пользоваться эмпирической формулой NaCl .
Эмпирические формулы используют также для отражения элементного анализа. Например, если по результатам анализа вещество состоит из атомов Углерода и Водорода с соотношением 1:1, то для этого вещества можно записать эмпирическую формулу СН. Однако без дополнительных данных сказать, что это за вещество, невозможно, ведь такая эмпирическая формула справедлива для ацетилена (молекулярная формула С2Н 2 ), бензену (молекулярная формула С6Н6), циклодекапентаену (С10Н10) и т.д. Или же эмпирическая формула СН2 характерна для всех этиленовых углеводородов (например, этилен С2Н4 или бутен С4Н8), а также и для всех циклоалканів (например, циклопропан С3Н6 или циклогексан С6Н12).
Электронные формулы схематично отражают механизм образования химических связей в молекулах. их записывают с помощью символов химических элементов и точек, которые обозначают электроны внешнего электронного уровня. Например:
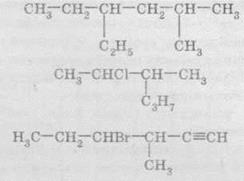
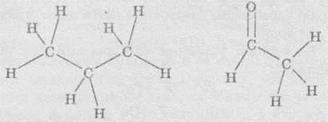
Структурные формулы отражают порядок соединения атомов или групп атомов в молекулах. Чаще всего структурные формулы используют для изображения молекул органических веществ. Например:
В структурных формулах черточкой обозначают химическую связь, то есть одна общая электронная пара. Структурные формулы используют только для отображения соединения атомов, но не пространственного строения. Структурные формулы невозможно использовать для изображения ионных соединений, поскольку в них отсутствуют общие электронные пары. Структурными формулами пользуются для изображения молекул или групп атомов, в которых атомы связаны ковалентними связями.
Дисплейные формулы напоминают структурные формулы, однако в дисплейных формулах все связи обозначают черточкой. Кроме того, часто в дисплейных формулах отражают валентные углы между связями, поэтому с их помощью можно отображать пространственную строение молекул.
Химические уравнение — это условное изображение химической реакции с помощью химических символов, формул и коэффициентов.
Например, 2 Na O H + H 2 S → Na 2 S + 2 H 2 О.
Коэффициенты обозначают большой цифрой слева от формулы вещества. Коэффициент принадлежит формуле только того вещества, рядом с которой он стоит. Коэффициент показывает число отдельных атомов или молекул (или число молей вещества атомов или молекул), которые участвуют в химической реакции.
При записи уравнений химических реакций используют также следующие обозначения:
• символы → или = разделяют исходные вещества и продукты реакции;
• символ 
• символ ↑ — вещество выделяется в виде газа с конденсированной системы (смеси твердых или жидких веществ);
• символ ↓ — вещество выпадает в осадок из раствора или смеси газов.
Иногда еще указывают агрегатное состояние исходных веществ и продуктов реакции или концентрацию раствора какой-либо исходного вещества: «тв» — твердое вещество, «г» — жидкость, «г» — газ, «конц» — концентрированный раствор, «решения» — разведенный раствор.
Уравнение химических реакций разделяют на:
молекулярные (для всех веществ записаны молекулярные или эмпирические формулы),
ионные (записывают только ионы, которые участвуют в реакции),
электронные и электронно-ионные уравнения напівреакцій (описывают процесс окисления или восстановления),
термохимические (в молекулярных уравнениях указывают тепловой эффект реакции).
Молекулярные уравнение реакции:
Соответствующие им ионные уравнения реакций:
В ионных и электронно-ионных уравнениях реакций указывают заряды ионов в растворах. При записи заряда ионов сначала записывают величину заряда (арабской цифрой), а потом знак заряда: 2-, 3+ и т.д.
Электронные уравнение напівреакцій для уравнения (2):
В электронных уравнениях реакции указывают степень окисления атомов элементов. При записи степени окисления сначала указывают знак, а затем значение степени окисления: -2, +5 и т.д.
Электронно-ионные уравнение напівреакцій для уравнения (3):
Также часто используют термохимические уравнения реакций. Это обычные уравнения, в которых указывают еще и тепловой эффект реакции, т.е. количество теплоты, которое поглощается или выделяется в результате реакции. Примеры термохимических уравнений реакций:
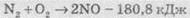
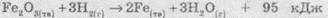
Уравнение химических реакций отражают количественные (мольные) соотношение веществ, вступают в реакцию и образуются в результате реакции. Поэтому иногда такие уравнения и коэффициенты в них называют стехиометрическими уравнениями и коэффициентами.
ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для
ЛЕК. 01 Химич.знаки,формулы, уравнения.ppt
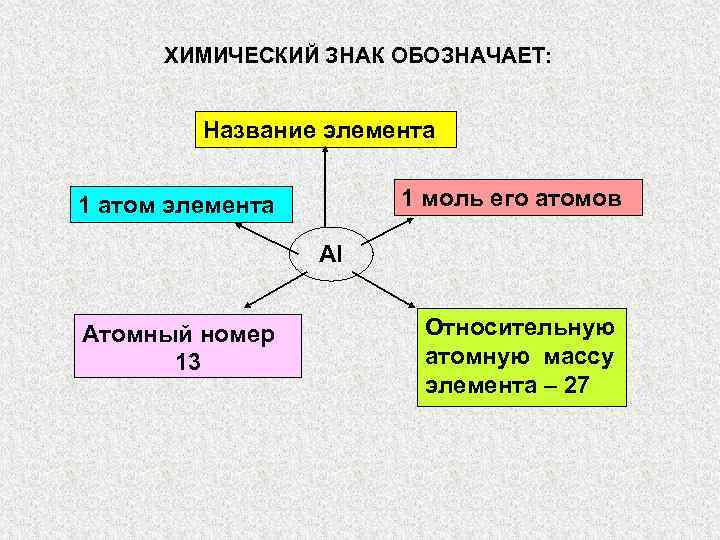
ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для обозначения элементов используют химические знаки, которые» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-1.jpg» alt=»> ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для обозначения элементов используют химические знаки, которые» /> ХИМИЧЕСКИЕ ЗНАКИ, ФОРМУЛЫ И УРАВНЕНИЯ Для обозначения элементов используют химические знаки, которые состоят из первой или первой и одной из последующих букв латинских названий элементов: алюминий – Aluminium …. Al железо – Ferrum …………. . Fe водород – Hydrogenium …. H кислород – Oxygenium ……O и т. д. ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКИЙ ЗНАК?
ХИМИЧЕСКИЙ ЗНАК ОБОЗНАЧАЕТ: Название элемента 1 атом элемента 1″ src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-2.jpg» alt=»> ХИМИЧЕСКИЙ ЗНАК ОБОЗНАЧАЕТ: Название элемента 1 атом элемента 1″ /> ХИМИЧЕСКИЙ ЗНАК ОБОЗНАЧАЕТ: Название элемента 1 атом элемента 1 моль его атомов Al Атомный номер Относительную 13 атомную массу элемента – 27
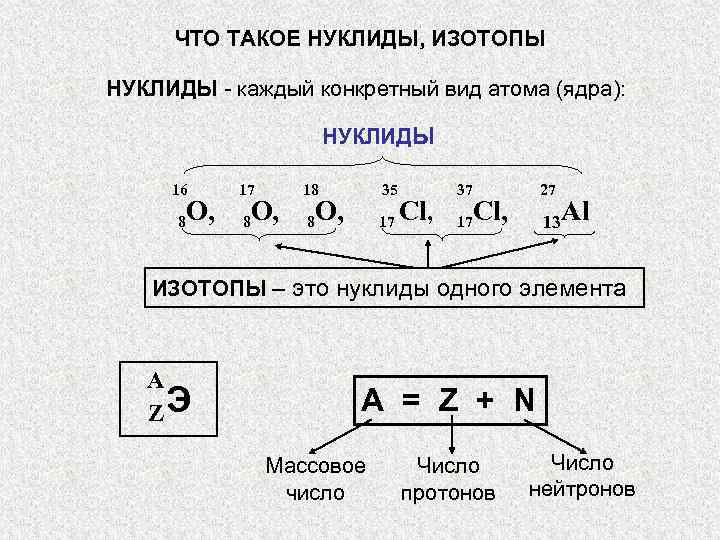
ЧТО ТАКОЕ НУКЛИДЫ, ИЗОТОПЫ НУКЛИДЫ — каждый конкретный вид атома (ядра): » src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-3.jpg» alt=»> ЧТО ТАКОЕ НУКЛИДЫ, ИЗОТОПЫ НУКЛИДЫ — каждый конкретный вид атома (ядра): » /> ЧТО ТАКОЕ НУКЛИДЫ, ИЗОТОПЫ НУКЛИДЫ — каждый конкретный вид атома (ядра): НУКЛИДЫ 16 17 18 35 37 27 O, 8 8 O, O, 8 17 Cl, 17 13 Al ИЗОТОПЫ – это нуклиды одного элемента A ZЭ A = Z + N Массовое Число число протонов нейтронов
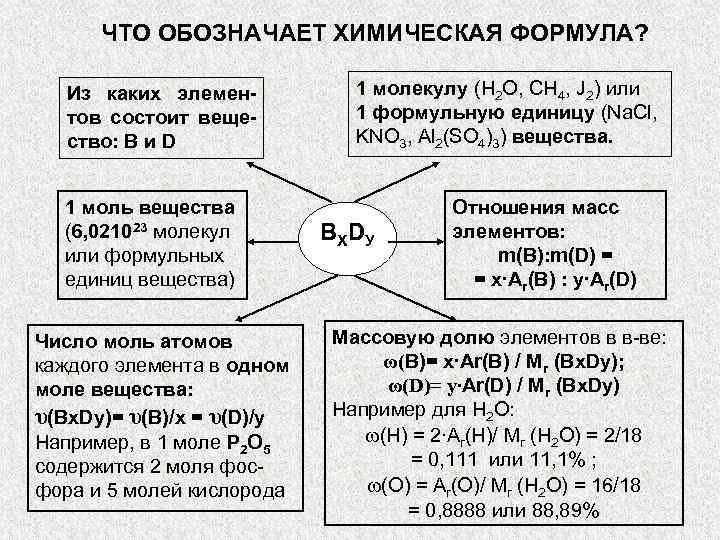
ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКАЯ ФОРМУЛА? Из каких элемен- 1 молекулу (Н 2 О,» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-4.jpg» alt=»> ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКАЯ ФОРМУЛА? Из каких элемен- 1 молекулу (Н 2 О,» /> ЧТО ОБОЗНАЧАЕТ ХИМИЧЕСКАЯ ФОРМУЛА? Из каких элемен- 1 молекулу (Н 2 О, СН 4, J 2) или тов состоит веще- 1 формульную единицу (Na. Cl, ство: В и D KNO 3, Al 2(SO 4)3) вещества. 1 моль вещества Отношения масс (6, 021023 молекул ВХ DУ элементов: или формульных m(B): m(D) = единиц вещества) = х∙Аr(B) : y∙Аr(D) Число моль атомов Массовую долю элементов в в-ве: каждого элемента в одном ω(В)= х∙Аr(B) / Mr (Bx. Dy); моле вещества: ω(D)= y∙Аr(D) / Mr (Bx. Dy) υ(Bx. Dy)= υ(B)/x = υ(D)/y Например для Н 2 О: Например, в 1 моле Р 2 О 5 ω(Н) = 2∙Аr(Н)/ Mr (Н 2 О) = 2/18 содержится 2 моля фос- = 0, 111 или 11, 1% ; фора и 5 молей кислорода ω(О) = Аr(О)/ Mr (Н 2 О) = 16/18 = 0, 8888 или 88, 89%
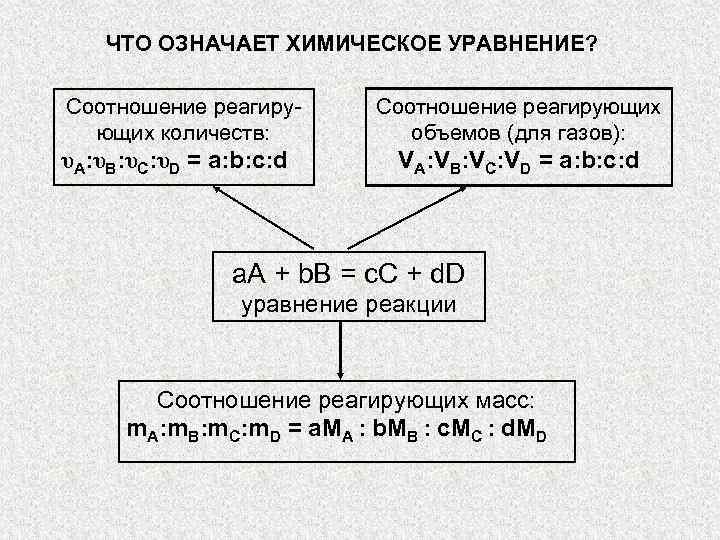
ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ? Соотношение реагиру- Соотношение реагирующих количеств: » src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-5.jpg» alt=»> ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ? Соотношение реагиру- Соотношение реагирующих количеств: » /> ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ? Соотношение реагиру- Соотношение реагирующих количеств: объемов (для газов): υA: υB: υC: υD = a: b: c: d VA: VB: VC: VD = a: b: c: d a. А + b. B = c. C + d. D уравнение реакции Соотношение реагирующих масс: m. A: m. B: m. C: m. D = a. MA : b. MB : c. MC : d. MD
ПРИМЕР РАССЧЕТА ПО ХИМИЧЕСКОМУ УРАВНЕНИЮ Задача. Какая масса Ba. Cl 2 израсходуется при» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-6.jpg» alt=»> ПРИМЕР РАССЧЕТА ПО ХИМИЧЕСКОМУ УРАВНЕНИЮ Задача. Какая масса Ba. Cl 2 израсходуется при» /> ПРИМЕР РАССЧЕТА ПО ХИМИЧЕСКОМУ УРАВНЕНИЮ Задача. Какая масса Ba. Cl 2 израсходуется при реакции с 10 г Fe 2(SO 4)3 ? Решение: Согласно уравнению реакции: Fe 2(SO 4)3 + 3 Ba. Cl 2 = 3 Ba. SO 4↓ + 2 Fe. Cl 3 1 моль 3 моля 2 моля отношение реагирующих масс: m(Fe 2(SO 4)3) : m(Ba. Cl 2) = 1 M(Fe 2(SO 4)3) : 3 M(Ba. Cl 2) отсюда находим массу хлорида бария: 3∙ 208, 24∙ 10 3 M(Ba. Cl 2) x m(Fe 2(SO 4)3) m(Ba. Cl 2) = = 15, 62 г 1 M(Fe 2(SO 4)3) 399, 88
ГАЗОВЫЕ ЗАКОНЫ Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-7.jpg» alt=»> ГАЗОВЫЕ ЗАКОНЫ Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р» /> ГАЗОВЫЕ ЗАКОНЫ Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р – давлением; Т , или t – температурой; V – объемом; m – массой всего газа; М – молярной массой. Взаимосвязь между этими величинами устанавливают газовые законы. При этом обычно используют модель идеального газа , которая основана на следующих допущениях: 1) между частицами газа отсутствуют силы взаимодействия; 2) сами частицы представляют собой материальные точки.
1. ЗАКОН БОЙЛЯ-МАРИОТТА При Т = const (изотермический процесс): PV = const или P» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-8.jpg» alt=»>1. ЗАКОН БОЙЛЯ-МАРИОТТА При Т = const (изотермический процесс): PV = const или P» /> 1. ЗАКОН БОЙЛЯ-МАРИОТТА При Т = const (изотермический процесс): PV = const или P 1 V 1 = P 2 V 2 2. ЗАКОН ГЕЙ-ЛЮССАКА При Р = const (изобарический процесс): V/Т = const или V 1/Т 1 = V 2/Т 2 3. ЗАКОН ШАРЛЯ При V = const (изохорический процесс) Р/Т = const или Р 1/Т 1 = Р 2/Т 2
4. УРАВНЕНИЕ КЛАПЕЙРОНА Объединенный газовый закон P 1 V 1 P» src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-9.jpg» alt=»> 4. УРАВНЕНИЕ КЛАПЕЙРОНА Объединенный газовый закон P 1 V 1 P» /> 4. УРАВНЕНИЕ КЛАПЕЙРОНА Объединенный газовый закон P 1 V 1 P 2 V 2 PV = или = const Т 1 Т 2 Т 5. УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА PV = n. RT, где n = m/M или PV = m. RT/М , где R = 8, 31 Дж/(моль∙К) = 0, 82 л∙атм/(моль∙К) P – давление, Па; Т – температура, К
УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА (следствия) Из уравнения Клапейрона-Менделеева следуют два » src=»https://present5.com/presentation/3/-101361182_420222222.pdf-img/-101361182_420222222.pdf-10.jpg» alt=»> УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА (следствия) Из уравнения Клапейрона-Менделеева следуют два » /> УРАВНЕНИЕ КЛАПЕЙРОНА- МЕНДЕЛЕЕВА (следствия) Из уравнения Клапейрона-Менделеева следуют два важных результата: Следствие 1. V = n. RT/Р = n∙(RT/Р) Отсюда, при Р = const и Т = const V 1 / n 1 = V 1 / n 1 или V
n Следовательно, объём газа прямо пропорционален числу молей (и числу молекул), причем коэффициент пропорциональности ( RT /Р) одинаков для всех газов и зависит только от давления и температуры. Это есть не что иное, как закон Авогадро.
Формулы веществ и уравнения химических реакций
Содержание:
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную информацию о химической реакции.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Формулы веществ и уравнения химических реакций
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Расчёты по химическим формулам
По химическим формулам веществ можно производить различные расчеты:
1. Определение численного соотношения атомов.
Для молекулы SO3 численное соотношение атомов составляет 1 : 3, а для

2. Определение относительной молекулярной массы вещества.
3. Расчет массы одной молекулы вещества.
Для молекулы
4. Определение массовых отношений химических элементов в сложном
веществе.
Для молекулы 
5. Расчет массы элемента по известной массе вещества и обратная задача.
а) Сколько граммов меди содержится в 320 г оксида меди (II)?

б) В какой массе карбоната кальция 
6. Расчет массовой доли химического элемента в сложном веществе.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля 


n – число атомов элемента (Э) в молекуле вещества;

Массовые доли обычно выражаются в процентах:
Пример: Рассчитать массовые доли водорода и кислорода в воде

Если вещество состоит из трех элементов, для определения массовой доли третьего элемента можно определить массовые доли двух элементов, затем их сумму отнять от 100%.
6. Составление формул по соотношению масс и массовых долей элементов в молекуле.
а) Выведите формулу вещества, если соотношение масс элементов
m (S) : m (O) = 2 : 3.


x (S) = 2 : 32 = 0,0625
y (О) = 3 : 16 = 0,1875


Поскольку в молекулах не может быть дробных чисел атомов, то делением на наименьшее значение или умножением на какое-то число превращаем дробные числа в целое число:


б) Составьте формулу вещества, если массовые доли элементов в соединении таковы:





Массовая доля элементов в веществе, массовые соотношения атомов, соотношения чисел атомов.
Составление уравнений химических реакций
Химические формулы, индексы, химические реакции
Используя различные слова, мы составляем предложения. Используя формулы веществ, составляем уравнения реакций. Химическое уравнение –условная запись химической реакции с помощью химических формул и знаков. По уравнениям реакций можно определить, в каких количественных отношениях реагируют вещества и сколько продуктов при этом образуется. Вещества, вступающие в реакцию, называются реагентами. Образующиеся при этом вещества называются продуктами.
Алгоритм составления уравнений реакций
1. Записываем схему уравнения реакции: формулы вступающих в реакцию веществ – слева, а образовавшихся – справа.
2. Уравнения реакций отличаются от схем этих же реакций. Например, горение железа в кислороде записывается в виде схемы:
3. В уравнениях реакций число атомов реагирующих веществ должно быть равно числу атомов продуктов реакций. Поэтому в схемах реакций перед формулами веществ ставятся коэффициенты. Подбираем коэффициенты, чтобы число атомов каждого элемента в левой и правой частях равенства было одинаковым. Коэффициент 1 не ставится. Вначале уравниваем число атомов кислорода. Для этого находим наименьшее кратное число для атомов кислорода до и после реакции: 2 · 3 = 6. Делением этого числа на число атомов кислорода находим коэффициенты в левой части – 6 : 2 = 3; затем в правой части – 6 : 3 = 2.
4. Теперь уравниваем число атомов железа и, наконец, заменяем стрелку на знак равенства:
Коэффициенты перед формулами веществ в химических уравнениях называются стехиометрическими коэффициентами.
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой части. Уравнение читается так: 4 атома железа плюс 3 молекулы кислорода равны 2 молекулам оксида железа (III).
При записи химического уравнения подбираются только коэффициенты, а индексы в формулах менять нельзя, так как нельзя произвольно менять состав вещества.
По уравнениям реакций можно получить следующие сведения:
1) качественный состав реагирующих и образовавшихся веществ 
2) соотношения коэффициентов перед формулами: 
3) соотношения масс веществ:
Уравнения реакции, реагенты, продукты, коэффициенты.
Закон сохранения массы веществ
При химических реакциях происходит распад молекул реагирующих
веществ, осуществляется перегруппировка атомов и групп атомов, образуются молекулы продуктов реакции. В результате реакций число атомов не изменяется, поэтому не должны изменяться и массы этих атомов.
Рассмотрим реакцию горения магния:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
В этом и состоит закон сохранения массы. Закон был открыт опытным путем в 1748 г. русским ученым М. В. Ломоносовым. Позднее, в 1789 г., французский ученый А. Лавуазье пришел к такому же выводу независимо от М. В. Ломоносова. Закон сохранения массы веществ имеет огромное значение для естественных наук.
Значение закона сохранения массы веществ
- 1. Открытие закона способствовало дальнейшему развитию химии.
- 2. Все расчетные задачи в химии решаются на его основе. Все химические уравнения составляются на основании этого закона.
- 3. Этот закон является одним из проявлений общего закона природы: вещество не исчезает бесследно и не образуется из ничего.
Закон сохранения массы веществ.
Демонстрация №1
Опыт, доказывающий закон сохранения массы веществ
Цель: Знать закон сохранения массы веществ и доказать это опытным путём.
Проведите реакцию карбоната кальция с соляной кислотой. Для этого предварительно взвесьте колбу с кислотой, а также шарик на весах (рис. 9). Насыпьте 1 г карбоната
кальция в шарик. Затем наденьте его на колбу. Закрепите скотчем. Поднимите надувной шарик, чтобы весь карбонат высыпался в колбу. После проведения реакции взвесьте.
Сделайте выводы.
Соотношение масс реагирующих веществ. Закон постоянства состава
Состав вещества можно выразить числом атомов или массовым отношением атомов в молекуле. Например, для молекулы 
= 1 : 2, а массовые отношения элементов m (C) : m (O) = 12 : 32 = 3 : 8. Или можно взять отношения массовых долей элементов:
Углекислый газ выделяется при горении топлива, при разложении некоторых сложных веществ или в результате дыхания.
Как вы видите, в молекуле 

Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
В настоящее время известны вещества с переменным составом, с ними вы познакомитесь позднее.
В формулах веществ молекулярного строения индекс указывает на количество химического элемента в молекуле вещества.
На основе закона постоянства состава вещества можно производить различные расчеты. Рассмотрим следующий пример:
При взаимодействии меди с серой образуется 1 моль сульфида меди (II):
m (Cu) : m (S) = 64 : 32 = 2 : 1
Значит, из 2 г Cu и 1 г S образуется сульфид меди (ІІ).
Проведем два опыта.
1. Возьмем смесь, состоящую из 5 г меди и 2 г серы. После нагревания получим смесь сульфида меди с медью, так как 1 г меди находится в избытке. В смеси содержится 6 г CuS и 1 г Сu.
2. Теперь возьмем по 4 г меди и серы. В этом случае после нагревания образуется смесь сульфида меди и серы, так как 2 г серы остаются неизрасходованными и образуется 6 г сульфида меди.
Проверим результаты опытов математическим путем.
Для первого опыта:


m(Cu) + m(S) = 4 + 2 = 6 г.

Для второго опыта:

По условию задачи было взято 4 г серы, значит, масса оставшейся
серы:
4 – 2 = 2 г S в избытке.

По закону сохранения массы веществ 4 г Cu взаимодействует с 2 г S с образованием 6 г CuS.

Соотношение масс реагирующих веществ, закон постоянства состава.
Лабораторный опыт №2
І вариант.
Цель: определить опытным путем соотношение масс реагирующих веществ, доказать правильность закона постоянства состава и закона сохранения масс.
Ход работы
1. Налейте во все пробирки, закрепленные в штативах, по 5 мл раствора
гидроксида натрия.
2. С помощью бюретки налейте определенные объемы раствора сульфата
меди в таком порядке: 1 мл, 1,5 мл, 2 мл, 2,5 мл, 3 мл, 3,5 мл, 4 мл.
3. Через некоторое время в некоторых пробирках образуется осадок, и
надо дать ему отстояться.
4. Заполните таблицу. Высота осадка будет измеряться линейкой.
Вопросы и задания:
1. Напишите уравнение реакции.
2. Какое объемное отношение растворов достаточно для образования осадка?
3. Определите массовые отношения исходных веществ.
4. Сделайте выводы: выполняется ли закон постоянства состава и закон сохранения масс.
ІІ вариант.
Цель: определять опытным путем соотношение масс реагирующих веществ.
Ход работы
1. Напишите уравнение реакции взаимодействия железа с серой:
2. Определить соотношение масс реагирующих веществ:
m (Fe) : m (S) = 56 : 32 = 7 : 4
3. Для удобства и экономии реагентов можно брать исходные вещества в соотношении 3,5 : 2, т. е. на технических весах взвесить 3,5 г железа и 2 г серы.
4. Закрепить тигель на кольце штатива, нагреть, перемешивая стеклянной палочкой взвешенные железо и серу до образования однородной темной массы сульфида железа (ІІ) (рис. 10).
Типы химических реакций
По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций.
1. Реакции соединения – это реакции, в результате которых из нескольких
простых или сложных веществ образуется одно сложное вещество (рис. 10).
2. Реакции разложения – это реакции, в результате которых из одного сложного вещества образуются два и более веществ – простых или сложных.
3. Реакции замещения – это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном соединении. В результате образуются новые простое и сложное вещества (рис. 11а).
4. Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями и образуются два новых сложных вещества (рис. 11б).
С классификацией химических реакций по другим признакам вы познакомитесь позднее.
Химические реакции в природе и жизнедеятельности живых организмов и человека
Вам известно, что в результате химических явлений одни вещества превращаются в другие, отличающиеся от исходных веществ по составу. Это вы можете наблюдать в окружающей среде каждодневно. Например: ржавление железного гвоздя, потускнение серебряных украшений и предметов кухонной утвари, позеленение тазика из латуни, горение дров и газа на плите. Что общего между ними? Все эти процессы происходят под действием кислорода
воздуха, т. е. идет окисление.
Химия в природе. В природе непрерывно идут реакции образования органических веществ из простых неорганических соединений, т. е. идут реакции синтеза (рис. 12):
Такой процесс идет в зеленых растениях и водорослях. Хлорофилл находится в хлоропластах зеленых листьев, поэтому они окрашены в зеленый цвет.
Во время грозы в летний период воздух становится свежее и чище в результате следующих реакций:
При разложении кислорода получаем атомарный кислород. Атомарный кислород, соединяясь с молекулой кислорода, образует озон.
Озон – это газ синего цвета с характерным запахом свежести. Накапливается в верхних слоях атмосферы и образует озоновый слой, который выполняет роль щита нашей планеты. Озон защищает Землю от солнечной радиации из космоса и не допускает остывание Земли, поглощая инфракрасное излучение.
Гниение также относится к реакциям окисления. В отличие от горения, гниение – это медленно протекающие процессы. В результате гниения сложные азотсодержащие вещества взаимодействуют с кислородом при участии микроорганизмов. Для того чтобы шел процесс гниения, кроме микроорганизмов, необходимо наличие влаги. Это уникальный, сложный многоступенчатый процесс, позволяющий перерабатывать белки погибших животных и
растений в соединения, пригодные к усвоению растениями.
На реакциях, лежащих в основе брожения сахаристых веществ, основаны многие производства, например, хлебобулочных изделий и напитков.
В результате реакции окисления глюкозы образуется углекислый газ, вода и большое количество тепла:
Это является источником энергии, необходимой для физической и умственной деятельности в повседневной жизни человека.
Использование пищевой соды способствует поднятию теста, так как при взаимодействии с органическими кислотами выделяется углекислый газ.
Выделяющийся углекислый газ 
Химия в живых организмах
С точки зрения химика, дыхание – также процесс окисления органических веществ: углеводов, жиров, белков.
Часть энергии, выделенной в результате этой реакции, организм использует
для совершения умственной, физической работы.
А вторая часть запасается в организме для того, чтобы можно было использовать ее при синтезе характерных для данного организма белков, углеводов и жиров. Таким образом, энергия, необходимая для жизнедеятельности, получается из питательных веществ, поступающих в организм из окружающей среды.
Антацидные вещества – лекарственные средства для лечения желудочно-кишечных заболеваний. Они нейтрализуют соляную кислоту, которая входит в состав желудочного сока.
Химия в быту
Работа двигателей внутреннего сгорания основана на реакции горения углеводородов (топлива).
Вы, наверное, заметили, что на стенках чайника через некоторое время образуется накипь. При этом идет реакция разложения солей магния и кальция, обусловливающих временную жесткость воды. В результате этих реакций образуются нерастворимые соли кальция и магния.
Из-за накипи выходят из строя нагревательные элементы в стиральных и посудомоечных машинах, утюгах, а также промышленные котлы.
Для очистки чайника от накипи достаточно прокипятить воду, в которую добавлена уксусная кислота.
Для этой цели можно использовать и лимонную кислоту.
«Гашение» соды уксусом – часто наблюдаемая на кухне реакция:
сода 4- уксусная кислота -> соль 4- вода 4- углекислый газ
Хозяйственное мыло не мылится в жесткой воде, т. к. идет реакция обмена с солями кальция и магния и образуется нерастворимая соль, которая «всплывает». Это объясняется тем, что натриевые соли органических кислот растворимые, а кальциевые, магниевые соли – нерастворимые в воде.
Санатории для больных туберкулезом обычно расположены в сосновых борах. Почему? Потому что в хвойных растениях содержится соединение, которое при окислении озоном (после грозы) выделяет атомарный кислород, который обладает дезинфицирующим и отбеливающим свойствами.
Еще одно интересное природное явление – образование в пещерах сталактитов и сталагмитов – это осадок карбоната кальция СаСО3. Сталактиты растут сверху вниз как сосульки, а сталагмиты – снизу вверх (рис. 13).
Химия дает человечеству огромные возможности и силы, но только она требует грамотного и ответственного отношения к ней. За день в мире происходят тысячи различных (опасных для человечества, в то же время интересных) химических реакций. Не зря говорится в изречении М. В. Ломоносова: «Широко распространяет химия руки свои в дела человеческие».
- 1. Обозначения качественного и количественного состава простых и сложных веществ с помощью символов элементов и индексов называются химическими формулами.
- 2. Химическое уравнение — условная запись химической реакции с помощью химических формул и знаков.
- 3. По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций: реакция соединения, реакция разложения, реакция замещения, реакция обмена.
- 4. Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Эта формулировка называется законом сохранения масс веществ.
- 5. Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://present5.com/ximicheskie-znaki-formuly-i-uravneniya-dlya/
http://natalibrilenova.ru/formulyi-veschestv-i-uravneniya-himicheskih-reaktsij/