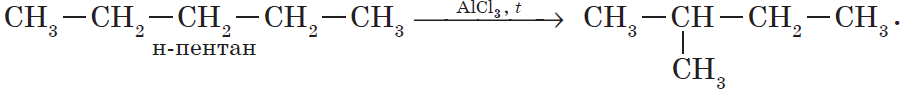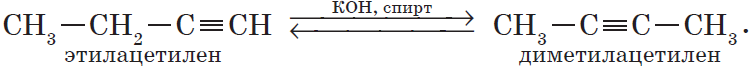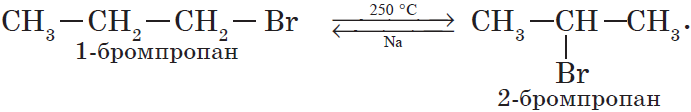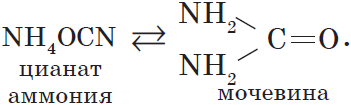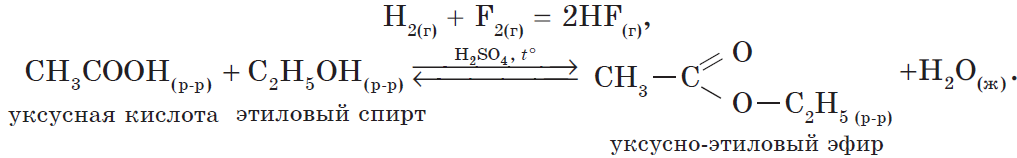Классификация химических реакций в неорганической и органической химии
Теория к заданию 19 из ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
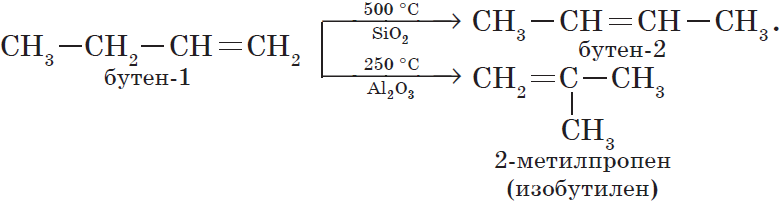
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2<⇄>↖
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
3) реакция полимеризации:
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO<→>↖
2) разложение нитрата калия:
$2KNO_3<→>↖
3) разложение перманганата калия:
$2KMnO_4<→>↖
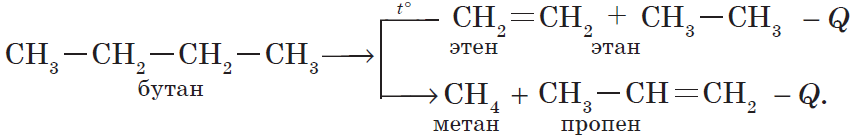
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
3) реакция крекинга (расщепления) пропана:
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
или в ионном виде:
2) реакция между щелочью и солью, идущая с образованием газа:
или в ионном виде:
3) реакция между щелочью и солью, идущая с образованием осадка:
или в ионном виде:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
- многие реакции разложения:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции идут без участия катализатора:
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Химических уравнений неорганических и органических соединений
Внимательно прочитайте теорию:
Давайте рассмотрим генетические связи и генетические ряды:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
нельзя считать генетическим, так как в последнем звене элемент бром отсутствует, хотя реакция для перехода от NaBr к NaNO 3 легко осуществима:
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:

3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
уже можно рассматривать как полный: он начинается простым веществом бромом и им же заканчивается.
Обобщая сказанное выше, можно дать следующее определение генетического ряда:
| Генетическим называют ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис. |
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов: генетический ряд элемента-металла, генетический ряд элемента-неметалла, генетический ряд элемента-металла, которому соответствуют амфотерные оксид и гидроксид.
I. Генетический рад элемента-металла. Наиболее богат веществами ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления +2 и +3:
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
II. Генетический ряд элемента-неметалла. Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например генетический ряд серы со степенями окисления +4 и +6:
Затруднение может вызвать лишь последний переход. Если вы выполняете задания такого типа, то руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например летучее водородное соединение неметалла. В нашем примере:
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
III. Генетический ряд элемента-металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, так как они проявляют в зависимости от условий то свойства кислоты, то свойства основания. Например, рассмотрим генетический ряд алюминия:
В органической химии также следует различать более общее понятие — «генетическая связь» и более частное понятие — «генетический ряд». Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле.
Каждой цифре соответствует определенное уравнение реакции:

Воспользуемся возможностью повторить названия реакций, соответствующих предложенным переходам:
Восстановление оксида кальция в карбид:
Гидролиз карбида кальция:
Самостоятельная работа в тетради (четкую фотографию выслать на почту: apnikitina98@gmail.com в теме указав ФИ, класс):
- Запишите уравнения реакций, иллюстрирующих следующие переходы:
Домашняя работа (сделать в тетради, посмотрю в школе, высылать не нужно)
Запишите уравнения реакций, иллюстрирующих следующие превращения:
Формулы веществ и уравнения химических реакций
Содержание:
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную информацию о химической реакции.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Формулы веществ и уравнения химических реакций
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Расчёты по химическим формулам
По химическим формулам веществ можно производить различные расчеты:
1. Определение численного соотношения атомов.
Для молекулы SO3 численное соотношение атомов составляет 1 : 3, а для

2. Определение относительной молекулярной массы вещества.
3. Расчет массы одной молекулы вещества.
Для молекулы
4. Определение массовых отношений химических элементов в сложном
веществе.
Для молекулы 
5. Расчет массы элемента по известной массе вещества и обратная задача.
а) Сколько граммов меди содержится в 320 г оксида меди (II)?

б) В какой массе карбоната кальция 
6. Расчет массовой доли химического элемента в сложном веществе.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля 


n – число атомов элемента (Э) в молекуле вещества;

Массовые доли обычно выражаются в процентах:
Пример: Рассчитать массовые доли водорода и кислорода в воде

Если вещество состоит из трех элементов, для определения массовой доли третьего элемента можно определить массовые доли двух элементов, затем их сумму отнять от 100%.
6. Составление формул по соотношению масс и массовых долей элементов в молекуле.
а) Выведите формулу вещества, если соотношение масс элементов
m (S) : m (O) = 2 : 3.


x (S) = 2 : 32 = 0,0625
y (О) = 3 : 16 = 0,1875


Поскольку в молекулах не может быть дробных чисел атомов, то делением на наименьшее значение или умножением на какое-то число превращаем дробные числа в целое число:


б) Составьте формулу вещества, если массовые доли элементов в соединении таковы:





Массовая доля элементов в веществе, массовые соотношения атомов, соотношения чисел атомов.
Составление уравнений химических реакций
Химические формулы, индексы, химические реакции
Используя различные слова, мы составляем предложения. Используя формулы веществ, составляем уравнения реакций. Химическое уравнение –условная запись химической реакции с помощью химических формул и знаков. По уравнениям реакций можно определить, в каких количественных отношениях реагируют вещества и сколько продуктов при этом образуется. Вещества, вступающие в реакцию, называются реагентами. Образующиеся при этом вещества называются продуктами.
Алгоритм составления уравнений реакций
1. Записываем схему уравнения реакции: формулы вступающих в реакцию веществ – слева, а образовавшихся – справа.
2. Уравнения реакций отличаются от схем этих же реакций. Например, горение железа в кислороде записывается в виде схемы:
3. В уравнениях реакций число атомов реагирующих веществ должно быть равно числу атомов продуктов реакций. Поэтому в схемах реакций перед формулами веществ ставятся коэффициенты. Подбираем коэффициенты, чтобы число атомов каждого элемента в левой и правой частях равенства было одинаковым. Коэффициент 1 не ставится. Вначале уравниваем число атомов кислорода. Для этого находим наименьшее кратное число для атомов кислорода до и после реакции: 2 · 3 = 6. Делением этого числа на число атомов кислорода находим коэффициенты в левой части – 6 : 2 = 3; затем в правой части – 6 : 3 = 2.
4. Теперь уравниваем число атомов железа и, наконец, заменяем стрелку на знак равенства:
Коэффициенты перед формулами веществ в химических уравнениях называются стехиометрическими коэффициентами.
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой части. Уравнение читается так: 4 атома железа плюс 3 молекулы кислорода равны 2 молекулам оксида железа (III).
При записи химического уравнения подбираются только коэффициенты, а индексы в формулах менять нельзя, так как нельзя произвольно менять состав вещества.
По уравнениям реакций можно получить следующие сведения:
1) качественный состав реагирующих и образовавшихся веществ 
2) соотношения коэффициентов перед формулами: 
3) соотношения масс веществ:
Уравнения реакции, реагенты, продукты, коэффициенты.
Закон сохранения массы веществ
При химических реакциях происходит распад молекул реагирующих
веществ, осуществляется перегруппировка атомов и групп атомов, образуются молекулы продуктов реакции. В результате реакций число атомов не изменяется, поэтому не должны изменяться и массы этих атомов.
Рассмотрим реакцию горения магния:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
В этом и состоит закон сохранения массы. Закон был открыт опытным путем в 1748 г. русским ученым М. В. Ломоносовым. Позднее, в 1789 г., французский ученый А. Лавуазье пришел к такому же выводу независимо от М. В. Ломоносова. Закон сохранения массы веществ имеет огромное значение для естественных наук.
Значение закона сохранения массы веществ
- 1. Открытие закона способствовало дальнейшему развитию химии.
- 2. Все расчетные задачи в химии решаются на его основе. Все химические уравнения составляются на основании этого закона.
- 3. Этот закон является одним из проявлений общего закона природы: вещество не исчезает бесследно и не образуется из ничего.
Закон сохранения массы веществ.
Демонстрация №1
Опыт, доказывающий закон сохранения массы веществ
Цель: Знать закон сохранения массы веществ и доказать это опытным путём.
Проведите реакцию карбоната кальция с соляной кислотой. Для этого предварительно взвесьте колбу с кислотой, а также шарик на весах (рис. 9). Насыпьте 1 г карбоната
кальция в шарик. Затем наденьте его на колбу. Закрепите скотчем. Поднимите надувной шарик, чтобы весь карбонат высыпался в колбу. После проведения реакции взвесьте.
Сделайте выводы.
Соотношение масс реагирующих веществ. Закон постоянства состава
Состав вещества можно выразить числом атомов или массовым отношением атомов в молекуле. Например, для молекулы 
= 1 : 2, а массовые отношения элементов m (C) : m (O) = 12 : 32 = 3 : 8. Или можно взять отношения массовых долей элементов:
Углекислый газ выделяется при горении топлива, при разложении некоторых сложных веществ или в результате дыхания.
Как вы видите, в молекуле 

Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
В настоящее время известны вещества с переменным составом, с ними вы познакомитесь позднее.
В формулах веществ молекулярного строения индекс указывает на количество химического элемента в молекуле вещества.
На основе закона постоянства состава вещества можно производить различные расчеты. Рассмотрим следующий пример:
При взаимодействии меди с серой образуется 1 моль сульфида меди (II):
m (Cu) : m (S) = 64 : 32 = 2 : 1
Значит, из 2 г Cu и 1 г S образуется сульфид меди (ІІ).
Проведем два опыта.
1. Возьмем смесь, состоящую из 5 г меди и 2 г серы. После нагревания получим смесь сульфида меди с медью, так как 1 г меди находится в избытке. В смеси содержится 6 г CuS и 1 г Сu.
2. Теперь возьмем по 4 г меди и серы. В этом случае после нагревания образуется смесь сульфида меди и серы, так как 2 г серы остаются неизрасходованными и образуется 6 г сульфида меди.
Проверим результаты опытов математическим путем.
Для первого опыта:


m(Cu) + m(S) = 4 + 2 = 6 г.

Для второго опыта:

По условию задачи было взято 4 г серы, значит, масса оставшейся
серы:
4 – 2 = 2 г S в избытке.

По закону сохранения массы веществ 4 г Cu взаимодействует с 2 г S с образованием 6 г CuS.

Соотношение масс реагирующих веществ, закон постоянства состава.
Лабораторный опыт №2
І вариант.
Цель: определить опытным путем соотношение масс реагирующих веществ, доказать правильность закона постоянства состава и закона сохранения масс.
Ход работы
1. Налейте во все пробирки, закрепленные в штативах, по 5 мл раствора
гидроксида натрия.
2. С помощью бюретки налейте определенные объемы раствора сульфата
меди в таком порядке: 1 мл, 1,5 мл, 2 мл, 2,5 мл, 3 мл, 3,5 мл, 4 мл.
3. Через некоторое время в некоторых пробирках образуется осадок, и
надо дать ему отстояться.
4. Заполните таблицу. Высота осадка будет измеряться линейкой.
Вопросы и задания:
1. Напишите уравнение реакции.
2. Какое объемное отношение растворов достаточно для образования осадка?
3. Определите массовые отношения исходных веществ.
4. Сделайте выводы: выполняется ли закон постоянства состава и закон сохранения масс.
ІІ вариант.
Цель: определять опытным путем соотношение масс реагирующих веществ.
Ход работы
1. Напишите уравнение реакции взаимодействия железа с серой:
2. Определить соотношение масс реагирующих веществ:
m (Fe) : m (S) = 56 : 32 = 7 : 4
3. Для удобства и экономии реагентов можно брать исходные вещества в соотношении 3,5 : 2, т. е. на технических весах взвесить 3,5 г железа и 2 г серы.
4. Закрепить тигель на кольце штатива, нагреть, перемешивая стеклянной палочкой взвешенные железо и серу до образования однородной темной массы сульфида железа (ІІ) (рис. 10).
Типы химических реакций
По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций.
1. Реакции соединения – это реакции, в результате которых из нескольких
простых или сложных веществ образуется одно сложное вещество (рис. 10).
2. Реакции разложения – это реакции, в результате которых из одного сложного вещества образуются два и более веществ – простых или сложных.
3. Реакции замещения – это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном соединении. В результате образуются новые простое и сложное вещества (рис. 11а).
4. Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями и образуются два новых сложных вещества (рис. 11б).
С классификацией химических реакций по другим признакам вы познакомитесь позднее.
Химические реакции в природе и жизнедеятельности живых организмов и человека
Вам известно, что в результате химических явлений одни вещества превращаются в другие, отличающиеся от исходных веществ по составу. Это вы можете наблюдать в окружающей среде каждодневно. Например: ржавление железного гвоздя, потускнение серебряных украшений и предметов кухонной утвари, позеленение тазика из латуни, горение дров и газа на плите. Что общего между ними? Все эти процессы происходят под действием кислорода
воздуха, т. е. идет окисление.
Химия в природе. В природе непрерывно идут реакции образования органических веществ из простых неорганических соединений, т. е. идут реакции синтеза (рис. 12):
Такой процесс идет в зеленых растениях и водорослях. Хлорофилл находится в хлоропластах зеленых листьев, поэтому они окрашены в зеленый цвет.
Во время грозы в летний период воздух становится свежее и чище в результате следующих реакций:
При разложении кислорода получаем атомарный кислород. Атомарный кислород, соединяясь с молекулой кислорода, образует озон.
Озон – это газ синего цвета с характерным запахом свежести. Накапливается в верхних слоях атмосферы и образует озоновый слой, который выполняет роль щита нашей планеты. Озон защищает Землю от солнечной радиации из космоса и не допускает остывание Земли, поглощая инфракрасное излучение.
Гниение также относится к реакциям окисления. В отличие от горения, гниение – это медленно протекающие процессы. В результате гниения сложные азотсодержащие вещества взаимодействуют с кислородом при участии микроорганизмов. Для того чтобы шел процесс гниения, кроме микроорганизмов, необходимо наличие влаги. Это уникальный, сложный многоступенчатый процесс, позволяющий перерабатывать белки погибших животных и
растений в соединения, пригодные к усвоению растениями.
На реакциях, лежащих в основе брожения сахаристых веществ, основаны многие производства, например, хлебобулочных изделий и напитков.
В результате реакции окисления глюкозы образуется углекислый газ, вода и большое количество тепла:
Это является источником энергии, необходимой для физической и умственной деятельности в повседневной жизни человека.
Использование пищевой соды способствует поднятию теста, так как при взаимодействии с органическими кислотами выделяется углекислый газ.
Выделяющийся углекислый газ 
Химия в живых организмах
С точки зрения химика, дыхание – также процесс окисления органических веществ: углеводов, жиров, белков.
Часть энергии, выделенной в результате этой реакции, организм использует
для совершения умственной, физической работы.
А вторая часть запасается в организме для того, чтобы можно было использовать ее при синтезе характерных для данного организма белков, углеводов и жиров. Таким образом, энергия, необходимая для жизнедеятельности, получается из питательных веществ, поступающих в организм из окружающей среды.
Антацидные вещества – лекарственные средства для лечения желудочно-кишечных заболеваний. Они нейтрализуют соляную кислоту, которая входит в состав желудочного сока.
Химия в быту
Работа двигателей внутреннего сгорания основана на реакции горения углеводородов (топлива).
Вы, наверное, заметили, что на стенках чайника через некоторое время образуется накипь. При этом идет реакция разложения солей магния и кальция, обусловливающих временную жесткость воды. В результате этих реакций образуются нерастворимые соли кальция и магния.
Из-за накипи выходят из строя нагревательные элементы в стиральных и посудомоечных машинах, утюгах, а также промышленные котлы.
Для очистки чайника от накипи достаточно прокипятить воду, в которую добавлена уксусная кислота.
Для этой цели можно использовать и лимонную кислоту.
«Гашение» соды уксусом – часто наблюдаемая на кухне реакция:
сода 4- уксусная кислота -> соль 4- вода 4- углекислый газ
Хозяйственное мыло не мылится в жесткой воде, т. к. идет реакция обмена с солями кальция и магния и образуется нерастворимая соль, которая «всплывает». Это объясняется тем, что натриевые соли органических кислот растворимые, а кальциевые, магниевые соли – нерастворимые в воде.
Санатории для больных туберкулезом обычно расположены в сосновых борах. Почему? Потому что в хвойных растениях содержится соединение, которое при окислении озоном (после грозы) выделяет атомарный кислород, который обладает дезинфицирующим и отбеливающим свойствами.
Еще одно интересное природное явление – образование в пещерах сталактитов и сталагмитов – это осадок карбоната кальция СаСО3. Сталактиты растут сверху вниз как сосульки, а сталагмиты – снизу вверх (рис. 13).
Химия дает человечеству огромные возможности и силы, но только она требует грамотного и ответственного отношения к ней. За день в мире происходят тысячи различных (опасных для человечества, в то же время интересных) химических реакций. Не зря говорится в изречении М. В. Ломоносова: «Широко распространяет химия руки свои в дела человеческие».
- 1. Обозначения качественного и количественного состава простых и сложных веществ с помощью символов элементов и индексов называются химическими формулами.
- 2. Химическое уравнение — условная запись химической реакции с помощью химических формул и знаков.
- 3. По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций: реакция соединения, реакция разложения, реакция замещения, реакция обмена.
- 4. Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Эта формулировка называется законом сохранения масс веществ.
- 5. Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://www.sites.google.com/site/chemnikitina/vizitka/11-klass/geneticeskaa-svaz-neorganiceskih-i-organiceskih-vesestv
http://natalibrilenova.ru/formulyi-veschestv-i-uravneniya-himicheskih-reaktsij/