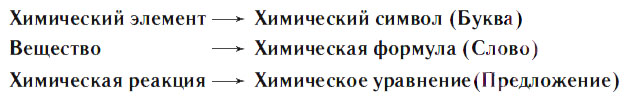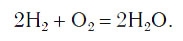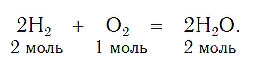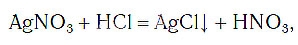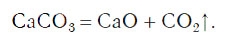Урок 11. Химические уравнения
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.
До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.

М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
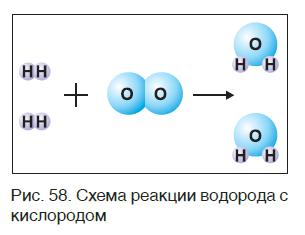
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):
При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*10 23 ), то коэффициенты показывают и химические количества каждого из веществ:
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:
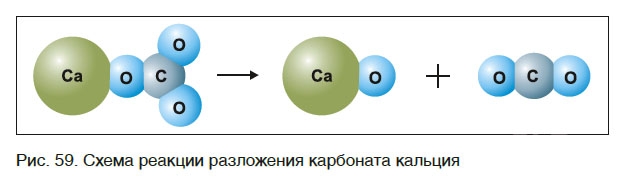
знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химическое уравнение это условная запись состава
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три .
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
| ЗАДАНИЕ. Обозначить, используя символы химических элементов а) три молекулы азота б) семь молекул сульфида железа в) четыре атома серы г) два атома кальция д) семь молекул воды е) четыре молекулы кислорода ж) две молекулы сернистой кислотыОТВЕТ: а) три молекулы азота — 3N2 б) семь молекул сульфида железа — 7FeS в) четыре атома серы — S4 г) два атома кальция — Ca2 д) семь молекул воды — 7H2O е) четыре молекулы кислорода — 4O2 ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4. |
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Химические уравнения.
Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
http://uchitel.pro/%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%84%D0%BE%D1%80%D0%BC%D1%83%D0%BB%D0%B0/
http://www.calc.ru/Khimicheskiye-Uravneniya.html