Разложение перманганата калия. Свойства солей марганцевой кислоты
Окислительно-восстановительные процессы лежат в основе важнейших явлений живой и неживой природы: горения, разложения сложных веществ, синтеза органических соединений. Перманганат калия, свойства которого мы изучим в нашей статье, относится к наиболее сильным окислителям, применяемым в лабораторных и промышленных условиях. Его окислительные способности зависят от степени окисления атома, которая меняется в ходе реакции. Рассмотрим это на конкретных примерах химических процессов, происходящих с участием молекул KMnO4.
Характеристика вещества
Рассматриваемое нами соединение (перманганат калия) является одним из наиболее применяемых в промышленности веществ – соединений марганца. Соль представлена кристаллами в виде правильных призм темно-фиолетового цвета. Она хорошо растворяется в воде и образует раствор малинового цвета, обладающий прекрасными бактерицидными характеристиками. Поэтому вещество нашло широкое применение как в медицине, так и в быту в качестве бактерицидного средства. Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
Опыты с марганцовкой
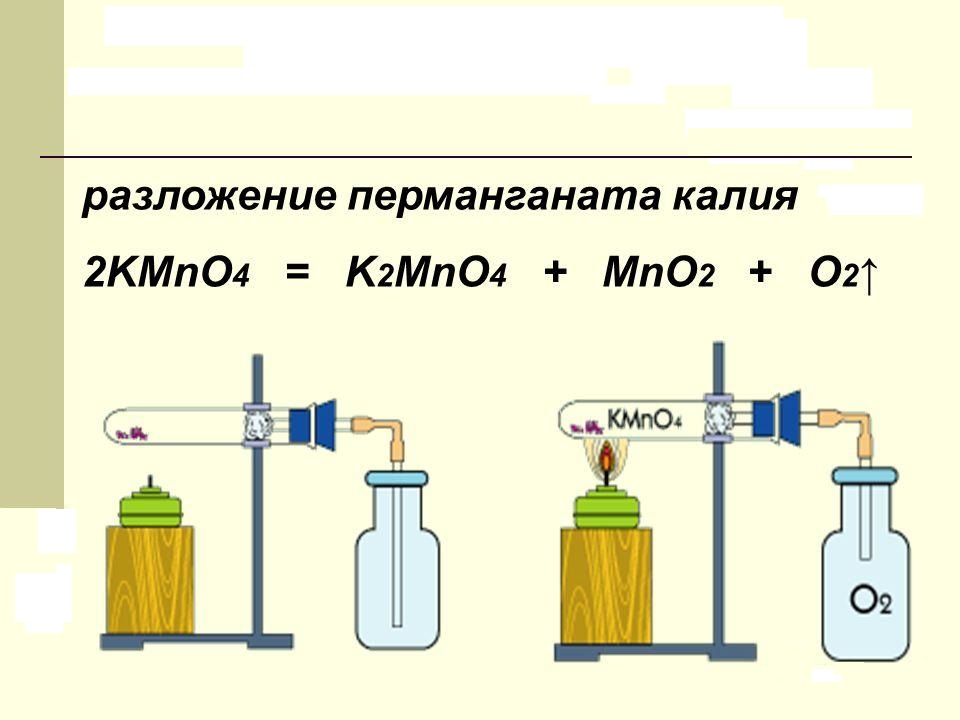
Вещество, в быту называемое марганцовкой, при нагревании разлагается. В продуктах реакции обнаруживается свободный кислород, двуокись марганца и новая соль – K2MnO4. В лаборатории этот процесс проводят для получения чистого кислорода. Химическое уравнение разложения перманганата калия можно представить так:
Сухое вещество, представляющее собой фиолетовые кристаллы в виде правильных призм, нагревают до температуры +200 °C. Катион марганца, находящийся в составе соли, имеет степень окисления, равную +7. Она снижается в продуктах реакции до величин +6 и +4 соответственно.
Окисление этилена
Газообразные углеводороды, относящиеся к различным классам органических соединений, имеют как одинарные, так и кратные связи между атомами углерода в составе своих молекул. Как определить присутствие пи-связей, лежащих в основе непредельного характера органического соединения? Для этого проводят химические опыты, пропуская исследуемое вещество (например, этен или ацетилен) через фиолетовый раствор перманганата калия. Наблюдается его обесцвечивание, так как непредельная связь разрушается. Молекула этилена окисляется и из непредельного углеводорода превращается в двухатомный предельный спирт – этиленгликоль. Данная реакция является качественной на наличие двойных или тройных связей.
Особенности химических проявлений KMnO4
Если степени окисления реагентов и продуктов реакции изменяются, значит происходит реакция окисления-восстановления. В ее основе лежит явление перемещения электронов от одних атомов к другим. Как и в случае с разложением перманганата калия, так и в других реакциях, вещество проявляет ярко выраженные свойства окислителя. Например, в подкисленном растворе сернистокислого натрия и перманганата калия образуется сульфаты натрия, калия и марганца, а также вода:
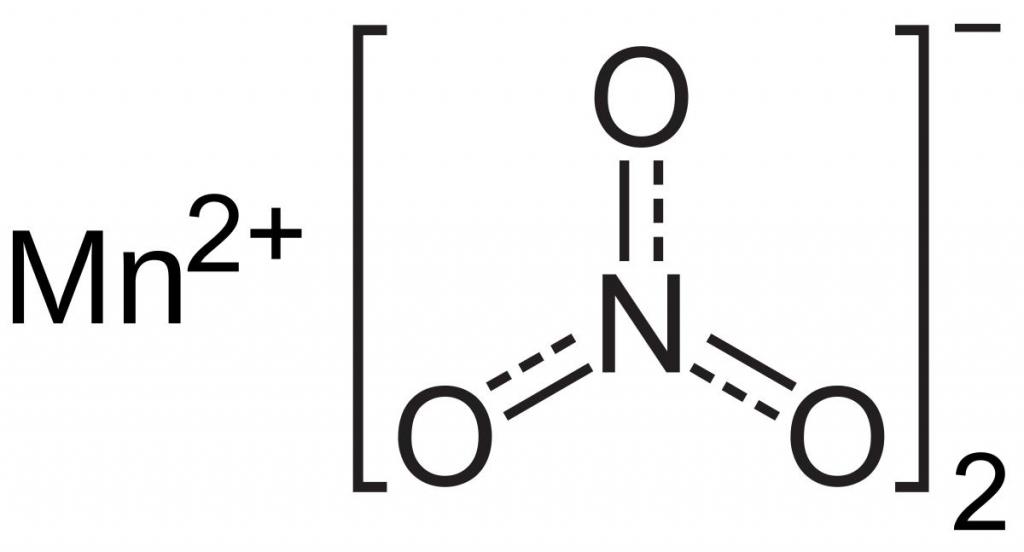
В этом случае ион серы является восстановителем, а марганец, входящий в сложный анион MnO4 — , проявляет свойства окислителя. Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Влияние среды на протекание химической реакции
В зависимости от концентрации ионов водорода или гидроксильных групп различают кислый, щелочной или нейтральный характер раствора, в котором происходит окислительно-восстановительная реакция. Например, при избыточном содержании катионов водорода, ион марганца со степенью окисления +7 в перманганате калия понижает ее до +2. В щелочной среде, при высокой концентрации гидроксильных групп, сульфит натрия, взаимодействуя с перманганатом калия, окисляется до сульфата. Ион марганца со степенью окисления +7 переходит в катион с зарядом +6, находящийся в составе K2MnO4, раствор которого имеет зеленую окраску. В нейтральной среде сульфит натрия и перманганат калия реагируют между собой, при этом осаждается двуокись марганца. Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.
Применение солей марганцевой кислоты
Реакция разложения перманганата калия при нагревании и другие окислительно-восстановительные процессы, проходящие с участием солей марганцевой кислоты, часто используются в промышленности. Например, окисление многих органических соединений, выделение газообразного хлора из соляной кислоты, превращение солей двухвалентного железа в трехвалентное. В сельском хозяйстве раствор KMnO4 применяют для предпосевной обработки семян и почвы, в медицине им обрабатывают поверхность ран, дезинфицируют воспаленные слизистые оболочки носовой полости, используют для обеззараживания предметов личной гигиены.
В нашей статье мы не только подробно изучили процесс разложения перманганата калия, но также рассмотрели его окислительные свойства и применение в быту и промышленности.
Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Реакция термического разложения перманганата калия
2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
Реакция термического разложения перманганата калия с образованием манганата калия, оксида марганца(IV) и кислорода. Реакция протекает при температуре выше 200°C. Лабораторный метод получения кислорода.
Термическое разложение перекристаллизованного, просушенного и дегазированного перманганата калия в вакууме — лучший способ получения высокочистого кислорода, легко поддающийся контролю. [16]
http://chemege.ru/reakcii-razlozheniya/
http://chemiday.com/reaction/3-1-0-329




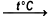 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2