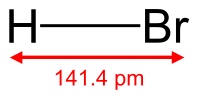
Бромоводород
| Бромоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | бромоводород | ||
| Традиционные названия | Бромистый водород | ||
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм , 20,003 бар , 26,5 бар и 40,7 бар | ||
| Константа диссоциации кислоты pKa | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES | |||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Транспортировка
- 6 Токсичность
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
2.3.1. Химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s 1 . С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген
Физические свойства
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns 2 np 5 , где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
HCl + HClO» width=»225″ height=»28″/>
HBr + HBrO» width=»225″ height=»28″/>
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
5NaI + NaIO3 + 3H2O» width=»341″ height=»62″/>
Бромоводородная кислота. Способы получения, физические и химические свойства
Бромоводородная кислота (другое название бромоводород) — это неорганическое соединение водорода (H) с бромом (Br). Это бесцветный газ, который во влажном воздухе образует густой туман.
Какие существуют способы получения бромоводорода
По причине высокой степени окисляемости бромоводороной кислоты, ее нельзя получить посредством воздействия серной кислоты концентрированной на бромиды металлов щелочных. Происходит следующая реакция:
2KBr (бромид калия) + 2Н2SO4 (кислота серная) = К2SO4 (калия сульфат) + SO2 (оксид серы) + Br2 (молекула брома) + 2Н2О (вода)
1. В промышленности получение кислот, таких как бромоводородная, осуществляется посредством реакции, в ходе которой взаимодействуют составляющие элементы. Например, рассматриваемое нами вещество можно получить следующим способом:
H2 (молекула водорода) + Br2 (молекула брома) = 2HBr (бромоводородная кислота)
Эта реакция осуществима при температуре от 200 до 400 градусов.
2. Также возможно получение бромоводородной кислоты и в лабораторных условиях несколькими способами.
— посредством гидролиза пентабромида фосфора или трибромида:
PBr3 (трибромид) + 3H2O (три молекулы воды) = H3PO3 (кислота фосфорная) + 3HBr (бромоводородная кислота, формула химическая)
PBr5 (пентабромид) + 4H2O (четыре молекулы воды) = H3PO4 (кислота фосфорная) + 5HBr (бромоводород)
— путем восстановления брома:
3Br2 (три молекулы брома) + S (сера) + 4H2O (вода) = (реакция возможна при температуре, равной 100-150 градусов) H2SO4 (серная кислота) + 6HBr (бромоводород)
3Br2 (три молекулы брома) + KNO2 (калия нитрит) + 4H2O (вода) = KNO3 (нитрат калия) + 2HBr (бромоводород)
— посредством вытеснения разбавленной кислотой щелочных металлов из бромидов:
KBr (бромистый калий) + H2SO4 (серная кислота) = KHSO4 (калия гидросульфат) + HBr (выделяется в виде газа)
3. Как побочный продукт бромистый водород можно получить при синтезе органических бромопроизводных соединений.
Физические свойства бромоводорода:
1. Бромоводородная кислота — это газ без цвета, имеющий неприятный и резкий запах. Сильно дымится на воздухе. Обладает высокой устойчивостью к температурам.
2. Хорошо растворяется в H2O (вода) и этаноле с образованием электролита. Водный раствор бромоводорода образует азеотропную смесь, которая кипит при температуре 124 градуса. В одном литре воды растворяется около полулитра бромводорода (при 0 градусов).
3. В процессе охлаждения водного раствора бромистого водорода можно получить следующие кристаллогидраты: HBr*H2O, HBr*2H2O, HBr*4H2O.
4. Чистый бромоводород образует кристаллы сингонии орторомбической, пространственной группы F mmm.
5. При температуре -66,8 градусов переходит в жидкое состояние, а при — 87 градусов затвердевает.
Химические свойства бромоводорода:
1. Бромоводородная кислота при взаимодействии с водой образует сильную кислоту одноосновную. Эта реакция выглядит так:
HBr + H2O (вода) = Br- (анион брома) + H3O+ (ион гидроксония)
2. Данное вещество устойчиво к высоким температурам, однако, при 1000 градусах около 0,5% всех молекул разлагаются:
2HBr (бромоводородная кислота) = H2 (молекула водорода) + Br2 (молекула брома)
3. Рассматриваемое нами химическое соединение реагирует с различными металлами, а также их основаниями и оксидами. Примеры реакций:
2HBr + Mg (магний) = MgBr2 (бромид магния) + H2 (выделяется в виде газа)
2HBr + CaO (кальция оксид) = CaBr2 (бромид кальция) + H2O (вода)
HBr + NaOH (натрия гидроксид) = NaBr (бромид натрия) + H2O (вода)
4. Бромоводород также является восстановителем. На воздухе медленно окисляется. По этой причине его водные растворы через некоторое время окрашиваются в бурый цвет. Реакция будет такая:
4HBr (бромоводородная кислота) + O2 (молекула кислорода) = 2Br2 (молекула брома) + 2H2O (вода)
Применение
Бромоводород используют для создания (синтеза) различных органических производных брома и для приготовления бромидов различных металлов. Особенное значение имеет бромид серебра, так как он используется в производстве кинофотоматериалов.
Как производится транспортировка
В баллонах емкостью 68 или 6,8 литров под давлением в 24 атмосферы.
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-vodoroda-i-galogenov
http://fb.ru/article/47093/bromovodorodnaya-kislota-sposobyi-polucheniya-fizicheskie-i-himicheskie-svoystva