§ 36. Электролитическая диссоциация
Как вы знаете из уроков физики, растворы одних веществ способны проводить электрический ток, а других — нет. Чтобы опытным путём проверить эту способность у растворов различных веществ, воспользуемся следующим прибором (рис. 129).
Он состоит из стакана, в который наливают раствор исследуемого вещества. На стакан ставят пластинку из эбонита с вмонтированными в неё двумя угольными электродами, к клеммам которых присоединены провода. Один из них соединён с лампочкой.

Выходной контакт от лампочки и провод от другой клеммы идут к источнику тока. Если раствор, налитый в стакан, проводит электрический ток, то лампочка загорается, и чем лучше эта способность, тем ярче горит лампочка. Проводят электрический ток растворы солей, щелочей, кислот.
| Вещества, растворы которых проводят электрический ток, называют электролитами. |
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
| Вещества, растворы которых не проводят электрический ток, называют неэлектролитами. |
Почему же растворы электролитов проводят электрический ток?
Шведский учёный Сванте Аррениус, изучая электропроводность растворов различных веществ, пришёл в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
| Процесс распада электролита на ионы называют электролитической диссоциацией. |
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решёткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита (рис. 130).
Рис. 130.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате химическая связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
- ориентация молекул — диполей воды около ионов кристалла;
- гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
- диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощённо происходящие процессы можно отразить с помощью следующего уравнения:
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная полярная связь (например, молекулы хлороводорода НСl, рис. 131), только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную, и последовательность процессов, происходящих при этом, будет такая:
- ориентация молекул воды вокруг полюсов молекулы электролита;
- гидратация (взаимодействие) молекул воды с молекулами электролита;
- ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
- диссоциация (распад) молекул электролита на гидратированные ионы.
Рис. 131.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Уравнение диссоциации соляной кислоты:
В растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и объединиться. Этот обратный процесс называют ассоциацией.
Свойства гидратированных и негидратированных ионов различаются. Например, негидратированный ион меди Сu 2+ — бесцветный в безводных кристаллах сульфата меди (II) CuSO4 и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Сu 2+ • nH2O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой α («альфа»).
| Степень диссоциации — это отношение количества вещества электролита, распавшегося на ионы (nд), к общему количеству растворенного вещества(nр): |
Степень диссоциации электролита определяют опытным путём и выражают в долях или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1, или 100%, то электролит полностью распадается на ионы. Электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице в разбавленных растворах.
К сильным электролитам относят:
- практически все соли;
- сильные кислоты, например: H2SO4, НСl, HNO3;
- все щёлочи, например: NaOH, КOН.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относят:
- слабые кислоты, например: H2S, H2CO3, HNO2;
- водный раствор аммиака NH3 • Н2O.
Ключевые слова и словосочетания
- Электролиты и неэлектролиты.
- Электролитическая диссоциация и ассоциация.
- Механизм диссоциации веществ с различным типом связи.
- Степень электролитической диссоциации.
- Сильные и слабые электролиты.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Объясните, почему раствор гидроксида калия проводит электрический ток, а раствор глюкозы С6Н12O6 — нет.
- Почему при разбавлении раствора электролита степень его диссоциации увеличивается?
- Докажите, что деление химических связей на ковалентную полярную и ионную условно.
- Как отличается по своей природе электропроводность металлов и электролитов?
- Как объяснить электрическую проводимость водных растворов электролитов?
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация

Средняя оценка: 4.1
Всего получено оценок: 953.
Средняя оценка: 4.1
Всего получено оценок: 953.
Процесс распада молекул на ионы называется электролитической диссоциацией. Впервые теорию диссоциации сформировал шведский учёный Сванте Август Аррениус в 1887 году. Он исследовал электропроводность растворов и пришёл к выводу, что вещества распадаются на заряженные частицы.
Суть процесса
По степени электропроводности все растворы или расплавы веществ делятся на две группы:
- электролиты – проводят электрический ток;
- неэлектролиты – не проводят электрический ток.
Электролиты и неэлектролиты при одинаковых объёмах и концентрациях помимо электропроводности отличаются другими физическими свойствами. Например, электролиты обладают более высокой температурой кипения. Разница физических свойств объясняется большим количеством заряженных частиц, образующихся в растворе или в расплаве.
В растворе под действием молекул воды молекулы вещества распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. То же самое происходит в расплаве при высоких температурах. Образование свободных ионов – сущность процесса диссоциации.
Именно наличие большого количества заряженных частиц объясняет способность растворов или расплавов проводить электрический ток. Образовавшиеся ионы являются переносчиками электрического тока.
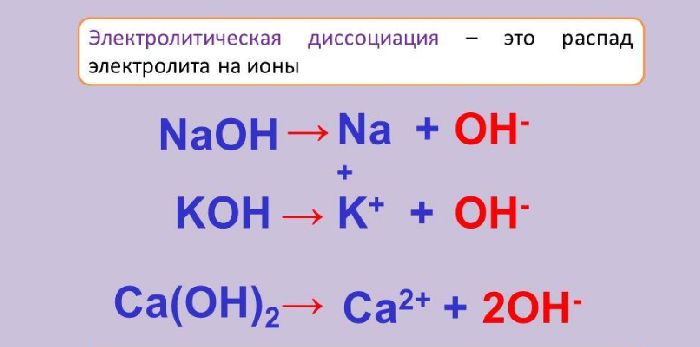
Электролиты в зависимости от степени диссоциации делятся на две группы:
- слабые – плохо распадаются на ионы;
- сильные – хорошо растворимы, легко распадаются на ионы.
Степень электролитической диссоциации – отношение количества распавшихся на ионы молекул к общему количеству молекул вещества:
Степень диссоциации зависит от температуры, давления, химических свойств электролита и растворителя. От степени диссоциации зависит электропроводность раствора. Сильные электролиты лучше проводят ток, чем слабые электролиты.
Только полярные молекулы подвергаются электролитической диссоциации. Такие молекулы связаны ковалентной полярной или ионной связью. Электролитическая диссоциация молекул – обратимый процесс.
Теория Аррениуса
Аррениус, исследовав тему электропроводности растворов, сформулировал теорию электролитической диссоциации. Основные положения теории до сих пор используются в химии:
- молекулы электролитов распадаются на катионы и анионы;
- в растворе электролита катионы движутся к катоду, анионы – к аноду;
- одновременно с распадом молекул происходит обратный процесс – ионы соединяются в молекулы.
В 1891 году Иван Каблуков дополнил теорию Аррениуса. Он ввёл понятие сольватации – электростатического взаимодействия между частицами растворённого вещества и растворителя.
Диссоциации разных веществ
Сложные вещества можно описать с точки зрения электролитической диссоциации. Определения и описания веществ даны в таблице.
Вещество
Определение
Примеры
Электролит, образующий при диссоциации только катионы водорода – Н +
Электролит, при диссоциации которого образуется анион ОН – – гидроксид-ион. Амфотерные основания называются амфолитами. Они распадаются на катион водорода и анион гидроксид-иона.
Электролит, образующий катион металла или аммония (NH4 + ) и анион кислотного остатка
Что мы узнали?
Из урока 8-9 класса узнали, что такое электролитическая диссоциация. В растворах под действием воды или в расплавах под действием температуры молекулы вещества расщепляются на заряженные частицы – ионы. Способность распадаться на ионы называется электролитической диссоциацией, а проводящие электричество растворы – электролитами. Быстрорастворимые вещества называются сильными электролитами, плохо растворимые – слабыми электролитами. Способность веществ распадаться на молекулы исследовал и описал в теории Сванте Август Аррениус. Сложные вещества распадаются по-разному. Кислоты образуют Н + , основания – ОН – , соли – катион металла и анион кислотного остатка.
http://studarium.ru/article/159
http://obrazovaka.ru/himiya/elektroliticheskaya-dissociaciya-molekul-8-klass.html













