Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
| t | ||
| 2HCl | → | Cl2 + H2. |
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
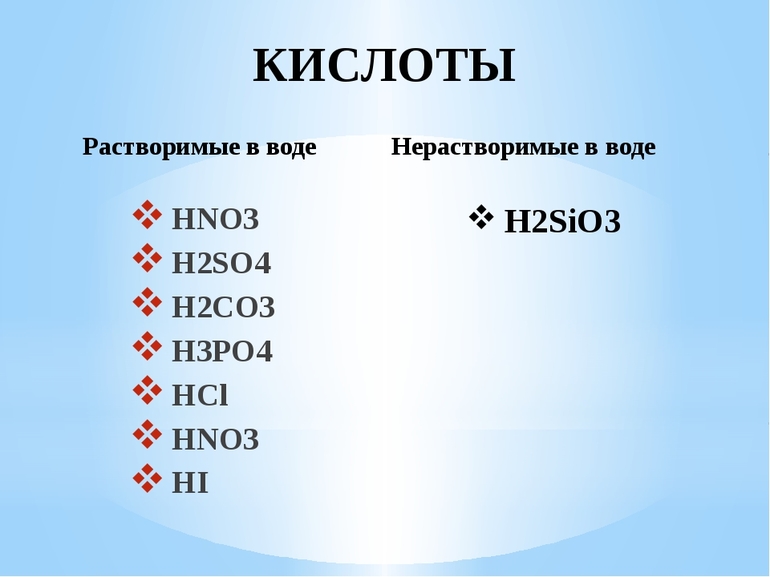
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Задания обучающего характера по теме «Кислоты» (8 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Напишите уравнения возможных реакций:
фосфорная кислота + оксид калия;
соляная кислота + оксид серы ( VI );
серная кислота + оксид алюминия;
азотная кислота + гидроксид железа ( III );
азотная кислота + серная кислота;
фосфорная кислота + карбонат калия;
серная кислота + нитрат бария;
фосфорная кислота + хлорид натрия;
серная кислота + хлорид серебра;
серная кислота + алюминий;
соляная кислота + медь.
Запишите уравнения реакций, происходящих согласно схеме:
Напишите уравнения реакций нейтрализации, приводящих к получению следующих солей: а) сульфата калия; б) фосфата кальция; в) нитрата бария.
С какими из перечисленных веществ будет реагировать соляная кислота:
оксид магния, оксид азота ( V ), оксид цинка, гидроксид калия, гидроксид алюминия, бромоводородная кислота, карбонат бария, нитрат магния, нитрат серебра, сульфат свинца ( II ), магний, серебро?
Напишите уравнения возможных реакций
Осуществите цепочку превращений:
а) литий ® оксид лития ® гидроксид лития ® нитрат лития;
б) фосфор ® оксид фосфора ( V ) ® фосфорная кислота ® фосфат калия.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 920 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 36 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 585 261 материал в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 16.10.2015
- 14594
- 285
- 16.10.2015
- 414
- 0
- 16.10.2015
- 6860
- 4
- 16.10.2015
- 849
- 0
- 16.10.2015
- 1083
- 1
- 16.10.2015
- 9711
- 271
- 16.10.2015
- 1242
- 2
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 16.10.2015 13921
- DOCX 29.5 кбайт
- 366 скачиваний
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Миронова Татьяна Викторовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 4 месяца
- Подписчики: 0
- Всего просмотров: 73201
- Всего материалов: 15
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Минпросвещения подключит студотряды к обновлению школьной инфраструктуры
Время чтения: 1 минута
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Получите новую специальность со скидкой 10%
Цена от 4900 740 руб. Промокод (до 23 февраля): Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
Химические свойства кислот — формулы, уравнения и примеры взаимодействия
Склонность к диссоциации
В водных растворах кислоты свободно диссоциируют на катионы водорода и кислотные остатки. Этот процесс не занимает много времени. Все кислоты делятся на малодиссоциирующие и диссоциирующие. Для корректного построения уравнения сильных одноосновных соединений может быть использована одна направленная вправо стрелка (→), либо знак равенства (=). Таким способом можно показать необратимость такой диссоциации. К примеру, самое элементарное уравнение диссоциации соляной кислоты можно записать двумя способами: HCl → H + + CL — или HCl = H + + CL — . Оба варианта являются правильными.
Используемая стрелка нужна для того, чтобы наглядно показать, что обратный процесс объединения кислотных остатков с катионами водорода практически не происходит. Если по условиям задачи нужно будет написать уравнение диссоциации одноосновного слабого соединения, тогда будет использоваться уже 2 стрелки (↔), которые будут направлены в разные стороны. Этот приём используется в химии для того, чтобы показать обратимость диссоциации слабых соединений. Такой подход особенно актуален в том случае, когда ярко выражен обратный процесс объединения имеющихся катионов водорода с кислотными остатками.
Химический процесс может происходить ступенчато. В этом случае речь касается многоосновных веществ, у которых катионы водорода отрываются от молекул не одновременно, а по очереди. Для выражения диссоциации понадобиться уже несколько уравнений, итоговое количество которых будет соответствовать основности кислот. Для лучшего понимания этого правила следует рассмотреть пример. При использовании трехосновной фосфорной кислоты диссоциация протекает сразу в три ступени с поочерёдным открытием катионов Н + :
- Н3РО4 ↔ Н + + Н2РО4 — .
- Н2РО4 — ↔ Н + + НРО4 2- .
- НРО4 2- ↔ Н + + РО4 3- .
Для правильного решения аналогичных задач нужно понимать, что каждая последующая степень диссоциации всегда протекает в меньшей степени, нежели предыдущая. Такое явление основано на увеличении заряда кислотных остатков, из-за чего прочность связи между ними и положительными ионами только возрастает.
Среди многоосновных веществ в категорию исключений входит только H2SO4. Это связано с тем, что это соединение диссоциирует сразу по двум ступеням.
Специфическое окисление
Из уроков химии достоверно известно, что сила концентрации H2SO4 и HNO3 способна удивлять. Эти вещества воздействуют не только на металлы, которые расположены до водорода в ряду активности, но и на другие элементы после него (за исключением золота, платины).
Кислородсодержащие азотные и серные кислоты могут окислить не только серебро и медь, но и ртуть. Но нужно понимать, что некоторые металлы (Fe, Al, Cr) являются довольно активными, так как расположены до водорода, но они не реагируют на HNO3, H2SO4 без предварительного нагревания. Это связано с пассивацией. На поверхности таких металлов образуется защитная плёнка, состоящая из твёрдых продуктов окисления. Благодаря этому молекулы H2SO4 и HNO3 не могут проникать вглубь металла для активации химической реакции. Но если температура будет высокой, тогда окисление произойдёт.
Если речь идет о взаимодействии кислот с металлами, тогда обязательными продуктами будет соль и вода. Дополнительно выделяется третий продукт, формула которого зависит от активности металлов, температуры химической реакции. Каждая ситуация является индивидуальной.
Азотная и серная кислоты отличаются высокой окислительной способностью, что позволяет им вступать в химическую реакцию практически со всеми металлами ряда активности, а также с твёрдыми неметаллами. Например, фосфор, углерод, сера. Наглядно увидеть список продуктов взаимодействия H2SO4, HNO3 с металлами можно увидеть в таблице кислот. В 8 классе химия изучается не углублённо, но выучить названия химических элементов и их свойства нужно обязательно.
Восстановительные реакции
Окислители представляют собой частицы (атомы, ионы, молекулы), которые во время химической реакции принимают электроны. При этом степень окисления постепенно понижается, а окислители восстанавливаются.
Все известные бескислородные кислоты (за исключением HF) под воздействием различных окислителей проявляют восстановительные свойства, но это только благодаря химическому элементу, который входит в состав аниона. К примеру, дихроматом калия, диоксидом марганца, перманганатом калия окисляются все галогеноводородные соединения. В категорию исключений входит только HF. А вот галогенид-ионы могут окисляться только до свободных галогенов. Химическую реакцию можно оформить следующим образом:
- 4HCl + MnJ2 → MnCl2 + Cl2↑ + 2H2O.
- 16Br + 2KMnO4 → 2KBr + 2MnBr2 + 8H2O + 5Br2.
- 14Hl + K2Cr2O7 → 3l2↓ + 2Crl3 + 2Kl + 7H2O.
Иодоводород среди всех галогеноводородных соединений обладает наибольшей восстановительной активностью. Окислить его могут даже оксид и соли трёхвалентного железа. Не меньшей восстановительной активностью обладает сероводород H2S.
Для получения кислот электролизу подвергают растворы солей, образовавшиеся благодаря кислотному остатку. К примеру, электролиз раствора сульфата меди.
Химические свойства
Все существующие кислоты можно поделить на две категории: растворимые и нерастворимые. Некоторые из этих веществ могут самопроизвольно разлагаться и в водном растворе практически исчезают. Речь касается неустойчивых соединений. Эту тему подробно изучают на уроках химии в 8 классе. Все кислоты обладают определёнными физическими и химическими свойствами, которые нужно выучить для сдачи ЕГЭ:
- Многие виды кислот могут растворяться в воде, существенно повышая её кислотность. Для определения химического соединения в конкретном растворе используются специальные индикаторы: лакмусовая бумажка окрашивается в красный цвет.
- Кислоты взаимодействуют с атмосферными основаниями и оксидами, из-за чего образуется вода и соли. Из-за электролита такие реакции всегда проходят до конца. Растворению подвергаются многие оксиды.
- Кислоты могут вступать в реакцию с солями, но это только при условии образования газообразных либо малорастворимых веществ.
- Сильные кислоты взаимодействуют со щелочами. Реакция нейтрализации происходит на фоне того, что не только кислая, но и щелочная среда в сумме образуют нейтральную среду воды. Это интересная химическая реакция, которую можно записать следующим образом: Н + + ОН- → Н2О.
Кислоты взаимодействуют с металлами, но для этого должны быть соблюдены определённые условия. В процессе химической реакции образуется соль и выделяется водород. В категорию исключений входят только те ситуации, когда металлы взаимодействуют с H2SO4 и HNO3.
Сферы применения
Химические вещества используются практически во всех отраслях современной промышленности. Но в настоящее время минеральные и органические кислоты применяются в следующих сферах:
- Борная кислота (H3BO3). Получила большой спрос в медицине как надёжное антисептическое средство. H3BO3 используется при пайке различных металлов, это вещество также добавляют в удобрения и применяют для борьбы с тараканами.
- В домашних условия при выпечке сдобных изделий не обойтись без лимонной и уксусной кислот, их также используют для удаления накипи с кранов, чайников.
- Хорошо всем известная аскорбиновая кислота, которая также известна как витамин С, применяется при простудных заболеваниях.
- Серная кислота (H2SO4). Активно используется в химической промышленности. H2SO4 используется для производства эффективных минеральных удобрений, лакокрасочных материалов. Часто используется в пищевой промышленности (например, пищевая добавка Е513), а также в качестве электролита, когда речь касается производства аккумуляторных батарей.
- Специальная хромовая смесь (раствор двухромовокислого калия в H2SO4) применяется в лабораторных условиях для очистки химической посуды. Это вещество является сильным окислителем, благодаря чему помогает максимально быстро и качественно удалить следы загрязнения органическими веществами. Хромовая смесь также используется в органическом синтезе.
- Азотная кислота (HNO3). Благодаря своим уникальным свойствам получила спрос в производстве взрывчатых веществ. Именно HNO3 используют при производстве востребованных в сельскохозяйственной отрасли азотосодержащих удобрений (например, калиевая и аммиачная селитра), а также для изготовления медикаментозных средств («Нитроглицерин»).
При использовании любой из кислот нужно соблюдать правила безопасности, так как такие вещества могут нанести серьёзный вред здоровью.
В 8 классе на уроках химии даётся общая информация по кислотам. Но учащимся нужно запомнить, что это сложные соединения, в составе которых содержатся атомы водорода, замещающиеся атомами металлов и кислотных остатков. Изучаемые химические элементы наделены определёнными свойствами. Например, могут взаимодействовать с оксидами, солями и металлами.
http://infourok.ru/zadaniya-obuchayuschego-haraktera-po-teme-kisloti-klass-494090.html
http://nauka.club/khimiya/khimicheskie-svoystva-kislot.html