Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
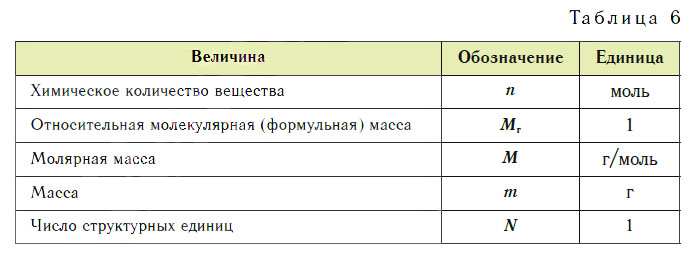
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Практические занятия № 1,2. Расчеты по химическим формулам и уравнениям
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б) оксида кальция (СаО)
в) гидроксида железа( III )( Fe ( OH ) 3 )
г) кремниевой кислоты ( H 2 SiO 3 )
д) фосфата натрия ( Na 3 PO 4 ).
1.2. Определение количества вещества по его массе:
а) азота ( N 2 ), масса которого 7 г
б) оксида натрия ( Na 2 O ), масса которого 3,1г
в) гидроксида кальция ( Ca ( OH ) 2 ), масса которого 3,7 г
г) серной кислоты ( H 2 SO 4 ), масса которой 4,9 г
д) нитрата серебра ( AgNO 3 ), масса которого 0,85 г
1.3. Определение количества вещества по его объему:
а) кислорода ( O 2 ), объем которого 2, 24 л
б) аммиака (Н 3 N ), объем которого 448 л
в) диоксида углерода (СО 2 ), объем которого 6,72л
г) метана (СН 4 ), объем которого 4,48 л
д) сероводорода (Н 2 S ), объем которого 3,36 л.
1.4. Определение относительной плотности одного газа по другому:
a ) диоксида серы ( S О 2 ) по водороду (Н 2 );
6) аммиака ( NH 3 ) по кислороду (О 2 );
в) метана (СН 4 ) по азоту ( N 2 );
г) этана ( С 2 Н 4 ) по воздуху ( M(возд.) = 29 г/моль );
д) ацетилена (С 2 Н 2 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде натрия ( NaOH ).
2.1 . Определите массу нитрата серебра (AgNO 3 ), необходимого для получения осадка массой 28,7 г хлорида серебра (AgCl) при взаимодействии с избытком хлороводородной (соляной) кислоты (HCl).
2.2. Какой объем газа (Н 2 ) выделится (при н.у.) при взаимодействии 5,4 г алюминия ( Al ) с избытком раствора серной кислоты ( H 2 SO 4 ).
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 A ( O ) = 2 
б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 


г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 ) = 2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции):
ν : 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям.
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б ) оксида магн ия ( Mg О)
в) гидроксида алюминия ( Al ( OH ) 3 )
г) угольной кислоты ( H 2 CO 3 )
д) нитрата железа ( III ) ( Fe ( NO 3 ) 3 ).
1.2. Определение количества вещества по его массе:
а) брома ( Br 2 ), масса которого 20 г
б) сероводорода (Н 2 S ), масса которого 3,4 г
в) гидроксида бария ( Ba ( OH ) 2 ), масса которого 1,71 г
г) азотной кислоты ( HNO 3 ), масса которой 1,26 г
д) сульфита калия (К 2 S О 3 ), масса которого 7,9 г
1.3. Определение количества вещества по его объему:
а) азота ( N 2 ), объем которого 33,6 л
б) водяного пара (Н 2 О), объем которого 16,8 л
в) диоксида серы ( SO 2 ), объем которого 1,12 л
г) ацетилена (С 2 Н 2 ), объем которого 168 л
д) метаналя ( CH 2 O ), объем которого 5,6 л.
1.4. Определение относительной плотности одного газа по другому:
а) оксида углерода ( II ) ( СО) по водороду (Н 2 );
б) диоксида азота ( N 0 2 ) по кислороду (О 2 );
г) этаналя ( С 2 Н 4 O ) по воздуху ( M(возд.) = 29 г/моль );
д) триоксида серы (SO 3 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде лития ( LiOH ).
2.1. Какая масса хлорида бария требуется для превращения 19,6 г серной кислоты в сульфат бария?
2.2. Какой объем оксида серы (IV) выделится (при н.у.) при взаимодействии 25,2 г сульфита натрия с избытком хлороводородной (соляной) кислоты?
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 

б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 



г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 )=2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции): Х г 19,6 г
ν: 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Ответы на задания 1 — го варианта:
1. 1 а) M (Н 2 ) = 2 

б) M ( CaO ) = А( Ca ) + A ( O ) = 40 + 16 = 56 г/моль;
в) M ( Fe ( OH ) 3 ) = А( Fe ) + 3 

г) M ( H 2 SiO 3 ) = 2 



д ) M (Na 3 PO 4 ) = 3 



1.2. а) M ( N 2 ) = 2 

ν ( N 2 ) = 

б) M ( Na 2 O ) = 2 

ν ( Na 2 O ) = 

в) M ( C а(ОН) 2 ) = A ( Ca ) + 2 

ν ( Ca ( OH ) 2 ) = 

г ) M(H 2 SO 4 )= 2 



ν ( H 2 SO 4 ) = 

д ) M(AgNO 3 ) = A(Ag) + A(N) + 3 

ν ( AgNO 3 ) = 

1.3. а) ν ( O 2 ) = 

б) ν ( NH 3 ) = 

в) ν ( CO 2 ) = 

г) ν ( CH 4 ) = 

д) ν ( H 2 S ) = 

1.4. а ) D H2 (SO 2 ) = 

б ) D O2 (H 3 N) = 

в) D N 2 ( CH 4 ) = 

г) D возд ( C 2 H 4 ) = 

д ) D Cl2 (C 2 H 2 ) = 

1.5. M(N аОН ) = A(Na) + A (O) + A(H) = 23 + 16 +1 = 40 г / моль .,
W(Na) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (57,5 %+ 40 %) = 2,5 %.
Ответ : W(Na) = 57,5 %; W(O) = 40 %; W(H) = 2,5 %.
ν : 1 моль 1 моль
M : 170 г/моль 143,5г/моль
m : 170 г 143,5 г
х = m ( AgNO 3 ) = 170 
ν : 2 моль 3 моль
M : 27 г/моль V m 22,4 л/моль
m : 54 г V 67,2 л
Х = V ( H 2) = 5,4 
Ответы на задания 2 — го варианта:
1.1 а) M ( N 2 ) = 2 

б) M ( MgO ) = А( Mg ) + A ( O ) = 24 + 16 = 40 г/моль;
в) M ( Al ( OH ) 3 ) = А( Al ) + 3 

г) M ( H 2 CO 3 ) = 2 



д ) M (Fe(NO 3 ) 3 ) = A(Fe) + 3 



1.2. а) M ( Br 2 ) = 2 

ν ( Br 2 ) = 

б ) M (H 2 S) = 2 

ν ( H 2 S ) = 

в ) M(B а ( ОН ) 2 ) = A(Ba) + 2 

ν (Ba(OH) 2 ) = 

г ) M(HNO 3 )= A(H) +A(N)+3 

ν ( HNO 3 ) = 

д ) M(K 2 SO 3 ) = 2 



ν ( K 2 SO 3 ) = 

1.3. а) ν ( N 2 ) = 

б) ν ( H 2 O ) = 

в) ν ( SO 2 ) = 

г) ν ( C 2 H 2 ) = 

д) ν ( CH 2 O ) = 

1.4. а) D H 2 (С O ) = 

б ) D O2 (NO 2 ) = 

в) D N 2 ( C 2 H 6 ) = 

г) D возд ( C 2 H 4 O ) = 

д ) D Cl2 (SO 3 ) = 

1.5. M(Li ОН ) = A(Li) + A (O) + A(H) = 7 + 16 +1 = 24 г / моль .,
W(Li) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (29,17 %+ 66,67 %) = 3,63 %.
Ответ : W(Na) = 29,17 %; W(O) = 66,67%; W(H) = 3,63 %.
ν : 1 моль 1 моль
M : 208 г/моль 98 г/моль
Х = m ( BaCl 2 ) = 208 
ν : 1 моль 1 моль
M : 126г/моль V m .22,4 л/моль
m : 126. г V 22,4 л
Х = V ( SO 2 ) = 25,2 
Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
http://infourok.ru/prakticheskie-zanyatiya-rascheti-po-himicheskim-formulam-i-uravneniyam-683079.html
http://urok.1sept.ru/articles/612236