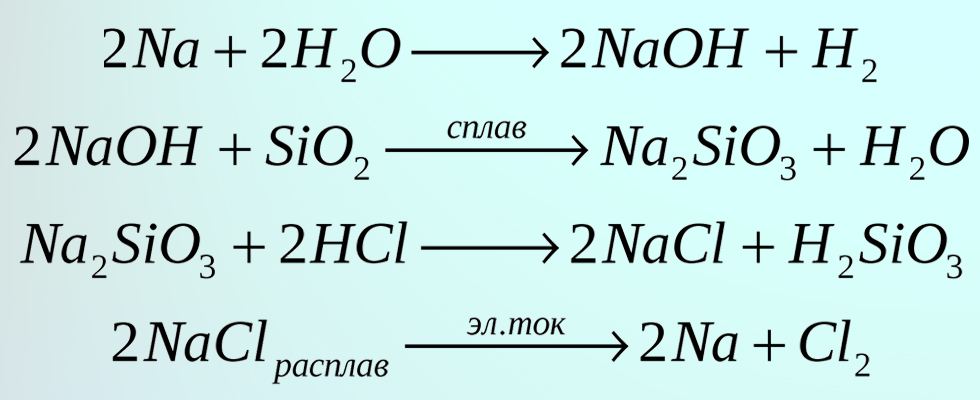урок 14. Уравнения химических реакций
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
— Слева запишем исходные вещества, справа — продукты реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
$\mathrm
— Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Число атомов каждого элемента до реакции должно быть равно числу атомов этих же элементов после реакции. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой СuО поставим коэффициент 2:
$\mathrm
— Теперь число атомов меди после реакции (в правой части) равно двум, а до реакции (в левой части) только одному, поэтому перед формулой меди Сu поставим коэффициент 2.
$\mathrm <2Cu+O_<2>\rightarrow 2CuO>$
— В результате произведенных действий число атомов каждого вида в левой и правой частях одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции.
Обратите внимание: если для протекания реакции требуется повышенная температура, то над знаком равенства нужно поставить значок t (данная реакция протекает при температуре t = 400 — 500 °C).
Это уравнение читается так: два купрум плюс о-два равно два купрум-о.
§17. Реакции соединения и разложения
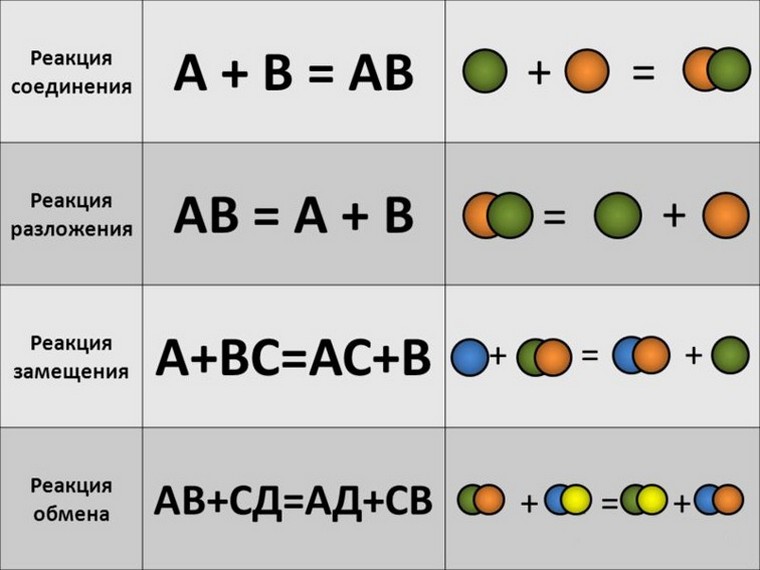
Выделяют 4 типа химических реакций:
1. Соединение (из нескольких веществ образуется одно более сложное)
2. Разложение (из одного сложного образуется несколько новых веществ)
3. Замещение (простое + сложное = простое + сложное)
4. Обмен (сложное + сложное = сложное + сложное)
РЕАКЦИИ СОЕДИНЕНИЯ
Рассмотрим уравнения следующих реакций:
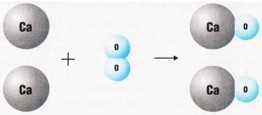
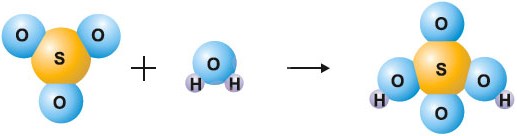
При взаимодействии двух веществ получается только одно вещество, такие реакции получили название реакций соединения.
В одних случаях из двух простых веществ получается одно сложное вещество, в других — происходят реакции, при которых соединяются два и более сложных веществ. Например:
Схема реакции соединения оксида серы(VI) с водой
РЕАКЦИИ РАЗЛОЖЕНИЯ
Рассмотрим уравнения следующих реакций:
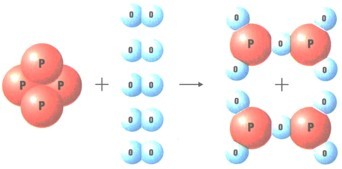
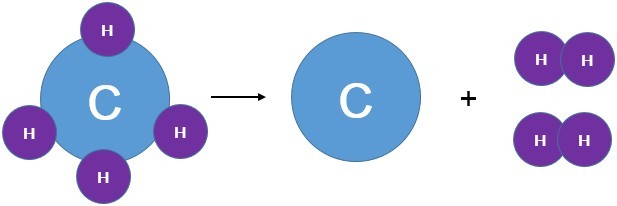
Можно заметить, что из одного сложного вещества получаются два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества, их может быть два и более.
Реакции разложения — это реакции, при которых из одного сложного вещества образуется несколько новых веществ.
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, реакция разложения метана СН4 — составной части природного газа:
реакция разложения метана
Пример реакции разложения.
Оранжевые кристаллы — кристаллы дихромата аммония. Горящая лучинка вызывает бурную реакцию. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция.
Окислитель — хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду: мы наблюдаем реакцию разложения соли. Реакция началась от горящей лучинки, но не прекратилась, когда лучинку убрали, а стала еще интенсивней. Дело в том, что в процессе реакции выделяется теплота, и начавшись от лучинки, процесс лавинообразно развивается до тех пор, пока вся масса дихромата не превратится в оксид хрома (III), азот и воду. Оксид хрома – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
§ 14. Составление уравнений химических реакций
1. Что обозначает схема химической реакции? Чем она отличается от уравнения химической реакции?
Уравнение химической реакции – это условная запись реакции с помощью химических формул и знаков «+», «-», «=».
Схема показывает только формулы исходных и конечных веществ. Между ними ставят стрелку, не расставляют коэффициенты.
2. Почему число атомов каждого элемента в обеих частях химического уравнения должно быть одинаковым?
Составление химических уравнений основано на законе сохранения массы веществ при химических реакциях.
3. Какие из приведенных записей представляют собой схемы химических реакций, а какие — уравнения:
Схемы химических реакция – б, г; уравнения – а, в.
4. Перечислите основные действия, которые необходимо выполнить, чтобы составить уравнение химической реакции.
1. составить формулы исходных и конечных веществ.
2. формулы исходных веществ записать слева, конечных справа.
3. уравнять числа атомов каждого элемента до и после реакции.
4. поставить знак «=».
5. Составьте уравнения химических реакций, приняв во внимание, что в образующихся веществах азот проявляет валентность три, а сера — два: а) магний + азот; б) калий + сера; в) алюминий + азот; г) алюминий + сера.
6. Составьте уравнения химических реакций:
7. Вместо знака вопроса запишите формулы веществ и составьте уравнения химических реакций:
а) HgO → Hg + ?; б) H2O→ O2 + ?; в) P + O2 →?; г) Ca + O2 = ?; д) Fe + ? →FeCl3; е) Al + S → ?.
8. Для остановки кровотечения и дезинфекции раны ее обрабатывают раствором вещества Н2О2 (т. н. перекиси водорода). При контакте с кровью оно превращается в два новых вещества — Н2О и О2. Напишите уравнение соответствующей реакции.
9. Перечислите важнейшие химические реакции, протекающие в: а) природе; б) живых организмах; в) быту; г) промышленности.
а) образование озона при грозе, фотосинтез
б) расщепление питательных веществе с целью получения энергии, пищеварение, свёртываемость крови
в) приготовление творога, брожение сока, горение угля, прокисание молока
г) получение металлов из руд, переработка отходов, получение удобрений
http://chem.virtuallab.by/publ/7_klass/17_urok_reakcii_soedinenija_i_razlozhenija/29-1-0-32
http://superresheba.by/resh/54749