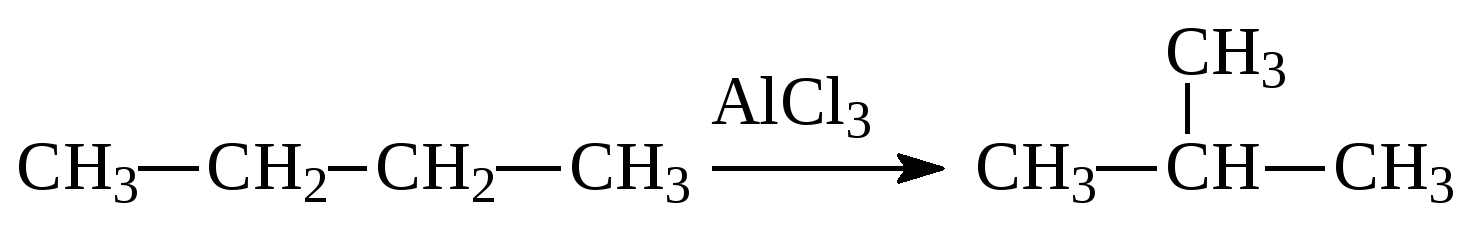«Химические реакции» (11 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема курса «Методическая разработка урока по химии
в 11 классе в контексте подготовки к ЕГЭ»
Семинар по теме «Химические реакции».
Цели: систематизация, обобщение и контроль по теме «Химические реакции»
Форма обучения: семинар ( коллоквиум )
1. Развитие аналитических способностей, умения обобщения и формулирования выводов;
2. Приобретение навыков использования научных знаний в практической деятельности;
3. Развитие навыков оперирования формулировками, понятиями, определениями.
Для проведения обобщающего урока по теме «Химические реакции» использовалась форма обучения — семинар. Семинар — это такая форма организации обучения, при которой на этапе подготовки доминирует самостоятельная работа учащихся с учебной литературой и другими дидактическими средствами над серией вопросов, проблем и задач, а в процессе семинара идут активное обсуждение, дискуссии и выступления учащихся, где они под руководством учителя делают обобщающие выводы и заключения[2].
Среди всех методов обучения, используемых при обучении химии, я выбрала частично – поисковый метод . При использовании частично-поискового метода знания учащихся более осознанные, развивается умение лучше наблюдать, пользоваться большим числом умственных операций, среди которых видную роль играют мыслительные действия высокого уровня [3].
Этапы занятия (80 мин)
1.Организационный момент- 2 мин.
(Подготовить учащихся к уроку, объявить цели и задачи урока). одготовить учащихся к уроку, объявить цели и 3) мультимедийный проектор.
2. Теоретическая часть — 20 мин.
3. Обсуждение основных вопросов — 8 мин.
4. Практическая часть (решение задач и упражнений) — 25 мин.
5. Контроль знаний -15 мин.
6. Заключительная часть.- 5 мин.
7. Подведение итогов -5 мин.
1. Теоретическая часть. Вопросы были заданы за две недели до проведения семинарского занятия.
1. Классификация химических реакций.
2. Скорость химических реакций.
3. Химическое равновесие и его смещение.
4. Электролитическая диссоциация
1. Организационный момент. (Подготовить учащихся к уроку, объявить цели и задачи урока). одготовить учащихся к уроку, объявить цели и 3) мультимедийный проектор.
Класс распределяется на группы по количеству вопросов, обсуждаемых на семинаре.
2. Теоретическая часть. [1].
1 группа готовит и выступает по теме «Классификация химических реакций».
Химические реакции – это явления, при которых из одних веществ получаются другие. В процессе изучения химии приходилось встречаться с классификациями химических реакций по различным признакам.
По тепловому эффекту
Экзотермические – протекают с выделением энергии
Эндотермические – протекают с поглощением энергии
Cu(OH) 2 

По числу и составу исходных и образовавшихся веществ
Реакции разложения – из одного сложного вещества образуется несколько более простых:
СаСО 3 
Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное: 2 H 2 + О 2 → 2 H 2 O ; C 2 H 4 + H 2 → C 2 H 6
Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе:
Zn + 2 HCl = ZnCl 2 + H 2 ↑ CH 4 + Cl 2 → CH 3 Cl + HCl
Реакции обмена – два сложных вещества обмениваются составными частями:
AgNO 3 + HCl = AgCl ↓ + HNO 3;
По агрегатному состоянию реагирующих веществ
Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях:
Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии:
По наличию катализатора
Каталитические 2 H 2 O 2 
C 2 H 4 + H 2 
Некаталитические S + О 2 
Необратимые – протекают в данных условиях только в одном направлении:
Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях:
По изменению степени окисления атомов элементов
Окислительно-восстановительные – реакции, идущие с изменением степени окисления:
Fe 0 + 2H +1 Cl -1 → Fe 2+ Cl 2 -1 + H 2 0 H +1 C 0 O -2 H +1 + H 2 → C -2 H 3 +1 O -2
Неокислительно-восстановительные – реакции, идущие без изменения степени окисления:
2группа готовит и выступает по теме «Скорость химических реакций».
Химические реакции протекают с разными скоростями. Очень быстро проходят реакции в водных растворах практически мгновенно. Смешаем растворы хлориды бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно горят сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики
науки о закономерностях протекания химических реакций во времени.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа н концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в гетерогенных реакций.
3 группа рассказывает про химическое равновесие и способах его смещения.
В обратимых процессах скорость прямой реакции вначале максимальна, а затем уменьшается из-за того, что уменьшаются концентрации исходных веществ, расходуемых ив образование продуктов реакции. Наоборот, скорость обратной реакции, минимальная в начале, увеличивается, но мере увеличения концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Состояние химического обратимого процесса называется химическим равновесием, если при этом скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие является динамичным (подвижным), так как при его наступлении реакция не прекращается, неизменными остаются лишь концентрации компонентов, то есть ля единицу времени образуется такое же количество продуктов реакции, какое превращается в исходные вещества. При постоянных температуре и давлении равновесие обратимое реакции может сохраняться неопределенно долгое время.
Французский химикЛеШателье в 1885 г. вывел, a немецкий физик Фердинанд Браун в 1887 г. обосновал общий закон смещения химического равновесия в зависимости ОТ внешних факторов, который известен пол названием принципа ЛеШателье.
Если изменить одно из условий — температуру, давление или концентрацию веществ — при которых данная система находится в состоянии химического равновесия, то равновесие сместится в направлении, которое препятствует этому изменению.
Этот принцип можно было бы назвать принципом «делай наоборот и добьешься своего».
4 группа выступает по теме «Электролитическая диссоциация».
В первой половине XIX в. М. Фарадей ввел понятие об электролитах и неэлектролиты. Электролитами он назвал вещества, водные растворы которых проводят электрический ток), а неэлектролитами — вещества, водные растворы которых не проводят электрический ток.
Для объяснения свойств водных растворов электролитов шведский ученый С. Аррениус (1859—1927) в 1887 г. предложил теорию электролитической диссоциации.
Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс назвали электролитической диссоциацией. Растворы веществ тогда становятся проводниками электрического тока, когда они содержат ионы (положительно или отрицательно заряженные частицы), которые в электрическом поле приходят в направленное движение.
Сильные электролиты — это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ноны. К сильным электролитам относятся почти все соли, неорганические кислоты, щелочи.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. К слабым электролитам относятся: многие неорганические кислоты , органические кислоты, основания (за исключением щелочей), гидрат аммиака , некоторые соли.
5группа готовит и выступает по теме «Гидролиз».
Гидролиз — это реакция обменного разложения веществ водой.
Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н- или ОН+ и распор соли становится кислотным или щелочным соответственно.
Любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей .
I. Соли, образованные сильным основанием и слабой кислотой
2. Соли, образованные сильной кислотой и слабым основанием.
3. Соли, образованные слабым основанием и слабой кислотой.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами.
3. Обсуждение основных вопросов.Вгруппах происходит обсуждение и обобщение изученного материала. Ребята отвечают на вопросы по каждому разделу темы «Химические реакции» (вопросы также заранее были приведены).
4. Практическая часть. Данная часть включает в себя упражнения и задачи в форме тестов.
П р и м е р 1. Взаимодействие растворов сульфата калия и хлорида бария относится к реакциям:
1) замещения; 2) нейтрализации;
3) ионного обмена; 4) соединения.
Поскольку исходные вещества являются электролитами, определить верный ответ несложно. Правильный ответ – 3.
П р и м е р 2. Взаимодействие между глицерином и высшимикарбоновыми кислотами относится к реакциям:
1) изомеризации; 2) дегидрирования;
3) нейтрализации; 4) этерификации.
Сразу исключается ответ 1, т.к. в условии даны два исходных вещества. Реакция дегидрирования (отщепления водорода) по этой жепричине не удовлетворяет требованиям задания. Реакция нейтрализации – реакция между сильной кислотой и щелочью, но ни первое, ни второе исходные вещества не являются таковыми. Правильныйответ – 4.
П р и м е р 3. К экзотермическим реакциям не относится взаимодействие:
1) оксида натрия с водой;
2) фосфора с кислородом;
3) оксида фосфора с водой;
4) азота с кислородом.
Все указанные в условии задания относятся к реакциям соединения, которые, как правило, являются экзотермическими реакциями, т.е. протекают с выделением теплоты. Одно из немногих
исключений – взаимодействие азота с кислородом. Правильныйответ – 4.
П р и м е р 4. Верны ли следующие суждения применительно к реакции синтеза аммиака?
А) Это реакция соединения, гомогенная, каталитическая.
Б) Это реакция окислительно-восстановительная, обратимая,
1) Верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
Верный ответ – 3. К такому выводу позволяет прийти запись уравнения реакции:
N2 + 3H2 ←.→кат 2NH3 + Q .
П р и м е р 5. К реакциям замещения и соединения относятся
1) оксид алюминия + соляная кислота и оксид железа(III) + алюминий;
2) алюминий + хлорид меди(II) и алюминий + хлор;
3) гидроксид алюминия + серная кислота и алюминий + кислород;
4) сульфат алюминия + хлорид бария и алюминий + йод.
Поскольку по условию задания первой в верном ответе должнабыть реакция замещения (взаимодействие простого и сложного веществ), то определить верный ответ не составит труда. Это – ответ 2.
Остальные варианты ответов можно не анализировать.
П р и м е р 6. К реакциям обмена и замещения соответственно
1) азотной кислоты с оксидом меди(II) и гидроксида кальция с оксидом углерода(IV);
2) этина с бромом и серной кислоты с оксидом магния;
3) соляной кислоты с гидроксидом железа(III) и метана с хлором;
4) фенола с натрием и фенола с гидроксидом натрия.
Достаточно сложное задание, т.к. требует знаний не только классификации химических реакций, но и номенклатуры органическихи неорганических соединений. Однако его можно выполнить бы-
стро на основании логики и знания о том, что реакция замещения –это, как правило, взаимодействие простого и сложного веществ. По условию задания эта реакция должна быть предложена вусловиях ответа второй. Правильный ответ – 3.
П р и м е р 7. Верны ли следующие суждения?
А) При сливании растворов карбоната натрия и хлорида алюминия выделяется газ и выпадает осадок.
Б) При сливании растворов карбоната натрия и хлорида бария
выделяется газ и выпадает осадок.
1) Верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
В результате обменной реакции между карбонатом натрия и хлоридом алюминия образуется карбонат алюминия, который в присутствии воды сразу необратимо гидролизуется с образованием нерастворимого в воде гидроксида алюминия и выделением углекислого газа, т.е. первое суждениеправильное. Реакция обмена между растворами хлорида бария и карбоната натрия приводит к образованию труднорастворимого карбоната бария, не подвергающегося гидролизу. Никакого газа при этом не выделяется, т.е. второе суждение неверно. Правильный ответ – 1.
П р и м е р 8. Установите соответствие между формулами двух солей и способностью к гидролизу соответственно.
Формулы солей Способность к гидролизу
А) Na2CO3, NaCl; 1) Гидролиз по катиону, гидролиз по аниону;
Б) CuSO4, K2S; 2) гидролиз по аниону, не гидролизуется;
В) LiNO3, Na2SiO3; 3) гидролиз по катиону, не гидролизуется;
Г) KCN, AlCl3. 4) гидролиз по аниону, гидролиз по катиону;
5) не гидролизуется, гидролиз по катиону;
6) не гидролизуется, гидролиз по аниону.
Выполнять задание рекомендуется, разбив левый столбик на дваподстолбика. Зная, по какому иону гидролизуются соли различноготипа, по формуле первого вещества из пáры отбирают возможные
варианты ответов из правого столбика, по формуле второй соли выбирают единственно верный из этих вариантов. Например, для первойпары: гидролиз карбоната натрия протекает по аниону (соответствияА–2, А–4), хлорид натрия не гидролизуется (остается соответствиеА–2). Правильный ответ – 2164.
П р и м е р 9. Установите соответствие между формулами двух
солей и реакцией среды их растворов соответственно.
Формулы солей Реакция среды
А) K2SO4, Na2SO3; 1) Кислая, щелочная;
Б) CH3COONa, KNO2; 2) нейтральная, кислая;
В) LiNO3, ZnCl2; 3) нейтральная, щелочная;
Г) (NH4)2SO4, C17H35COOK. 4) щелочная, щелочная;
5) кислая, кислая;
6) щелочная, кислая.
Выполнять задание рекомендуется, разбив левый столбик надва подстолбика. На основании анализа состава первой соли изпáры и реакции среды в ее растворе отбирают возможные варианты
ответов из правого столбика, по формуле второй соли выбираютединственно верный из этих вариантов. Например, для первойпары: сульфат калия образован сильной кислотой и сильным
основанием, реакция среды – нейтральная (соответствия А–2,А–3), сульфит натрия образован сильным основанием и кислотойсредней силы, среда раствора – щелочная (остается соответствие
А–3).Правильный ответ – 3421.
П р и м е р 10. Для пропана возможны реакции:
Пропан – предельный углеводород, следовательно, реакции присоединения (варианты 1, 2) и полимеризации (вариант 4) для негонехарактерны. Правильный ответ – 356.
5. Контроль знаний. ( Можно предложить взять подобные задания из сборников по подготовке к ЕГЭ).
6. Заключительная часть.
Успех всего семинара и особенно на этапе его подготовки во многом зависит от эффективности самостоятельной работы учащихся.
Для более глубокого изучения темы были заранее подготовлены теоретические вопросы и практические задания. На уроке был рассмотрен достаточно большой объем материала, который в ходе обсуждения был систематизирован и обобщен.Для подготовки точного и полного ответа на семинарском занятии ребятам пришлось серьезно и основательно подготовится. Учащиеся серьезно подошли к подготовке и проведению семинара. Именно такая форма работы способствовала созданию условийдля организации дискуссий, индивидуальной и коллективной работы учащихся, повышению уровня их осмысления и обобщения изученного материала.
7. Подведение итогов (рефлексия). Ребята обсудили итоги семинара (что получилось, а что нет) и самостоятельно оценили свои выступления в группах. Учитель проанализировал ответы всех участников, уровень их подготовки и участия в семинаре и подвел общий итог.
Список используемой литературы
1.Габриелян О.С. Химия. 11 класс. Пособие для общеобразовательныхучреждений — 2-е изд. – М.: Дрофа,2002. – 375 с.
2. Громов Е.В. Методика организации реферативного обучения на семинарских занятиях. — М.: 2001. – 325 с.
3. Педагогический словарь./ под ред. Каирова И.А. – М.: АПН РСФСР, 1960. – Т. 1 – 774 с., Т. 2 – 766с.
Анализ проведенного занятия.
— Мне удалось достичь поставленных целей и задач.
— При проведении занятия у учащихся возникли проблемы в усвоении содержания учебного материала. Причиной возникших трудностей и проблем оказалось, что не все учащиеся хорошо разобрались в изучаемой темеи мне как, учителю пришлось немного корректировать ход проведения семинара.
— Основную концепцию занятия я бы оставила, но добавила задания на творческое развитие учащихся, так например, дала бы им попробовать самостоятельно составить подобные тесты и упражнения и прорешать их всем вместе.
Урок химии в 11-м классе по теме «Составление уравнений окислительно-восстановительных реакций различными способами»
Разделы: Химия
Цели урока:
- углубить знания по составлению уравнений ОВР методом электронного баланса;
- изучить ионно-электронный метод составлению уравнений ОВР, показать его преимущества в формировании умений прогнозирования направления протекания ОВР в растворах.
- закрепить умения по составлению уравнений ОВР, протекающих в различных средах;
Познакомить учащихся ещё с одним способом составления уравнений ОВР.
Оборудование и реактивы:
Тип урока: усвоение новых знаний с применением имеющихся знаний и умений с последующим обобщением и систематизацией.
Методы.
План урока.
1. Актуализация знаний.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. С ними связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов. С их помощью получают щёлочи, кислоты и другие ценные продукты. Они лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу 20-го века была создана электронная теория окислительно-восстановительных процессов.
Повторение основных теоретических понятий темы: ОВР, окислители, восстановители, процессы окисления и восстановления. (Слайд 4). Презентация
Какие химические реакции относятся к окислительно-восстановительным, мы узнали в 8 классе, тогда же научились составлять уравнения этих реакций методом электронного баланса. В последствии, в 9 и 10 классе, мы отмечали, что в любой ОВР один из участников – восстановитель отдает электроны, окисляется, то есть повышает свою степень окисления, а другой – окислитель принимает электроны, восстанавливается, то есть понижает степень окисления. Поэтому, если оба её участника находятся в высшей (окислители: КМn +7 О4 + HN +5 O3) или низшей степени окисления (восстановители: H2S -2 + HCl -1 ), то реакция невозможна.. Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна (HCl -1 + HN +5 O3—>).
Поэтому, прежде чем написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
- Возможна ли в принципе ОВР между данными веществами?
- Если да, то установить продукты реакции.
- Подобрать коэффициенты в уравнении реакции.
Задание №1. Определите, возможна ли в принципе ОВР между данными веществами? Если да, то определите восстановитель и окислитель в реакции. (Слайд 5)
Выполнение лабораторных опытов.
Вывод после проведения опытов: к ОВР обязательно относятся все реакции замещения и реакции, в которых присутствуют простые вещества.
2. Составление уравнений ОВР методом электронного баланса, его недостатки.
Метод электронного баланса основан на сравнении степеней окисления в исходных и конечных веществах, когда известны все исходные вещества и продукты реакции. (Слайд 6) Этот метод хорошо знают и используют все учащиеся при расстановке коэффициентов. И данным методом действительно удобно пользоваться и в неорганической и органической химии, конечно, если даны полные схемы реакций.
Алгоритм составления уравнений ОВР методом электронного баланса. (Приложение 1)
Работа у доски: (Слайд 7)
1. Записать схему реакции:
2. Определить, атомы, каких элементов изменяют степень окисления:
3. Составить электронные уравнения процессов окисления и восстановления:
4. Умножить полученные электронные уравнения на наименьшие множители для установления баланса по электронам:
5. Перенести множители из электронных уравнений в молекулярное уравнение реакции:
6. Проверить выполнение закона сохранения массы (число атомов каждого элемента в левой и правой части уравнения должно быть одинаковым) и, если требуется, ввести новые или изменить полученные коэффициенты:
Вывод: Данным способом расстановки коэффициентов удобно пользоваться, если известны исходные вещества и продукты реакции, т.е. даны полные схемы реакций.
3. Ионно-электронный метод составления уравнений ОВР, его преимущества.
Если ОВР протекает в водных растворах и участники реакции не очевидны, то удобнее использовать метод электронно-ионного баланса (другое название – метод полуреакций). А именно такие схемы реакций, в которых не известны некоторые исходные вещества и продукты реакции, даны в заданиях С1 единого государственного экзамена. Сегодня мы познакомимся с особенностями протекания ОВР в водных растворах, научимся определять продукты реакции, используя специфический для таких реакций метод составления их уравнений. (Слайд 8).
Метод полуреакций, или ионно-электронный метод составления ОВР заключается в том, что для окислительных и восстановительных процессов в отдельности записываются уравнения полуреакций. Затем их уравнивают отдельно, умножают на коэффициенты, чтобы получить общее уравнение, в котором соблюдены законы сохранения массы и заряда, и складывают. Метод на первый взгляд кажется громоздким, но он имеет жесткий алгоритм исполнения, что удобно и полезно.
Алгоритм составления уравнения ОВР методом электронно-ионного баланса
- Составить перечень веществ и частиц, присутствующих в системе до начала реакции.
- Найти среди них окислитель и восстановитель; определить реакцию среды.
- Составить уравнение полуреакции окислителя.
- Составить уравнение полуреакции восстановителя.
- Уравнять число принятых и отданных электронов.
- Составить ионное уравнение.
- Составить молекулярное уравнение.
Составляя этим методом уравнений ОВР, необходимо учитывать следующие основные правила:
1) при составлении уравнений полуреакций можно использовать только те вещества и частицы, которые присутствуют в данной системе;
2) продуктами полуреакций могут быть только те вещества и частицы, которые устойчивы в данной системе;
3) при составлении уравнения полуреакции окислителя нельзя использовать частицы восстановителя и, наоборот, при составлении уравнения полуреакции восстановителя нельзя использовать частицы окислителя.
Рассмотрим взаимодействие дихромата калия К2Сг207 с соляной кислотой. (Работа у доски)
1. Запишим в левой части уравнения формулы исходных веществ.
Для создания в растворах кислой среды обычно пользуются серной кислотой. Соляная и азотная кислоты применяются редко, так как первая (НСl) способна окисляться, а вторая (НNО3) сама — сильный окислитель.
2. Определим окислитель и восстановитель.
Ион Сг207 2- , содержащий хром в его высшей степени окисления, может быть только окислителем. В кислой среде степень окисления хрома понижается — он восстанавливается в Сг 3+ . Ионы С1 — могут только окисляться – он восстановитель.
3. Составим схемы электронно-ионных уравнений полуреакций для процессов окисления и восстановления.
Полуреакция окисления: 2СГ — 2е = С12.
Полурсакция восстановления. Начинать подбор ее коэффициентов следует с уравнивания числа атомов элемента, который меняет свою степень окисления, в данном случае — хрома: Сг207 2- —> 2Сг 3+ .
4. Проверим число атомов кислорода в каждом уравнении полуреакции слева и справа и уравняйте их. Уравниваем число атомов кислорода. Они превращаются в молекулы воды, степень окисления кислорода в которых та же, что и в Сг207 2- . Для этого необходимо в левую часть добавить ионы Н + , которые заведомо имеются в растворе (среда кислая): Сг207 2- + 14Н + = 2Сг 3+ + 7Н20.
Одновременно с атомами кислорода при этом уравнивается и число атомов водорода.
5. Проверим число атомов каждого элемента в левой и правой частях схем уравнений окисления и восстановления.
6. Проверим равенство сумм зарядов до и после реакции, в соответствии с законом электронейтральности — суммарное число зарядов продуктов реакции должно быть равно
суммарному числу зарядов исходных веществ.
В нашей записи суммарный заряд всех ионов слева +12, а справа +6, поэтому для баланса нужно добавить в левую часть нашего выражения 6 электронов, каждый из которых несет заряд — 1. В результате получим уравнение: Сг207 2- + 14Н + + бе = 2Сг 3+ + 7Н20.
7. Подберем коэффициенты для окислителя и восстановителя согласно закону сохранения энергии (материи) — общее число электронов, отданных восстановителем и принятых окислителем, должно быть равным.
8. Суммируйте правые и левые части электронно-ионных уравнений, предварительно умножив соответствующие части на подобранные коэффициенты. Сг207 2 — + 14Н + + 6СГ = 2Cr 3+ + 7Н20 + ЗС12,
9. Сократим подобные члены в правой и левой частях уравнения.
10. Перепишем ионное уравнение.
11. По ионному уравнению составим молекулярное, для этого необходимо в правой и левой частях уравнения каждому аниону приписать соответствующее число катионов, а
каждому катиону приписать соответствующее число анионов. Скомпонуйте ионы в молекулы.
В данном случае источником ионов Сг207 2- была соль К2Сг207, поэтому с каждым молем Сг207 2- в раствор попадает 2 моль ионов К + . В реакции они участия не принимают, поэтому в неизмененном виде должны перейти в правую часть. Вместе с 14 моль ионов Н + в раствор вносится 14 моль ионов СГ. Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы К + , в неизмененном виде остаются после реакции, т. е. дописываются в правую часть. Проделав это, получим:
Сг207 2- + 14Н + + 6СГ + 2К + + 8С1 — = 2Сг 3+ + 7Н20 + ЗС12 + 2К + + 8С1 —
После этого можно объединить ионы в формулы реальных веществ:
Преимущества электронно-ионного метода:
1. Рассматриваются реально существующие ионы:
2. Не нужно знать все получающиеся вещества, они появляются при его выводе.
3. При использовании этого метода нет необходимости определять степени окисления атомов отдельных элементов, что особенно важно в случае ОВР, протекающих с участием органических соединений, для которых подчас очень сложно сделать это.
4. Этот метод дает не только сведения о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
5. Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
6. Видна роль среды как активного участника всего процесса.
Самостоятельная работа (15 мин.): (Слайды 11, 12, 13, 14)
Закрепление. Составьте уравнение одной из 2 предложенных ОВР ионно-электронным методом или методом электронного баланса.
(Анализ самостоятельной работы показал, что с работой справились все учащиеся, отдавая предпочтение ионно-электронному методу подбора продуктов реакции и коэффициентов).
Вывод: Если в ОВР не указаны продукты реакции, то удобнее использовать метод электронно-ионного баланса, который позволяет подобрать их, используя четкий алгоритм исполнения, что удобно и полезно.
Домашнее задание: (Слайд 15, 16)
Задание 2. Используя метод электронного баланса (или метод электронно-ионного баланса), составьте уравнения любых 3 реакций.
Определите окислитель и восстановитель.
Вывод по итогам занятия: Учащиеся проявляют повышенный интерес к данной теме, они осознают важность и необходимость владения рассмотренным материалом, понимают, что полученные знания помогут им успешно выполнить задания ЕГЭ.
Анализ самостоятельной работы показал, что с работой справились все учащиеся, отдавая предпочтение ионно-электронному методу подбора продуктов реакции и коэффициентов.
Химические реакции
Контрольная работа по химии для 11 класса по теме «Химические реакции»
Просмотр содержимого документа
«Химические реакции»
Контрольная работа №2 «Химические реакции»
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой:
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
1) N 0 2) H 0 3) H +1 4) N –3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость увеличится
1) в 3 раза 2) в 9 раз 3) в 27 раз 4) в 81 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции CaO(т)+CO2(г)↔CaCO3(т)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
А8. Наиболее сильной кислотой из перечисленных является:
А9. Осадок образуется при взаимодействии хлорида калия с:
А10. Гидролизу не подвергается:
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
http://urok.1sept.ru/articles/622215
http://multiurok.ru/files/khimicheskie-reaktsii-1.html