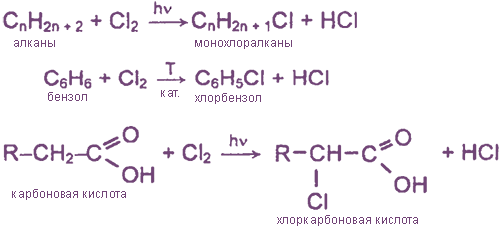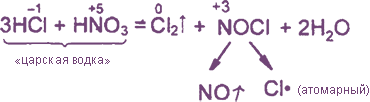Физические свойства
Cl2 при об. Т — газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха — в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Способы получения
Основаны на процессе окисления анионов Cl —
2Cl — — 2e — = Cl2 0
Промышленный
Электролиз водных растворов хлоридов, чаще — NaCl:
Лабораторные
Окисление конц. HCI различными окислителями:
Химические свойства
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl — :
Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl — , а другие в положительной степени окисления входят в состав анионов ClO — или ClO3 — .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Газообразный хлороводород
Физические и химические свойства
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Способы получения
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl — окисляется до свободного галогена:
2Cl — — 2e — = Cl2 0
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Химические свойства хлора
Межэлектронное отталкивание валентных электронов в атоме хлора заметно меньше, чем в атоме фтора, и лишний электрон не так сильно дестабилизирует систему, поэтому из всех атомов галогенов атом хлора обладает максимальным сродством к электрону.
Большая прочность молекул хлора по сравнению с молекулами фтора объясняется не только эффектом обратного экранирования в атоме фтора, приводящим к ослаблению связи в его молекулах. В молекулах хлора имеет место дополнительное π-связывание за счет p-электронов и d-атомной орбитали. π-связывание возникает по донорно-акцепторному механизму, когда каждый атом хлора одновременно является и донором и акцептором электронной пары (дативная связь). В рамках МВС дополнительное π-связывание можно представить схемой:
Здесь знаком σ показано возникновение основной σ-связи по обменному механизму, а стрелками – дополнительное π-связывание (неподеленная p-электронная пара одного атома хлора взаимодействует с d-АО другого). При этом происходит лишь частичный перенос электронной плотности на d-АО атома партнера и поэтому порядок связи менее 1,5.
Наличие 3d-АО атома хлора резко повышает валентные возможности и вариации его положительных степеней окисления. Теоретически максимальная ковалентность хлора может достигать 9 (9 АО при n=3). Однако практически наблюдаемая координационная валентность хлора не превышает 6. При взаимодействии атомов хлора между собой и с другими элементами хлор проявляет степени окисления -1, 0, +1, +3, +4, +5, +6, +7. Разнообразие валентных состояний и степеней окисления делают химию хлора во многих отношениях отличной от химии фтора. В то же время оба элемента – типичные неметаллы с ярко выраженными окислительными свойствами. Поэтому главное в химии этих элементов – функционирование в качестве анионообразователей в бинарных и более сложных соединениях.
В большинстве соединений хлор как сильно электроотрицательный элемент (ОЭО=3,0) выступает в отрицательной степени окисления -1. В соединениях же с более электроотрицательными фтором, кислородом и азотом он проявляет положительные степени окисления. Особенно разнообразны соединения хлора с кислородом, в которых хлор проявляет степени окисления +1, +3, +5, +7, а также +4 и +6.
Хлор – активный окислитель:
Он весьма энергично реагирует с металлами и большинством неметаллов (за исключением кислорода, азота, благородных газов, углерода), легко окисляет многие сложные соединения.
Так, расплавленный натрий сгорает в атмосфере хлора с ослепительной вспышкой. Подобным образом ведут себя многие металлы и неметаллы: медь, олово, порошок сурьмы, кристаллический фосфор, натрий…
2Na + Cl2 = 2NaCl, ΔH° = -822 кДж
2P + 3Cl2 = 2PCl3, ΔH° = -624 кДж
Фосфор, мышьяк, сурьма, кремний, натрий, калий и магний уже при низкой температуре реагируют с хлором с выделением большого количества теплоты.
Sb + 3/2Cl2 = SbCl3, ΔH° = -381,2 кДж
S + 2Cl2 = SCl4 (при нагревании)
Однако реакция с водородом при стандартных условиях заморожена. При повышенной температуре, сильном освещении (УФ) или электрическом разряде хлор взаимодействует с водородом со взрывом
H2 + Cl2 + hν = 2HCl, ΔH° = -184 кДж
Эта реакция протекает по цепному механизму:
Аналогично протекают реакции хлора с различными углеводородами.
Хлор взаимодействует с другими галогенами:
При этом в реакции со фтором хлор выступает в качестве восстановителя, а в остальных случаях в качестве окислителя.
Хлор способен окислять и сложные вещества:
Вода катализирует многие реакции с участием хлора. Например, хорошо осушенный хлор при стандартных условиях практически не реагирует со многими металлами, в частности с железом. Это позволяет хранить хлор в стальных баллонах.
Наиболее эффективным окислителем хлора в водной среде является сам хлор, вступающий при растворении в воде в реакцию диспропорционирования, для протекания которой наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов:
3Cl2 + 6OH – ↔ 5Cl – + ClO3 – + 3H2O (2), Kp = 7,5·10 15
Cl2 + 2OH – ↔ Cl – + ClO – + H2O (3)
Равновесие реакции (1) сдвинуто влево (Kp = 4,2·10 -4 ) поэтому молярная концентрация хлорноватистой кислоты при 20 °C достигает лишь 0,03 моль/л.
Растворение хлора в водном растворе щелочи (реакции 2 и 3) практически нацело смещает равновесие вправо. Состав образующихся при этом солей зависит от температуры.
Образующийся на первой стадии гипохлорит анион склонен к диспропорционированию:
3ClO – ↔ ClO3 – + 2Cl – (a)
4ClO – ↔ ClO4 – + 3Cl – (b)
2ClO – ↔ ClO2 – + Cl – (c)
Как показывает опыт, при комнатной и более низкой температуре скорость всех реакций диспропорционирования аниона ClO – низка. Поэтому реакция хлора с холодным (лучше охлаждаемым льдом) раствором гидроксида натрия или калия позволяет получить смесь хлорида натрия и гипохлорита натрия, хлорида калия и гипохлорита калия соответственно, называемых жавелевой водой, из которой можно выделить кристаллогидраты солей NaClO или KClO. Аналогичная реакция хлора с гидроксидом кальция дает смешанную соль CaCl(ClO) или CaCl2·Ca(ClO)2 и CaCl2·Ca(OH)2, называемой хлорной известью.
При нагревании до 70-80 °C, а тем более до кипения, реакция (a) протекает быстро, причем с большой скоростью, чем реакция (c), в то время как скорость реакции (b) остается очень низкой. Следовательно, реакция хлора с горячим раствором щелочи позволяет получать соли иона ClO3 – (например, KClO3 – бертолетова соль).
Хлор (Cl)
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название «хлорин», которое вскоре было сокращено до «хлор» с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название «галоген», но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре — на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору «по барабану» с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений — хлорофилла.
Природный хлор состоит из смеси двух изотопов:
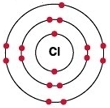
Рис. Строение атома хлора.
Электронная конфигурация атома хлора — 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора — этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой — кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор «охотно» вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде — водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде — натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://himgdz.ru/galogeni/himicheskie-svojstva-hlora/
http://prosto-o-slognom.ru/chimia/518_hlor_Cl.html