Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1c86c3ce7e4989 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Получение хлора в лаборатории и изучение его свойств
Презентация к уроку
Тип урока: комбинированный, с практической работой (урок рассчитан на 2 часа в профильной группе)
Цель урока: продолжить формирование знаний о неметаллах на примере хлора. Закрепить знания о окислительно-восстановительных реакциях на примере изучения свойств хлора. Подготовиться к выполнению задания № 37 ЕГЭ.
Задачи урока
Оборудование и реактивы:
- Прибор для проведения химических реакций (АПХР), состоящий из двугорлой круглодонной колбы; насадок; капельной воронки; стеклянных пробок; мерный цилиндр
- Оксид марганца(IV); концентрированная соляная кислота; раствор бромида натрия; раствор иодида калия; концентрированная серная кислота; раствор фенолфталеина; раствор щелочи; раствор сульфита натрия.
1. Актуализация знаний.
Сравните электронное строение атомов и ионов фтора и хлора. Задание выполняется двумя учениками у доски. Остальные ученики выполняют задание в тетради по вариантам.
Задание в парах: Сравните электронное строение атома и иона химического элемента.
- 1 ученик: фтора
- 2 ученик: хлора
Осуществите взаимопроверку. Два ученика в это время работают за закрытой доской и осле окончания работы результаты проверяют.
Почему у атома фтора проявляется только отрицательная степень окисления?
Объясните существование разных степеней окисления у хлора, исходя из их электронного строения. Составьте электронные формулы для атома хлора в разных степенях окисления.
Два ученика, используя интернет –источники подготавливают ответы на вопросы: ссылки: http://znaesh-kak.com/
Выступление учеников по вопросам:
1) Кем и при каких обстоятельствах открыт хлор?
2. Интересная информация о хлоре: 1) использование хлора в первой мировой войне; 2) отбеливающие свойства хлора;
2. Усвоение новых знаний.
2. 1. Получение хлора в лаборатории и изучение его химических свойств.
Вопрос: Какие будут предложения по получению хлора в лаборатории?
Возможный ответ: Электролизом растворов хлоридов щелочных металлов или раствора соляной кислоты.
Составляем схемы протекающих процессов у доски. Оцениваем целесообразность и возможность применения электролиза в лаборатории. Далее рассуждаем на тему, каким образом можно окислить хлорид-ион, не используя в качестве окислителя электрический ток? Чаще всего ученики называют несколько окислителей: бихромат калия, перманганат калия, диоксид марганца, и правильно предлагают окислить хлорид- ион в соляной кислоте до хлора.
Работа с презентацией.
Ученики получают задание: Изучите материалы презентации. Соберите прибор для получения хлора в лабораторных условиях по фото-инструкции, если исходными веществами являются концентрированная соляная кислота и оксид марганца (IV) (кристаллический). Используем прибор АПХР (прибор для проведения химических реакций). Вспоминаем, что хлор ядовит, следовательно, опыт будем проводить под тягой!
Посмотрите внимательно материалы презентации (Слайды № 1-10) и ответьте на вопросы в таблице № 1.
| Вопросы | Ответы | Почему? |
| 1. Где получать? | Под тягой | Ядовит |
| 2. Из чего? | НCl(конц) + МnO2 | Марганце, в степени окисления +4 окисляет хлорид-ион до свободного хлора. |
| 3. Что увидим? | выделение желто-зеленого газа | Хлор-зеленый. |
| 4. Как собираем? | Вытеснением воздуха из реакционной колбы, одновременно пропуская в реагирующие вещества; | Он тяжелее воздуха, заполняет объем колбы и поднимается по насадкам. |
| 5. Какой прибор используем? | АПХР | Жидкость удобно приливать к твердому веществу. |
| 6. Какие вещества наливаем в насадки? | 1) концентрированную серную кислоты |
2) раствор бромида натрия;
3) раствор иодида калия + раствор крахмального клейстера;
4) раствор гидроксида натрия с фенолфталеином
Изучение химических свойств хлора.
Проводим лабораторный опыт в группах в вытяжном шкафу и записываем наблюдения и заполняем таблицу № 2. Для проведения работы ученики делятся на 3 группы. Пока одна группа получает вещество в вытяжном шкафу, другие ученики работает самостоятельно, заполняя в рабочем листе, таблицу № 2.
Таблица 2. Уравнения химических реакций, проходящих при получении хлора
| Название опыта | Уравнения химических реакций | Наблюдения |
| Получение хлора. | MnO2+4HCl —> MnCl2+Cl2^+2H2O | Выделение желто-зеленого газа. |
| Замещение брома в бромиде. | 2 NaBr + Cl2 —>2 NaCl + Br2 | Образование бурого раствора бромной воды. |
| Замещение йода в иодиде. | 2 NaI + Cl2 —> 2 NaCl + I2 | Образование желтого раствора йодной воды. |
| Диспропорционирование хлора в щелочной среде | Сl2 + KOH(хол) —>KCl + KClO | Раствор фенолфталеина обесцвечивается. |
| Нейтрализация брома и йода сульфитом натрия | Na2SO3 + Br2 + 2NaOH —> 2 NaBr + Na2SO4 + H2O |
Na2SO3 + I2 + 2NaOH —> 2 NaI + Na2SO4 + H2O
2.2. Самостоятельная работа.
- Предложите другие способы получения хлора в лаборатории.
- Какие вещества еще можно окислять хлором. Составьте УХР.
Запишите их в рабочий лист.
Поменяйтесь рабочими листами и ответьте на вопросы друг друга (работа в парах).
Составьте уравнения предложенных химических реакции и расставьте коэффициенты методом окислительно-восстановительного баланса.
Осуществите взаимопроверку, используя слайды № 11,12.
3. Закрепление знаний. Подведение итогов урока.
Решение качественной задачи. (ЕГЭ № 37) Составьте уравнения описанных реакций.
1 вариант К кристаллическому перманганату калия добавили концентрированную соляную кислоту. Полученный газ пропустили над медью. Образовавшееся вещество растворили в воде и добавили раствор гидроксида натрия. Полученный осадок прокалили при этом образовалось вещество черного цвета.
2 вариант Оксид марганца (lV) прореагировал при нагревании с концентрированной соляной кислотой. Выделившийся газ пропустили через горячий раствор гидроксида калия. Полученный раствор разделили на две части. К одной части раствора добавили раствор нитрата серебра, в результате чего выпал белый осадок. К другой части раствора прилили раствор йодида натрия, образовалось темно-бурое вещество. Составьте уравнения четырёх описанных реакций.
Обязательно проводится проверка фронтально. Решение на доске записывается учителем.
1. Приведите оценку своих достижений на уроке:
А) работал, получил результат, результатом доволен;
Б) работал, но мог работать лучше;
В) старался, но было трудно, много не понял;
2. Оцените свое эмоциональное состояние:
А) комфортное; б) некомфортное;
3. Считаете ли вы, что урок был наглядным: а) да; б) нет
4. Считаете ли вы, что материал трудно воспринимается, т.к. опыты с получением хлора вы проводили самостоятельно?
Сдайте свои рабочие листы на проверку учителю.
Д/З: параграф 34 стр. 276 № 1-7 учебник для 11 кл. “Общая химия” О.С.Габриелян, И.Г.Остроумов, С.Н.Соловьев, Ф.Н.Маскаев
- Приложение 1
- Приложение 2
Хлор (Cl)
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название «хлорин», которое вскоре было сокращено до «хлор» с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название «галоген», но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре — на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору «по барабану» с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений — хлорофилла.
Природный хлор состоит из смеси двух изотопов:
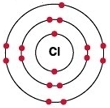
Рис. Строение атома хлора.
Электронная конфигурация атома хлора — 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора — этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой — кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор «охотно» вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде — водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде — натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://urok.1sept.ru/articles/661014
http://prosto-o-slognom.ru/chimia/518_hlor_Cl.html