Гидроксид цинка
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например , хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами .
Например , гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка взаимодействует с кислотными оксидами .
Например , гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом гидроксид цинка проявляет кислотные свойства.
Например , гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Практическая работа № 6(н). Получение, собирание и распознавание газов
Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответы:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.
Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответы:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.
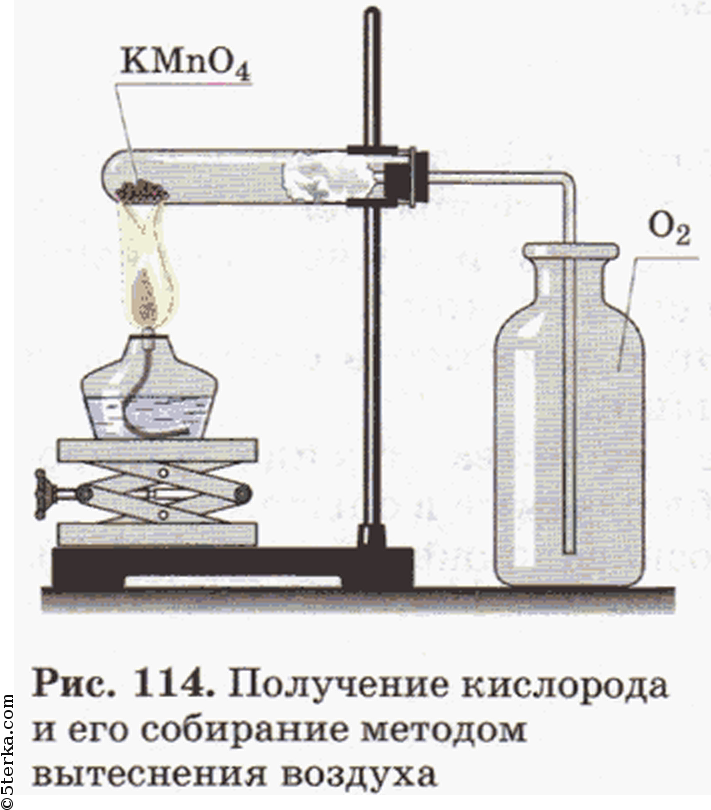
Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
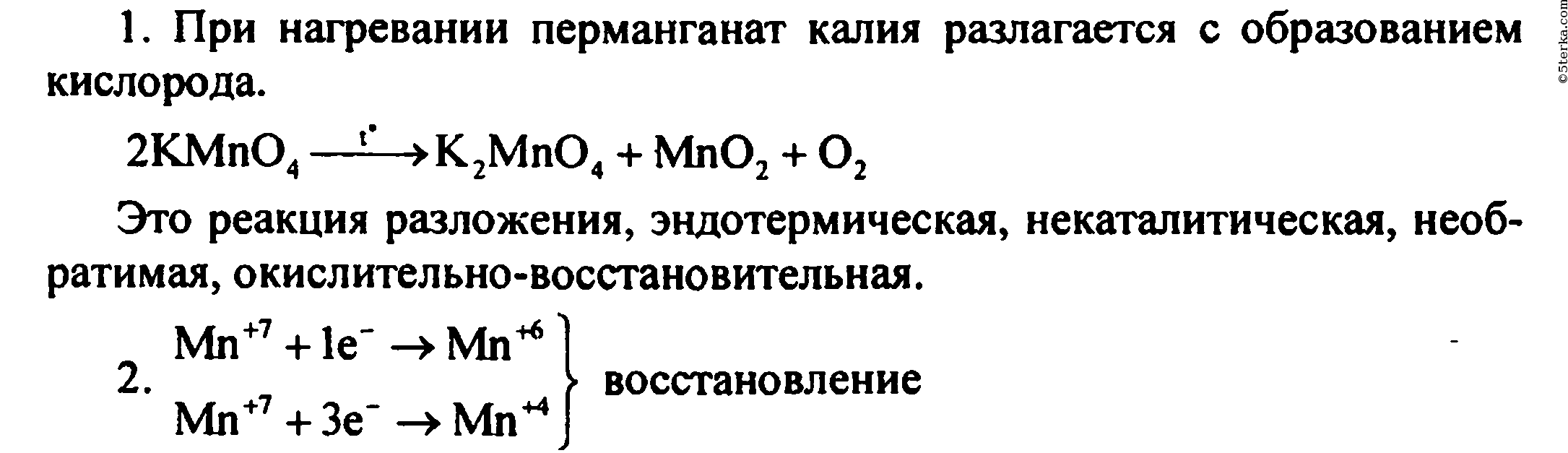
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответы:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.
Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответы:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.
Эта реакция является качественной на углекислый газ.

задача №6
к главе «Практические работы».
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e134afcfb8a426c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://5terka.com/node/10693
http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/prakt/6.html