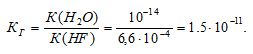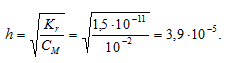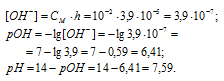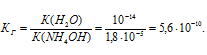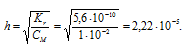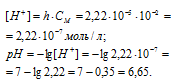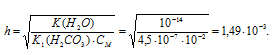Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Соли аммония
Презентация к уроку
Вид урока: урок с применением мультимедиа
Цели урока:
- Обучающие: Систематизировать знания учащихся о солях; формирование на межпредметном уровне системы знаний о солях аммония, имеющих огромное практическое значение.
- Развивающие: выработать практические навыки проведения качественных реакций на соли аммония; умение анализировать увиденное; развитие логического мышления; развитие познавательного интереса при выполнении теоретических и практических заданий.
- Воспитательные: Повышать познавательную деятельность и активность учащихся; воспитание умения работать в коллективе.
Оборудование и реактивы урока:
1. На столе учителя: раствор соляной кислоты HCl; гидроксид аммония NH4OH; хлорид аммония NH4 Cl; хлорид натрия NaCl; вода H2O; лакмус; фенолфталеин; бихромат аммония (NH4) 2Cr2O7.
2. На столе учащихся: сульфат аммония (NH4) 2SO4; серная кислота H2 SO4; хлорид бария BaCl; хлорид аммония NH4 Cl; гидроксид натрия NaOH;
Основные понятия: Катион аммония, соли аммония.
1. Организационный момент
Учитель проверяет готовности к уроку, сообщает тему урока.
2. Проверка опорных знаний (10 мин)
На учительском столе стоят в стеклянной таре вещества (соли).
Учитель: В этой таре находится удивительное вещество. Когда то оно считалось «милостью божьей», символом благополучия.
:. Но оно может и погубить живое, из за него даже море может стать мертвым.
Вмести с этим трудно перечислить, где бы оно ни применялось.
Что же находится в этой склянке?
(Предполагаемый ответ соль.)
Какие вещества мы относим к солям?
Из перечисленных веществ выберите соли и назовите их:
KCl NaOH KOH CO2 H2 SO4 Ba(NO3)2 CuSO4 MgO NH4 Cl H2 S AgNO3 (NH4) 2SO4
Учитель: Какие необычные соли вам встретились?
В составе этих солей находится сложный катион — катион аммония.
Учитель просит класс сформулировать понятие соли аммония (соли, состоящие из катионов аммония и анионов кислотного остатка).
Учитель: Как вы думаете, где могут применяться эти соли? Почему?
Учащиеся: В сельском хозяйстве, так как содержат жизненно важный элемент для растений — азот.
Для всесторонней характеристики практического значения солей аммония целесообразно заслушать мини доклад учащихся.
3. Изучение нового материала (15 мин)
Учитель: Изучим физические и химические свойства солей аммония на практике.
Что общего в физических свойствах солей и солей аммония?
Учащиеся: твердые, белые, кристаллические вещества, хорошо растворимы в воде, электролиты.
Учитель: Проверьте растворимость сульфата аммония на практике, запишите физические свойства в тетрадь (проведение эксперимента).
Учитель: Рассмотрим химические свойства солей аммония.
Вспомним общие свойства солей:
(В тетради составляется опорный конспект).
А) диссоциация — запишем уравнения диссоциации солей
- Хлорида аммония
- Сульфата аммония
Б) Взаимодействие с кислотами
2 NH4 Cl + H2 SO4 
Выполнить опыт, указать признаки реакции (проведение эксперимента).
В) Взаимодействие со щелочами.
В пробирку опускаем фенолфталеиновую бумагу и наблюдаем изменение окраски (проведение эксперимента)
Вывод: данная реакция является качественной на соли аммония
Г) Взаимодействие с солями
NH4 Cl + AgNO3 
Учащиеся проделывают эксперимент, записывают уравнение реакции и сверяют их самостоятельно с уравнением на слайде (проведение эксперимента).
Творческое задание: Определите, в какой из трех пробирок находится сульфат аммония. Запишите уравнения проделанных реакций (проведение эксперимента).
Специфические свойства солей:
Д) Разложение солей аммония
Демонстрационный опыт: разложения бихромата аммония; хлорида аммония:
NH4 Cl 

(NH4)2Сr2О7 
Е) Гидролиз солей аммония
NH4 Cl + H2О 
Вывод: среда щелочная, лакмус — синий, фенолфталеин — малиновый.
Учитель: Вспомните, какими способами можно получить соли.
Учащиеся: При взаимодействии основания и кислоты; соли и соли; соли и кислоты.
Учитель демонстрирует опыты, учащиеся записывают опорный конспект при помощи слайда.
А) NH4OH + HCl 
Б) (NH4) 2SO4 + BaCl2

В) (NH4) 2СO3 + 2HCl 
Вывод: при написании уравнений необходимо соблюдать условие необратимости химических реакций.
4. Закрепление пройденного материала (15 мин)
http://buzani.ru/zadachi/khimiya-glinka/1198-konstanta-gidroliza-soli-zadachi-537
http://urok.1sept.ru/articles/604238