Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты;
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Получение нитрата калия из хлорида калия и азотной кислоты или окислов азота
Этот способ, не нашедший пока широкого распространения в промышленности вследствие трудностей, связанных главным образом со значительной коррозией аппаратуры, представляет, однако, интерес, так как не требует затраты дефицитных щелочей и большого расхода пара 236-243.
Взаимодействие хлорида калия с азотной кислотой или окислами азота идет по следующим схемам:
Реакция (1) идет слева направо при сравнительно низких температурах (25—60°). Реакция (2) легко обратима, начинается при низких температурах; при 100° равновесие сдвинуто почти нацело в сторону NOC1 и С12.
Образованию хлористого нитрозила способствует повышение концентрации кислот в растворе. При большой концентрации кислот и высокой температуре давление паров НС1 и HN03 над раствором увеличивается, что приводит к образованию больших количеств хлористого нитрозила и хлора. При применении 30—40%-ной азотной кислоты и температуре ниже 60° потери азота в виде хлористого нитрозила невелики, и хлор накапливается в растворе в виде НС1. При охлаждении раствора из него выделяется значительная доля KN03, а маточный раствор может быть возвращен в цикл. В дальнейшем, при накоплении значительных количеств соляной кислоты, перед возвратом раствора в процесс необходимо’ отгонять из него часть хлористого водорода. Отгоняемые пары конденсируются в виде соляной кислоты.
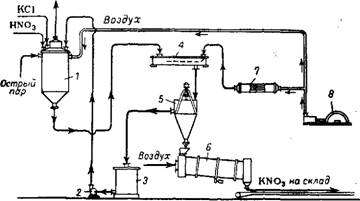
Нитрат калия можно получать из хлорида калия и азотной кислоты 224’251 и при повышенной температуре по схеме, изображенной на рис. 360. В стальной реактор 1, футерованный диабазовыми плитками, подают азотную кислоту, маточный раствор от предыдущей операции и загружают твердый хлорид калия. Реакционный раствор перемешивают сжатым воздухом и нагревают острым паром До 75—85°. Вначале реакция протекает бурно, затем замедляется. Образующиеся газы и водяные пары направляют воздушным
эжектором в абсорбер. С газами удаляется и часть хлористого водорода. По окончании реакции раствор, содержащий в среднем 520 г/л KN03, 35—65 г/л HN03 и 120—140 г/л HCI, поступает на кристаллизацию. Выделяющийся при охлаждении раствора до 25—30° нитрат калия отделяют на центрифуге 5, промывают и высушивают. Маточный раствор в смеси с промывными водами частично возвращают в реактор. Приблизительный состав возвращаемого раствора: 90—110 г/л KN03, 20—40 г/л HN03 и 70—80 г/л
Noc1 На переработку
Рис. 360. Схема получения нитрата калия из хлористого калия и азотной кислоты:
/ — реактор; 2 — центробежный насос; 3 —сборник маточных растворов;
4 — кристаллизатор; 5 — центрифуга; 6 — сушильный барабан; 7— холодильник для воздуха; 8 — компрессор.
НС1. Часть маточного раствора нейтрализуют раствором едкого кали и направляют на выпаривание (на схеме не показано), из выпаренного раствора кристаллизуют нитрат калия, который может быть использован в качестве продукта 3-то сорта.
Выход нитрата калия по азотной кислоте при использовании части маточного раствора составляет
70%. На производство 1 т Продукта расходуется только 4 т пара вместо 11 т по методу конверсии КС1 и NaN03.
Получение KN03 по реакции (1) можно осуществить с помощью жидких экстрагентов — бутилового, изоаминового спиртов и т. п. — с последующей их регенерацией 252.
Интересен метод получения KN03, основанный на осуществлении топохимической реакции между твердым хлоридом калия и газообразной или жидкой двуокисью азота:
Эта реакция каталитически ускоряется в присутствии ничтожных количеств воды и идет с большой скоростью при низких температурах (—10, —12°). Скорость реакции, лимитируемая скоростью диффузии, возрастает при применении тонкоизмельченного хлорида калия и при увеличении скорости жидкого или газового потока, омывающего твердые частицы.
Реакция с жидкой двуокисью азота может проводиться в автоклаве, а с газообразной — в шаровых или трубчатых мельницах.
Себестоимость калиевой селитры, полученной взаимодействием жидких окислов азота с хлоридом калия, должна быть приблизительно такой же, как при получении ее методом катионного обмена253’254. (Последний метод, однако, дает более чистый нитрат калия.)
Получение нитратов калия и натрия взаимодействием хлоридов с N02 или с азотной кислотой является одним из экономичных путей производства этих продуктов при условии использования хлора, выделяющегося в газовую фазу в виде С12, НС1 и NOC1. Особенно важно использование хлористого нитрозила, так как в противном случае потеря содержащегося в нем азота делает производство нерентабельным Хлористый нитрозил может быть окислен до N02 и С12 кислородом воздуха в присутствии концентрированной азотной кислоты или в присутствии катализаторов: МпОг, Fe203 и др. Хлористый нитрозил может быть использован также для хлорирования окислов и других веществ; освобождающаяся при этом N0 может быть переработана в азотную кислоту. Существуют и другие методы переработки хлористого нитрозила. В последнее время интерес к этому способу привлекает внимание еще и потому, что хлористый нитрозил, ранее не находивший применения, может быть использован для получения полупродуктов, применяемых в производстве полиамидных смол.
Разработаны также способы получения KN03 из КС1 и азотной кислоты без образования NOC1. Например, в среде расплавленного KN03 (или других солей) в отличие от водной среды, реакция идет согласно уравнению:
Вследствие того, что в систему с азотной кислотой вводится вода, точка плавления KN03 понижена и процесс осуществляется при 200—250° при давлении
20 ат. Часть плава возвращают на растворение в нем КС! перед обработкой азотной кислотой, а другую (меньшую) продувают азотом для удаления газов, гранулируют и выпускают в качестве продукта. Из отходящего газа извлекают конденсацией и сорбцией хлор и двуокись азота, которую направляют на производство азотной кислоты 255.
Другой способ заключается в осуществлении реакции2И: 2КС1 + 2HN03 + у202 = 2KN03 + С12 + Н20
Нитрат калия: способы получения и химические свойства
Нитрат калия KNO3 — соль щелочного металла калия и азотной кислоты. Белый. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 101,10; относительная плотность для тв. и ж. состояния d = 2,109; tпл = 334, 5º C;
Способ получения
1. Нитрат калия можно получить при 70º С путем взаимодействия надпероксида калия и оксида азота (IV), образуется нитрат калия и кислород:
2. В результате взаимодействия разбавленной азотной кислоты и гидроксида калия образуется нитрат калия и вода:
3. В результате реакции между горячим гидроксидом калия, оксидом азота (IV) и кислородом, происходит образование нитрата калия и воды:
4. В результате взаимодействия горячего и разбавленного раствора нитрита калия и кислорода образуется нитрат калия:
5. При смешивании горячего пероксида водорода и нитрита калия в разбавленной серной кислоте происходит образование нитрата калия и воды:
Качественная реакция
Качественная реакция на нитрат калия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат калия образует сульфат калия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат калия разлагается при температуре 400–520º С с образованием нитрита калия и кислорода:
2. Н итрат калия может реагировать с простыми веществами :
2.1. Н итрат калия реагирует со свинцом при температуре 350–400 ºС . При этом образуется нитрит калия и оксид свинца:
KNO3 + Pb = KNO2 + PbO
2.2. Нитрат калия реагирует при температуре 400º С с алюминием с образованием алюмината калия, оксида алюминия и азота:
2.3. Нитрат калия взаимодействует с атомным водородом в присутствии цинка и разбавленной соляной кислоты при этом образуются нитрит калия и вода:
при взаимодействии нитрата калия и водорода при кипении в присутствии алюминия и концентрированного гидроксида калия образуется газ аммиак, вода и гидроксид калия:
3KNO3 + 8Al + 5KOH+ 18H2O = 3NH3↑ + 8K[Al(OH)4]
3. Возможны реакции между нитратом калия и сложными веществами :
3.1. Нитрат калия вступает в реакцию с кислотами :
3.1.1. В результате реакции в вакууме между нитратом калия и концентрированной серной кислотой образуется гидросульфат калия и азотная кислота:
3.2. Нитрат калия взаимодействует с солями :
3.2.1. Нитрат калия реагирует с сульфатом аммония при нагревании. В результате данной реакции образуются сульфат калия, оксид азота (I) и вода:
http://msd.com.ua/texnologiya-mineralnyx-solej-udo-brenij-pesticidov-promyshlennyx-so-lej-okislov-i-kislot/poluchenie-nitrata-kaliya-iz-xlorida-kaliya-i-azotnoj-kisloty-ili-okislov-azota/
http://chemege.ru/nitrat-kaliya/