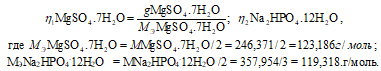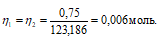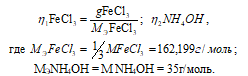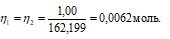Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e09e8f858fb0c7d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Количественное осаждение солей хлорида железа (ⅠⅠⅠ) и кристаллогидрата сульфата магния
Уравнения реакции осаждения кристаллогидрата сульфата магния и хлорида железа (ⅠⅠⅠ)
Задача 119.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество MgSO4 . 7H2O, навеска массой 0,75г; осадитель
Na2HPO4 . 12H2O, концентрация 6%.
Решение:
Уравнение реакции осаждения:
Так как вещества реагируют в химических реакциях равным чис¬лом грамм-эквивалентов, то n1 = n2.
Согласно закону равенства эквивалентов:
Рассчитаем массу Na2HPO4 . 12H2O:
m(Na2HPO4 . 12H2O) = MЭ(Na2HPO4 . 12H2O) . n(Na2HPO4 . 12H2O) = (119,318 . 0,006) = 0,73г.
Теперь рассчитаем объём раствора Na2HPO4 . 12H2O, теоретически необходимый для осаждения 1,20г MgSO4 . 7H2O из пропорции:
100 : 6 = х : 0,73;
х = (0,73 . 100)/6 = 12,16см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём Na2HPO4 . 12H2O, необходимый для осаждения:
V(Na2HPO4 . 12H2O) = (1,5 . 12,16) = 18,9см 3 .
Условия осаждения:
Определение осложняется тем, что Mg3(PO4)2 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(Na2HPO4 . 12H2O) = 18,9см 3 .
Уравнения реакции осаждения хлорида железа (ⅠⅠⅠ)
Задача 120.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество FeCl3, навеска массой 1,00г; осадитель NH4OH, концентрация 12%.
Решение:
Уравнение реакции осаждения:
Так как вещества реагируют в химических реакциях равным чис¬лом грамм-эквивалентов, то n1 = n2.
Согласно закону равенства эквивалентов:
Рассчитаем массу NH4OH:
Теперь рассчитаем объём раствора NH4OH, теоретически необходимый для осаждения 1,00г FeCl3 из пропорции:
100 : 12 = х : 0,215;
х = (0,215 . 100)/12 = 1,8см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём NH4OH, необходимый для осаждения:
V(NH4OH) = (1,5 . 1,8) = 2,7см 3 .
Условия осаждения: Определение осложняется тем, что Fe(OH)3 — аморфное соединение, склонено к уплотнению, что затрудняет последующее отмывание осадка, кроме того при стоянни увеличивается количество примесей, адсорбированных развитой поверхностью аморфного осадка. Поэтому Fe(OH)3 отфильтровывают сразу же после осаждения и кратковременного отстаивания.
Необходимые условия осаждения:
Осаждение ведут в присутствии подходящего электролита-коагулятора (обычно это соли аммония), из нагретого анализируемого раствора нагретым раствором осадителя.
- Осаждение ведут из достаточно концентрированного исследуемого раствора концентрированным раствором осадителя.
- Медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка.
- Повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(NH4OH) = 2,7см 3 .
Сульфат магния: способы получения и химические свойства
Сульфат магния MgSO4 — соль щелочного металла магния и серной кислоты. Белый, разлагается выше температуры плавления. Хорошо растворяется в воде (слабый гидролиз по катиону).
Относительная молекулярная масса Mr = 120,37; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 1137º C;
Способ получения
1. В результате взаимодействия карбоната магния и концентрированного раствора сульфата аммония при кипении образуется сульфат магния, аммиак, углекислый газ и воды:
Качественная реакция
Качественная реакция на сульфат магния — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат магния образует сульфат бария и хлорид магния:
Химические свойства
1. Сульфат магния вступает в реакцию со многими сложными веществами :
1.1. Сульфат магния взаимодействует с основаниями :
1.1.1. Сульфат магния реагирует с разбавленным раствором гидроксидом натрия с образованием гидроксида магния и сульфата натрия:
1.2. Сульфат магния может реагировать с кислотами :
1.2.1. При взаимодействии с концентрированной и холодной серной кислотой твердый сульфат магния образует гидросульфат магния:
1.3. Сульфат магния реагирует с солями :
1.3.1. Сульфат магния взаимодействует с концентрированным гидратом аммиака . При этом образуются гидроксид магния и сульфат аммония:
1.3.2. Сульфат магния вступает в реакцию с перхлоратами кальция, стронция и бария образуя сульфат этого металла и перхлорат магния:
1.3.3. Сульфат магния вступает во взаимодействие с гидрокарбонатом калия и образует карбонат магния, сульфат калия, воду и углекислый газ:
1.3.4. В результате реакции между насыщенным сульфатом магния и насыщенным хроматом кальция образуется хромат магния и сульфат кальция:
2. Сульфат магния разлагается при температуре выше 1200º С, образуя оксид магния, оксид серы и кислород:
http://buzani.ru/zadachi/analiticheskaya-khimiya/1461-khlorid-zheleza-i-kristallogidrat-sulfata-magniya-zadachi-119-120
http://chemege.ru/sulfat-magniya/