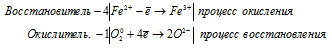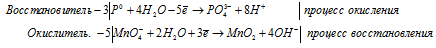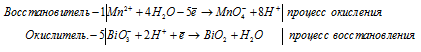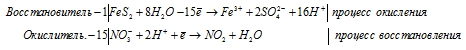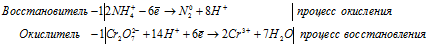Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e285ae4bff6fa70 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Оксид железа (III)
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства . Но есть интересный нюанс — при восстановлении оксида железа (III), как правило, образуется смесь продуктов: это может быть оксид железа (II), просто вещество железо, или железная окалина Fe3O4. Но в реакции мы записываем при этом только один продукт. А вот какой именно это будет продукт, зависит от условий реакции. Как правило, в экзаменах по химии нам даются указания на возможный продукт (цвет образовавшегося вещества или дальнейшие характерные реакции).
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до простого железа, так и до оксида железа (II) или железной окалины:
При восстановлении оксида железа (III) водородом также возможно образование различных продуктов, например, простого железа:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
http://chemege.ru/fe2o3/
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655