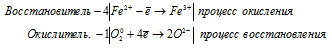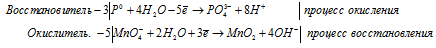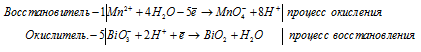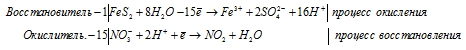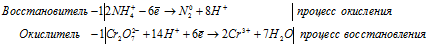Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfae061ab99163a • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
2HNO3 + (NH4)2CO3 = 2NH4NO3 +
Скачать
презентацию
2HNO3 + (NH4)2CO3 = 2NH4NO3 + ?CO2 + H2O. 2H+ + CO22– = ?CO2 + H2O. 2HNO3 + Na2SiO3 = ?H2SiO3 + 2NaNO3. 2H+ + 2NO3– + 2Na+ + SiO32– = ?H2SiO3 + 2Na+ + 2NO3–. 2H+ + SiO32– = ?H2SiO3. 3. 2H+ + 2NO3– + 2NH4+ + CO22– = 2NH4+ +2NO3– + ?CO2 + H2O. Активные кислоты вытесняют слабые летучие или нерастворимые кислоты из растворов солей.
Картинка 19 из презентации «Азотная кислота» к урокам химии на тему «Названия кислот»
Размеры: 960 х 720 пикселей, формат: jpg. Чтобы бесплатно скачать картинку для урока химии, щёлкните по изображению правой кнопкой мышки и нажмите «Сохранить изображение как. ». Для показа картинок на уроке Вы также можете бесплатно скачать презентацию «Азотная кислота.ppt» целиком со всеми картинками в zip-архиве. Размер архива — 1534 КБ.
Названия кислот
«Угольная кислота и её соли» — Ввести в схему. Правильные ответы: 1 вариант – 1, 2, 3, 4, 8, 10 2 вариант – 3, 5, 6, 7, 9, 10. О каком явлении идет речь? О каких оксидах углерода говорится в следующих высказываниях? Очень ядовит Не горит и не поддерживает горения Используется в металлургии при выплавке чугуна Образуется при полном сгорании топлива В нем горит магний Типичный кислотный оксид.
«Физические и химические свойства кислот» — Получение H2SO4 – на ЧЭЦЗ. Сернистая кислота. 2. По количеству атомов водорода. Трех-основные H3PO4. При обычных условиях кислоты могут быть твердыми и жидкими. Двух-основные H2S H2SO4. Соляная кислота. Угольная кислота. Дать название кислотам: HCI H2SO4 H3PO4 HNO3 H2S НNO2 H 2SO3 H2CO3 н2sio4. Ашинский химический завод – уксусная кислота.
«Серная кислота урок» — Отрицательное воздействие на среду». Девиз урока: Какие общие свойства кислот характерны для серной кислоты? Как можно распознать серную кислоту? Как взаимодействует концентрированная серная кислота на органические соединения? Интегрированный урок по теме: Цель урока: Применение серной кислоты.
«Угольная кислота» — 2NaOH. t. 1. 3. Разложение при нагревании. 15. 6. 13. Угольная кислота но c = o но. 16. Карбамид (мочевина). 11. Угольная кислота. 3.
«Жирные кислоты» — n-9. Ферменты, белки. С 1978 г. С.Д. Варфоломеев, А.Т. Мевх, Г.Ф. Судьина, П.В. Вржещ и др. Диагностика. 3. 4. 2. Арахидоновая кислота и другие полиеновые жирные кислоты как сигнальные молекулы.
«Производство серной кислоты» — Сушильная башня. «Огарок». Двойной цилиндр, центробежная сила, сила гравитационного притяжения. Циклон. Очистка «печного газа». Керамические трубки — увеличение площади соприкосновения. V2O5. Технология производства. III стадия. 1. Горения 2. Экзотермическая 3. Гетерогенная 4. Некаталитическая 5. Необратимая 6. Окислительно-восстановительная.
Всего в теме «Названия кислот» 7 презентаций
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655
http://900igr.net/kartinki/khimija/Azotnaja-kislota/019-2HNO3-NH42CO3-2NH4NO3-CO2-H2O.html