Лекция №15: Классификация растворов. Коллигативные свойства растворов.
1. Идеальные растворы. Физической моделью идеального раствора является совокупность невзаимодействующих частиц, имеющая объем, аддитивно складывающийся из объемов отдельных компонентов. Наиболее важными свойствами идеальных растворов являются: а) Идеальные растворы образуются из чистых компонентов, находящихся в том же агрегатном состоянии, что и раствор, атермально, т.е. без теплового эффекта. б) Объем идеального раствора, образованного из чистых компонентов, находящихся в том же агрегатном состоянии, что и раствор, аддитивно складывается из объемов отдельных компонентов. Основное назначение концепции идеальных растворов – служить эталоном, с которым сравниваются реальные растворы. Все свойства идеальных растворов, в отличие от реальных, легко рассчитываются исходя только из их концентрации и свойств отдельных компонентов.
2. Предельно разбавленные растворы. Предельно разбавленным (п.р.) раствором называют раствор, в котором свойства растворителя практически остались неизменными по сравнению с чистым растворителем ввиду низкой концентрации раствора, в то время как свойства растворенного вещества могут очень сильно отличаться от его свойств в чистом виде ввиду попадания в среду растворителя. Свойствами п.р. растворов обладают обычно все разбавленные растворы вплоть до определенной концентрации, характерной для каждой системы. Чем ближе свойства компонентов, тем до более высокой концентрации сохраняют их растворы свойства п.р. растворов. Для растворов электролитов этот предел очень низок, так как ионы заметно изменяют свойства растворителя уже при миллимолярных концентрациях.
3. Реальные растворы. Различные свойства реальных растворов в той или иной степени отклоняются от идеальных (например, термодинамические). Для адекватного описания этих отклонений обычно требуются различные физические модели, учитывающие межчастичные парные и коллективные взаимодействия, размеры частиц, расстояния между ними и т.д. В некоторых простейших случаях такие модели приводят к результатам, хорошо совпадающим с экспериментом. Однако наиболее универсальный и полностью формальный способ учета неидеальности компонентов раствора был предложен Г. Льюисом в 1907 г., который сохранил ту же форму выражения химического потенциала компонента в реальном растворе, что и в идеальном, но вместо концентрации компонента использовал в нем активности.
По концентрации растворенного вещества растворы можно подразделить на концентрированные (с большой концентрацией растворенного вещества) и разбавленные (с малой концентрацией растворенного вещества).
Важное значение при описании свойств растворов имеет закон Генри: «Масса газа, растворяющегося при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа». Математически это можно записать так: С=k·р, где k – константа Генри, С – массовая концентрация газа в насыщенном растворе. Важнейшим следствием этого закона является то, что объём газа, растворяющегося при постоянной температуре в данном объёме жидкости, не зависит от его парциального давления.
Коллигативными свойствами раствора называются свойства, зависящие от концентрации частиц растворенного вещества и мало или совсем не зависящие от природы растворителя. К таким свойствам относят:
— давление насыщенного пара растворителя;
— понижение температуры замерзания раствора;
— повышение температуры кипения раствора;
1. Давление насыщенного пара растворителя. Под давлением насыщенного пара вещества понимают давление его паров в отсутствие других газов, в частности воздуха. Относительное понижение давления пара над раствором равно:
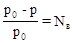
2. Осмотическое давление. Осмотическое давление — это такое давление, которое нужно приложить к раствору, отделенному от растворителя полупроницаемой перегородкой, чтобы наступило состояние равновесия. Процесс осмоса, в свою очередь, характеризуется самопроизвольным проникновением молекул растворителя через полупроницаемые перегородки.
В 1886 г. Вант-Гофф cформулировал закон (закон Вант-Гоффа), согласно которому «в разбавленном растворе растворенное вещество ведет себя подобно идеальному газу» и показал, что для растворов неэлектролитов невысоких концентраций осмотическое давление Рос равно:
Рос=С·R·Т=10 3 ·(m/M)·RT, где С= 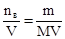
Для растворов электролитов величина Рос составляет:
где i – изотонический коэффициент, показывающий, во сколько раз осмотическое давление данного раствора выше нормального. Для каждого раствора этот коэффициент определяется экспериментально.
3. Понижение температуры замерзания раствора (криоскопия). Из всех коллигативных свойств чаще других используются криоскопические измерения ввиду простоты и высокой точности измерения температуры замерзания. Последняя обычно измеряется с помощью специальных метастатических ртутных термометров (термометров Бекмана) с ценой деления 0.01 К. Такие термометры имеют шкалу только на 5 К, но снабжены дополнительным резервуаром для ртути, позволяющим настроить его на любые абсолютные температуры от 260 до 380 К.
Понижение температуры замерзания можно найти как:
Dtзам=i·К·m, где m – моляльность; К — криоскопическая константа, зависящая только от природы растворителя и не зависящая от природы растворенного вещества. Для воды К=1.86, для бензола К=5,07.
4. Повышение температуры кипения раствора (эбуллиоскопия). Помимо криоскопического метода в химии применяется эбуллиоскопический метод, основанный на измерении температуры кипения растворов.
Повышение температуры кипения можно найти как:
Dtкип=i·Е·m, где m – моляльность; Е — эбуллиоскопическая константа, зависящая только от природы растворителя и не зависящая от природы растворенного вещества. Для воды Е=0.52, для бензола Е=2,6.
Оба рассмотренные методы позволяют определять молекулярные массы веществ.
Термодинамическая теория растворов
Раствор – это гомогенная система, в которой одно вещество равномерно распределено в среде другого (или других) веществ. Раствор –это однофазная гомогенная система, образующаяся не менее чем 2-мя компонентами. Состав раствора можно изменять непрерывно в определенных пределах.
Растворы делятся на:
-жидкие (морская вода)
В жидких растворах различают растворители и растворенные вещества. Растворителемназывают жидкий компонент раствора, который имеется в избытке по сравнению с остальными компонентами раствора. Остальные компоненты раствора, которые находятся в растворе в меньшем количестве, называются растворенными веществами.
В 19 веке развивались 2 противоположных теории растворов: химическая теория, в которой все свойства растворов пытались объяснить образованием в них химических соединений (Д. И. Менделеев и др.) и физическая, в которой растворенное вещество рассматривалось как газ, который заполняет инертный растворитель (Якоб Хендрик Вант-Гофф, Сванте Аррениус и др.). В современной физико-химической теории растворов (основоположники Иван Алексеевич Каблуков, Владимир Александрович Кистяковский) признается важность как физических, так и химических сил между частицами (молекулами, атомами, ионами) в растворе.
Растворение ионных веществ в воде состоит из 2-х стадий. 1 стадия – разрушение кристаллической решетки под действием дипольных молекул воды. При этом энергия затрачивается (ΔH1 > 0, Q1 0, Q2 0 и эффект эндотермический (NaCl, NH4Cl). Для некоторых веществ ΔsolH°инт
Основными характеристиками раствора являются его состав и химические потенциалы компонентов раствора.
Способы выражения состава растворов.
| Название | Формула | Единица измерения |
| Массовая доля |  | % или доли единицы |
| Мольная доля | 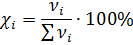 | % или доли единицы |
| Молярная концентрация (молярность) |  | моль/л, М |
| Молярная концентрация эквивалента (нормальность) | 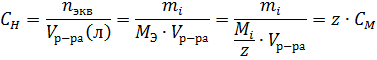 | моль/л, Н |
| Моляльность | 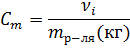 | моль/кгр-ля |
Основным вопросом термодинамической теории растворов является установление зависимости равновесных свойств от состава и свойств его исходных компонентов.
Идеальные растворы– это растворы, в которых частицы взаимодействуют одинаково, независимо от их химической природы. Признаком идеальности раствора является аддитивность парциальных давлений, парциальных объемов, теплоемкостей и энтропий компонентов. Тепловой эффект при образовании идеального раствора ΔH = 0, объем не изменяется ΔVm = 0, а изменение энтропии равно идеальной энтропии смешения ΔS = ΔSсмеш. ид. = -χ1Rlnx1 – χ2Rlnx2.
Идеальные растворы подчиняются закону Рауля и следствиям из него. Идеальный раствор – это идеальная модель. Наиболее близки к ним растворы из молекул, очень похожих друг на друга («подобное растворяется в подобном»). Например, это смеси изотопов, смеси изомеров, смеси гомологов и т. д.
Предельно разбавленный раствор – это раствор, в котором концентрация растворенного вещества мала. Растворитель подчиняется законам идеального раствора, а растворенное вещество не подчиняется.
Неидеальные растворы (реальные) – все растворы, которые не относятся к идеальным или предельно разбавленным растворам. Вместо концентраций применительно к ним используются активности.
Среди неидеальных растворов выделяют:
1) Регулярные растворы – это реальные растворы, у которых при смешении компонентов, взятых в одинаковом агрегатном состоянии, изменение энтальпии и объема не равны нулю, ΔH ≠ 0, ΔVm ≠ 0, но изменение энтропии такое же, как у реальных растворов: ΔS = ΔSсмеш. ид. Это растворы неполярны неассоциированных жидкостей: C6H6 и C6H12, C6H12 и CCl4, C6H6 и CCl4.
2) Атермальные растворы– реальные растворы, теплота образования которых равна нулю ΔH = 0. Они близки к идеальным, но состоят из компонентов, существенно различающихся по размерам и, следовательно, разными Vm. Это растворы ВМС в низкомолекулярных соединениях.
Лекция 5: Растворы. Свойства растворов. Способы выражения концентрации растворов
Лекция 5: Растворы. Свойства растворов. Способы выражения концентрации растворов.
1. Понятие о растворах. Классификация растворов.
2. Растворимость веществ. Факторы, влияющие на растворимость веществ.
3. Сущность процесса растворения. Термодинамика процесса растворения.
4. Способы выражения концентрации растворов.
5. Коллигативные свойства растворов.
1.Растворы. Классификация растворов.
Раствором называется гомогенная (однородная) система, состоящая из двух или более независимых компонентов (растворенное вещество и растворитель), а также продуктов их взаимодействия. Компонент, количество которого преобладает в данной системе, называют растворителем.
По агрегатному состоянию растворы делятся:
- газообразные растворы: воздух – это раствор кислорода, паров воды, углекислого газа СО2 и благородных газов в азоте; твердые растворы: сплавы металлов; жидкие растворы в свою очередь делятся: растворы твердых веществ в жидкостях: соль+Н2О, сахар+Н2О, йод+Н2О растворы газообразныхых веществ в жидкостях: лимонады, нашатырный спирт
3. растворы жидких веществ в жидкостях: уксус, водка (спирт + вода)
Наибольшее значение для химии имеют растворы, в которых растворителем является жидкость. Относительное содержание компонентов в растворе может быть любым, оно ограничено лишь взаимной растворимостью веществ, которая зависит от их химической природы, их сродства друг к другу, а также от условий приготовления растворов – температуры, давления (в случае растворения газов), присутствия других растворенных веществ.
По относительным количествам растворенного вещества и растворители растворы бывают: разбавленные и концентрированные.
По соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и перенасыщенные.
Насыщенный раствор — это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества.
Раствор концентрация которого ниже концентрации насыщенного раствора называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количество того же самого вещества.
Если раствор, насыщенный при нагревании, осторожно охладить до комнатной температуры так, чтобы не выделялись кристаллы соли, то образуется перенасыщенный раствор. Таким образом, перенасыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем возможно в насыщенном растворе. Перенасыщенный раствор нестабилен, и при изменении условий (например при энергичном встряхивании или внесении кристаллика соли – затравки для кристаллизации) образуется насыщенный раствор и осадок кристаллов соли.
2. Растворимость веществ. Факторы, влияющие на растворимость веществ.
Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость. Наиболее распространенными способами такой характеристики служат:
· коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Например, при 20ْ С в 100 г воды с образованием насыщенного раствора растворяется 36,0 г NaCI, значит Р(NaCI) = 36.
· молярная растворимость вещества (S) — число молей вещества, способное при данной температуре раствориться в 1 л указанного растворителя с образованием насыщенного раствора. Так, S(NaCI) = 6,154 моль\л
· коэффициент поглощения газа –наибольший объем газа, который может раствориться в единице объема растворителя при данной температуре и парциальном давлении газа 1 атм. Так при 20ْ С коэффициенты поглощения водой азота и кислорода, молекулы которых неполярны, составляют соответственно 0,016 и 0,031. Для газов, молекулы которых полярны, коэффициент их поглощения водой значительно выше, например для HCI – 500, NH3 – 1300.
Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления.
Зависимость от природы реагирующих веществ
Наибольшая растворимость достигается тогда, когда эти силы межмолекулярного взаимодействия имеют подобный характер: «подобное растворяется в подобном». Так вещества с ионным типом химической связи (соли, щелочи) или, полярные (спирты, альдегиды) хорошо растворимы в полярных растворителях, например в воде. И наоборот малополярные соединения, например оксид углерода (II) хорошо растворимы в неполярных соединениях, например в сероуглероде.
Зависимость от температуры.
Так как растворение процесс обратимый, значит к нему применим принцип Ле-Шателье: если растворение вещества происходит с поглощением теплоты, то повышение температуры приводит к увеличению растворимости.
Для большинства твердых веществ повышение температуры способствует увеличению растворимости.
Для газов повышение температуры способствует уменьшению растворимости, так как связи между молекулами растворимого вещества и растворителя — непрочные.
3. Сущность процесса растворения. Термодинамика процесса растворения.
Растворение веществ часто происходит с выделением или поглощением теплоты, иногда с изменением объема. Основоположником теории растворов является . Сущность процесса растворения сводится к следующему:
- В растворах между компонентами раствора имеется взаимодействие, что приводит к образованию нестойких соединений переменного состава. Эти соединения растворенного вещества и растворителя называется сольватами, если растворитель – вода, то их называют гидратами. Раствор является динамической системой, в котором распадающиеся соединения находятся в подвижном равновесии с продуктами распада в соответствии с законом действующих масс. Сольватация (гидратация) обусловлена силами Ван-дер-Ваальса, действующими между растворенными веществом и растворителем. Сольватация протекает тем лучше, чем более полярны молекулы, составляющие раствор. Вода — хороший растворитель, так как её молекулы сильно полярны. Гидратная вода может быть связана с молекулами твердого вещества и входить в состав кристаллов (кристаллогидраты): CuSO4 ∙ 5 H2O –медный купорос, CaSO4 ∙ 2 H2O – гипс.
Процесс растворения можно выразить схемой:
растворенное вещество + растворитель ó вещество в растворе ± ∆ Н.
Тепловой эффект, сопровождающий процесс растворения, относящийся к 1 молю растворенного вещества называется молярной теплотой растворения ∆ Н раств.
∆Н 1 > 0 — количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя (процесс эндотермический).
∆Н 2 0 — энергия необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический).
В зависимости от того преобладает первая или вторая составляющие, процесс растворения может быть экзотермический или эндотермический:
если │ ∆Н2 │> │∆ Н1│, процесс экзотермический и ∆Н 0.
4. Способы выражения состава растворов.
Состав растворов количественно принято выражать через безразмерные количественные величины – доли (массовую, объемную, молярную) и размерные величины – концентрации.
Массовая доля (W) или процентная концентрация — отношение массы растворенного вещества к массе раствора. Массовая доля – безразмерная величина, ее выражают в долях от единицы в процентах (10%). Массовая доля показывает, сколько граммов данного вещества, находится в 100 г раствора
mв-ва — масса растворенного вещества, г
mв-ва — масса раствора, г
m р-ля — масса растворителя, г.
W (NaOH) = 5% или 0,05 означает, что
5 г NaOH находится в 100г раствора,
5 г NaOH находится в 95 г воды
Объемная доля j — отношение объема растворенного вещества к объему раствора.
Молярная доля N – отношение числа молей растворенного вещества к сумме числа молей растворенного вещества и растворителя.
Концентрация показывает отношение массы или количества вещества к объему раствора.
Молярная концентрация (молярность) См (моль/л) – показывает число молей растворенного вещества в одном литре раствора, выражается отношением количества растворенного вещества к объему раствора.
См-молярная концентрация раствора.
ma — масса вещества в граммах
Ma – молярная масса вещества в г/моль
V – объем раствора в литрах
Для обозначения молярной концентрации применяются символы:
1М-одномолярный раствор См = 1 моль/л
0,1М-децимолярный раствор См = 0,1 моль/л
Раствор в котором содержится 1 моль растворенного вещества называется одномолярным.
2М раствор NaOH означает, что 2 моля NaOH содержится в 1 литре раствора, т. е 2* 40 = 80 г NaOH.
Нормальная концентрация (нормальность раствора) или молярная концентрация эквивалента, Сн (экв/л) – показывает число эквивалентов растворенного вещества, содержащихся в одном литре раствора.
Сн — нормальная концентрация [моль/л]
М эква – эквивалентная масса вещества в г/моль
ma — масса вещества в граммах
V – объем раствора в литрах
1Н — однонормальный раствор Сн =1 моль/л
0,1Н — децинормальный раствор Сн=0,1 моль/л
0,01Н — сантинормальный раствор Сн = 0,01 моль/л
Эквивалентом вещества называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождаться или быть каким-либо образом эквивалентна (равнозначна) одному катиону H водорода в кислотно-основных растворах или одному электрону в окислительно-восстановительных реакциях. Число, показывающее, какая доля реальной частицы вещества эквивалентна одному катиону H или одному электрону называется фактором эквивалентности ( f экв ). Количество эквивалента (n экв) также как и количество вещества измеряется в молях. Масса одного моля эквивалента называется молярной массой эквивалента (Мэкв) также как и молярная масса измеряется в г/моль. Между собой эти две массы связаны следующим соотношением:
n(Н ) – число ионов водорода, способных замещаться на металл (основность кислоты)
n(ОН ) – число ионов гидроксогрупп (кислотность основания)
f экв = число атомов металла * заряд иона металла
С учетом фактора эквивалентности:
Титр раствора Т – показывает массу растворенного вещества, содержащуюся в 1 мл раствора.
Моляльная концентрация (моляльность Сm) — отношение количества растворенного вещества к массе растворителя, выраженой в килограммах.
1000 — коэффициент перевода граммов в килограммы
Коллигативные свойства растворов.
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Растворы, образованные частицами строго одинакового размера, между которыми действуют примерно одинаковые силы межмолекулярного взаимодействия, не происходит химического взаимодействия, изменения температуры и объема называются идеальными. К идеальным растворам стремятся очень разбавленные растворы.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
· давление насыщенного пара растворителя над раствором
· температура кристаллизации раствора
· температура кипения раствора
Осмос. Осмотическое давление.
Растворы однородны по всем частям объема. Если в один сосуд поместить концентрированный раствор, а сверху разбавленный, то через некоторое время эта неоднородная масса вновь станет однородной. Такой самопроизвольный процесс перемешивания вещества, приводящий к выравниванию его концентрации называется диффузией.
Если между двумя растворами поместить полупроницаемую перегородку (мембрану), то выравнивание концентраций будет проходить только вследствие перемещения молекул воды. Такая односторонняя диффузия называется осмосом.
Осмос – односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую перегородку из раствора с низкой концентрацией в раствор с более высокой концентрацией.
Полупроницаемые перегородки способны пропускать только молекулы растворителя, но не пропускают молекулы растворенного вещества.
природные полупроницаемые перегородки — стенки растительных и животных клеток, стенки кишечника;
искусственные полупроницаемые перегородки – целлофан, пергамент, пленки из желатина.
Количественной характеристикой осмоса является осмотическое давление раствора.
Осмотическим давлением (Pосм.) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
К осмотическому давлению применимы все законы газового давления и для его вычисления можно использовать уравнение Клапейрона — Менделеева m
В 1887 г Вант-Гоффом в результате исследований была установлена такая зависимость:
См –молярная концентрация растворенного вещества, моль/л
R – универсальная газовая постоянная, 8,314 Дж/моль* К
T – температура, К.
Осмотическое давление разбавленного идеального раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы при той же температуре находилось бы в газообразном состоянии и занимало бы объем, равный объему раствора.
Однако это уравнение справедливо только для растворов, в которых отсутствует взаимодействие частиц, т. е. для идеальных растворов. В реальных растворах имеют место межмолекулярные взаимодействия между молекулами вещества и растворителя, которые могут приводить или к диссоциации молекул растворенного вещества на ионы, или к ассоциации молекул растворенного вещества с образованием из них ассоциатов.
Диссоциации молекул растворенного вещества в водном растворе на ионы характерна для электролитов. В результате диссоциации число частиц в растворе увеличивается.
Ассоциация наблюдается, если молекулы вещества лучше взаимодействуют между собой, чем с молекулами растворителя. Это характерно для коллоидных растворов, что приводит к уменьшению числа частиц в растворе.
Для учета межмолекулярных взаимодействий в реальных растворах Вант-Гофф предложил использовать изотонический коэффициент i. Для молекул растворенного вещества физический смысл изотонического коэффициента:
i = число частиц растворенного вещества / число частиц исходного вещества.
Для растворов неэлектролитов, молекулы которых не диссоциируют и мало склонны к ассоциации, i =1.
Для водных растворов электролитов, вследствие диссоциации i > 1, причем максимальное его значение (i max) для данного электролита равно числу ионов в его молекуле:
NaCI CaCI2 Na3PO4
Для растворов, в которых вещество находится в виде ассоциатов, i 1 для электролитов.
Изотонические растворы – имеют равное осмотическое давление. Гипертонические растворы– имеют большее осмотическое давление по сравнению с другим раствором. Гипотонические растворы – имеют меньшее осмотическое давление по сравнению с другим раствором.
Роль осмоса. СРС.
Понижение давление пара растворов. Законы Рауля.
Над любой жидкостью устанавливается определенное давление пара, насыщающего пространство. В отличии от поверхности растворителя, поверхность раствора частично занята молекулами растворенного вещества. Именно поэтому испарение с поверхности растворов всегда меньше, чем с поверхности растворителя, и при одной и той же температуре давление насыщенного пара над раствором всегда будет ниже давления пара над чистым растворителем.
. Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе
• p — давление пара над раствором, Па;
• p0 — давление пара над чистым растворителем, Па;
• χр-ль — мольная доля растворителя.
• nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
• относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
• При этом принимаем, что χв-ва + χр-ль = 1
• Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
• Δp = i · p0 · χв-ва, где
• Δp — изменение давления паров раствора по сравнению с чистым растворителем;
• χв-ва — мольная доля вещества в растворе
• i – изотонический коэффициент.
i =1 для неэлектролитов, i > 1 для электролитов.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
С понижением давления насыщенного пара растворителя над раствором связано повышение температуры кипения раствора и понижение температуры его замерзания. Любая жидкость кипит, когда давление насыщенного пара над ней становится равным атмосферному. Так как согласно I закону Рауля давление пара над раствором меньше, чем над раствором растворителя, то для того, чтобы раствор закипел, его нужно нагреть до более высокой температуры, чем растворитель. Таким образом, растворы кипят при более высокой температуре, а замерзают при более низкой температуре, чем чистый растворитель.
Разность температур кипения раствора и растворителя называется повышением температуры кипения.
Разность температур замерзания раствора и растворителя называется понижением температуры замерзания.
Понижение температуры замерзания и повышение температуры кипения не зависят от природы растворенного вещества и прямопропорциональны моляльной концентрации раствора.
Кэб – эбулиоскопическая константа
Ккр – криоскопическая константа
Cm – моляльная концентрация раствора [моль/кг растворителя]
i- изотонический коэффициент, i =1 для неэлектролитов, i > 1 для электролитов.
Кэб – эбулиоскопическая константа
Ккр – криоскопическая константа
Физический смысл:
Эбулиоскопическая константа (Кэб) – показывает повышение температуры кипения одномоляльного раствора по сравнению с чистым растворителем.
Криоскопическая константа (Ккр) – показывает понижение температуры замерзания одномоляльного раствора по сравнению с чистым растворителем.
Все одномоляльные растворы неэлектролитов будут
кипеть при температуре: t кип = 100 С + 0,52 С = 100,52 С
и замерзать при температуре: t зам = 0 С– 1,86 С = — 1,86 С
Пример. Вычислить температуру кипения и температуру замерзания 4,6% раствора глицерина (С3 Н5 (ОН)3) в воде.
В 100г воды содержится 4,6г глицерина и 95,4г воды.
http://poisk-ru.ru/s22360t4.html
http://pandia.ru/text/80/317/73265.php
