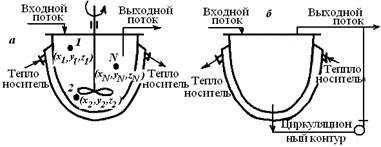
Реактор идеального смешения
Для модели идеального смешения принимается ряд допущений. Допускается, что в результате интенсивного перемешивания устанавливаются абсолютно одинаковые условия в любой точке реактора: концентрации реагентов и продуктов, степени превращения реагентов, температура, скорость химической реакции и т. д. Например, в некоторый момент времени τj во всех точках ректора (рис. 5.1) выполняются следующие условия:
где x, у, z – пространственные координаты.
В проточном реакторе идеального смешения концентрации элементов реакции в выходном потоке в рассматриваемый момент времени τi строго равны концентрациям тех же веществ в реакторе.
Чтобы перечисленные допущения могли быть выполнены, необходимо принять еще одно допущение: переход от одной концентрации к другой в реакторе идеального смешения не должен иметь протяженности во времени. Изменение концентрации исходного реагента от начальной cJ,0 во входном потоке в данный момент времени τi до концентрации в реакторе сJ в этот же момент времени должно происходить мгновенно (скачкообразно).
Приблизиться к режиму идеального смешения можно, обеспечив интенсивное перемешивание реакционной смеси механическими мешалками разного типа или циркуляционными насосами, создающими высокую кратность циркуляции. Смешение, близкое к идеальному смешению, легче выполнить в емкостных аппаратах с приблизительно равным диаметром и высотой.
Так как в реакторе идеального смешения концентрации элементов реакции равномерно распределены по объему, то уравнение материального баланса (4.7), выведенное для элементарного объема, можно распространить на полный объем реактора.
Рассмотрим два частных случая: периодический реактор идеального смешения и проточный реактор идеального смешения, работающий в стационарном режиме.
Периодический реактор идеального смешения.В периодический реактор все реагенты вводят до начала реакции, а все продукты выводят из него только по окончании процесса. В ходе реакционного цикла никаких веществ в реактор не вводят и из него не выводят, так что общая масса реакционной смеси в реакторе остается постоянной, изменяется лишь ее состав. При составлении математического описания принимают, что реакционная смесь однородна по объему аппарата и ее состав зависит только от времени пребывания в периодическом реакторе.
Рис. 5.1. Схемы реакторов идеального смешения
с механическим перемешивающим устройством (а)
и циркуляционным контуром (б)
Из общего уравнения материального баланса (4.7) в случае периодического реактора идеального смешения можно исключить два первых оператора, описывающих явления конвективного и диффузионного переноса вещества в аппарате. При отсутствии перемещения потока через реактор в произвольный момент времени между началом и окончанием процесса средняя линейная скорость элемента потока равна нулю, следовательно, и конвективный перенос в непроточном реакторе отсутствует. Заключение об отсутствии диффузионного переноса вытекает из допущений модели идеального смешения, так как диффузия возможна лишь при наличии градиента концентраций, а при равномерном распределении концентраций по объему он равен нулю. (Этот вывод справедлив не только для периодического, но и для проточного реактора идеального смешения.)
Следовательно, уравнение материального баланса для периодического реактора идеального смешения примет вид
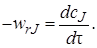
В уравнении (5.1) частная производная заменена на полную, так как в соответствии с допущениями идеального смешения концентрация с внутри реактора является функцией только одной переменной – времени.
Уравнение материального баланса периодического реактора идеального смешения (5.1) совпадает с уравнением (3.2), дающим определение скорости химического превращения. Из одинакового вида уравнений косвенно можно сделать вывод, что гидродинамическая обстановка в периодическом реакторе идеального смешения не накладывает ограничений на химическую кинетику.
Для проведения расчетов по уравнению (5.1) в его левую часть вместо wrJ(cJ)вводят конкретное кинетическое уравнение. Тогда можно рассчитать, например, время реакционного цикла, необходимое для достижения заданной глубины превращения (заданной конечной концентрации сJ,f):
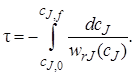
Если вещество J – исходный реагент, то концентрацию cs можно выразить через его степень превращения:
и уравнение (5.2) примет вид
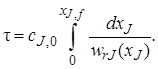
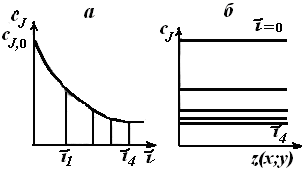
Уравнения (5.2) и (5.3) позволяют также рассчитать зависимость концентрации реагента сJ или его степени превращения хJ от времени пребывания в реакторе (продолжительности реакционного цикла). В разные моменты времени условия в периодическом реакторе различные (концентрация реагентов, продуктов, скорость реакции и т. д.), однако в каждый данный момент времени из-за допущения об идеальности эти параметры строго одинаковы в объеме реактора (рис. 5.2).
Время, рассчитанное по уравнению (5.2) или (5.3), является «чистым» временем, необходимым для проведения химического превращения. Однако для осуществления процесса в периодическом реакторе кроме этого «реакционного» времени нужно затратить вспомогательное время на загрузку реагентов, выведение реактора на нужный технологический режим, разгрузку и очистку. Полное время одного цикла работы периодического реактора суммируется из основного τхр и вспомогательного τвсп.
Рис. 5.2. Изменение концентрации исходного реагента
в периодическом реакторе идеального смешения во времени (а)
и по объему аппарата (б)
Наличие τвсп как составной части времени цикла приводит к снижению производительности химического реактора (количество продукта, получаемого в единицу времени) и является одним из существенных недостатков периодических процессов вообще. Другие их недостатки – большие затраты ручного труда, сложность решения задач автоматизации (так как условия в реакторе во времени постоянно меняются).
Однако периодические реакторы обычно можно приспособить к широкому диапазону условий реакций, что удобно при необходимости производить на одной установке различные химические продукты, например, в промышленности химических реактивов.
Периодические реакторы с интенсивным перемешиванием, приближающимся к идеальному смешению, применяют в производствах реактивов, органических красителей, лекарственных препаратов – там, где для достижения достаточной глубины превращения требуется сравнительно длительное время, а объемы производства невелики.
Периодические реакторы смешения часто применяют в микробиологической промышленности для культивирования аэробных микроорганизмов. Процесс культивирования для большинства микроорганизмов длится 48–72 ч, т. е. достаточно длителен. Интенсивное перемешивание в ферментаторе позволяет обеспечить равномерное распределение температуры, что особенно важно в таких процессах, так как даже небольшие локальные разогревы могут привести к гибели микроорганизмов. Изолированность реакционной системы в периодическом реакторе позволяет устранить опасность отравления микроорганизмов случайными примесями, которые могут попасть в аппарат при непрерывной подаче реагентов.
Окончательное решение о целесообразности применения периодического или непрерывного процесса можно вынести лишь на основании экономической оценки (сравнения расходов на эксплуатацию, амортизацию, электроэнергию, пар, сырье и т. д.). Как правило, при проведении такого сравнения оказывается, что периодические процессы выгодны при относительно невысокой производственной мощности в тех случаях, когда получают дорогостоящие продукты.
Проточный реактор идеального смешения в стационарном режиме.Если необходимо обеспечить получение большого количества продукта одинакового качества, химический процесс предпочитают проводить в непрерывно действующих реакторах с установившимся режимом. Распространенным видом таких проточных аппаратов являются реакторы смешения. Проточный реактор смешения может работать как в нестационарном режиме (пуск, выход на режим, остановка), так и в стационарном, установившемся режиме.
Рассмотрим уравнение материального баланса для стационарного проточного реактора идеального смешения без циркуляции. Получим его, опять упрощая общее уравнение материального баланса (4.7). Для любого реактора идеального смешения, и в частности для проточного, из уравнения можно исключить оператор, описывающий диффузионный перенос. При стационарном режиме работы реактора из уравнения исключается производная дсJ/дτ,не равная нулю только при наличии накопления вещества в реакторе.
Таким образом, в уравнении остаются только два члена, описывающие конвективный перенос вещества J и расход или образование этого вещества в ходе химической реакции.
Оператор конвективного переноса (переноса импульса), записанный в уравнении (4.7) в дифференциальной форме, можно представить для проточного реактора идеального смешения в конечно-разностной форме. В соответствии с допущениями модели идеального смешения в проточном реакторе происходит дискретное конечное (а не бесконечно малое) изменение концентрации ∆сJ сразу же на входе в реактор. Заменим поэтому градиент концентрации на отношение конечного изменения концентрации ∆сJ к изменению координаты ∆z при прохождении реакционного потока через реактор со средней линейной скоростью 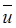
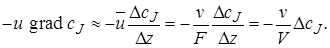
В выражении (5.4) ∆сJ равно разности концентраций на выходе из реактора cif и на входе в реактор сJ,0. Окончательно уравнение материального баланса проточного стационарного реактора идеального смешения можно представить так:
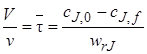
Это же уравнение можно получить и другим путем. Как указывалось, в качестве элементарного объема для реактора идеального смешения можно принять полный объем реактора V. При стационарном режиме работы реактора не происходит изменения постоянных по объему концентраций элементов реакции и во времени, следовательно, в качестве элементарного промежутка времени можно принять любой конечный временной интервал, например единицу времени (1 с, 1 мин или 1 ч).
Количество вещества J, которое за единицу времени войдет в реактор с конвективным потоком, будет равно v0cJ,0,где v0 – объемный расход реакционного потока на входе в аппарат. За это же время выйдет из реактора с конвективным потоком количество вещества J = vfcJ,f,а расход вещества J (или его образование) в ходе химической реакции составит wrJ V. При этом скорость wrJ определяется концентрацией cJ,f.
Стационарность процесса в проточном реакторе можно обеспечить, если объемные расходы на входе v0 и выходе vf равны между собой
(v0 = vf = v).
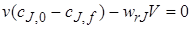
Очевидно, что уравнение (5.6) тождественно уравнению (5.5).
Величина 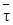
Действительное время пребывания частиц в проточном реакторе смешения является случайной величиной в отличие от времени пребывания реагентов в периодическом реакторе. Пусть, например, в реактор введено N одинаковых частиц. В периодическом реакторе все они будут находиться равное время от загрузки до выгрузки. В проточном реакторе идеального смешения эти частицы мгновенно и равномерно распределяются по всему объему аппарата, и так как из аппарата непрерывно выходит поток продуктов, то в момент ввода частиц в реактор какое-то их количество может сразу же оказаться в выходном потоке. Некоторые частицы, равномерно распределяясь в новых порциях реакционной смеси, вошедшей в аппарат, могут находиться в нем бесконечно долго. Отсюда можно сделать вывод, что действительное время пребывания частиц в проточном реакторе – это случайная величина, которая может изменяться от 0 до ∞. Непрерывную случайную величину можно задать с помощью вероятностных характеристик, в частности функций распределения случайной величины. Использование в качестве характеристики времени пребывания частиц в проточном реакторе величины 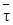
Для решения практических задач удобно концентрацию реагента cJ,fвыразить через его степень превращения хJ,f:
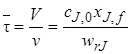
Уравнения материального баланса (5.5)–(5.7) для проточного реактора идеального смешения в стационарном режиме имеют ряд отличий от соответствующих уравнений для периодического реактора (5.2) и (5.3). Следует отметить, что балансовые уравнения стационарного реактора идеального смешения записываются сразу в виде конечного алгебраического уравнения в отличие от дифференциальной формы исходных уравнений для периодического реактора.
В уравнение для периодического реактора скорость wr,Jследует подставлять в виде функциональной зависимости от концентрации wr,J(cj) или степени превращения wr,J(xj) и лишь после интегрирования уравнения возможна подстановка числовых значений. Этот факт, как и дифференциальная форма уравнений материального баланса, отражает зависимость параметров процесса в периодическом реакторе от времени. В стационарном режиме в любой точке реактора идеального смешения в любой момент времени концентрация постоянна. Следовательно, скорость реакции характеризуется каким-то одним конкретным числовым значением, определяемым этой концентрацией. Это число может быть сразу поставлено в уравнение материального баланса.
Пример 5.1.Рассчитать среднее время пребывания реагентов в проточном реакторе идеального смешения, необходимое для достижения степени превращения исходного реагента хА,f= 0,8.
В реакторе протекает реакция второго порядка 2А 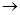
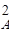
Решение. Для определения 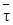
Таким образом, для достижения степени превращения хА = 0,8 необходимо, чтобы соотношение между объемом реактора и объемным расходом через него 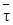
Уравнения материального баланса для проточного реактора могут быть использованы не только для определения среднего времени пребывания 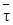
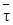
Решение этой задачи не вызывает никаких затруднений, если скорость реакции описывается сравнительно простыми кинетическими уравнениями (уравнениями первого и второго порядка). Например, для реакции первого порядка А 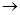
Зачастую скорость сложных реакций с невыясненным до конца механизмом выражают в виде кинетических уравнений дробного порядка. В этом случае аналитическое решение оказывается невозможным и приходится прибегать к численным методам расчета. В качестве примера рассмотрим весьма наглядный графический метод определения концентрации реагентов на выходе из стационарного проточного реактора идеального смешения.
Запишем уравнение материального баланса (5.5) в следующем виде:
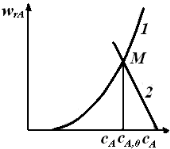
Уравнение (5.8) представляет собой равенство двух разных функций от концентрации. В левой части уравнения записана функция wrА(сА), представляющая собой кинетическое уравнение реакции. В соответствии с законом действующих масс скорость химических реакций пропорциональна концентрациям реагентов, следовательно, wrA(cA) – это возрастающая функция, которую легко представить графически (рис. 5.3, линия 1). Она пересекает ось абсцисс в точке, соответствующей равновесной концентрации сА,е для обратимых реакций, или исходит из начала координат в случае необратимых реакций.
Рис. 5.3. Зависимость скорости реакции от концентрации реагента
на выходе из проточного реактора идеального смешения,
используемая для определения конечной концентрации
В правой части уравнения (5.8) записана соответствующая уравнению материального баланса стационарного реактора идеального смешения линейная функциональная зависимость скорости реакции от концентрации исходного реагента, имеющая отрицательный угловой коэффициент (–1/ 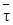
Уравнению (5.8) удовлетворяют такие значения концентраций сА, при которых значения функций, стоящих в левой и правой частях этого уравнения, равны. Иначе – такие концентрации, при которых графики этих функций пересекаются. Как видно, линии 1 и 2 пересекаются в единственной точке М.Абсцисса этой точки и есть искомая концентрация реагента на выходе из реактора идеального смешения.
Дата добавления: 2015-06-17 ; просмотров: 7958 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
ОХТ(шпоры). УКлассификация технологических процессов механические и химические технологии промышленность неорганических веществ промышадность органических веществ (включая производство и переработку пищевых продуктов)
| Название | УКлассификация технологических процессов механические и химические технологии промышленность неорганических веществ промышадность органических веществ (включая производство и переработку пищевых продуктов) |
| Анкор | ОХТ(шпоры).docx |
| Дата | 24.04.2017 |
| Размер | 3.28 Mb. |
| Формат файла |  |
| Имя файла | ОХТ(шпоры).docx |
| Тип | Документы #2923 |
| страница | 7 из 13 |
Подборка по базе: Л1-1) МЕХАНИЧЕСКИЕ СВОЙСТВА ГРУНТОВ-2.docx, Лабораторная работа №2 Изучение процессов.docx, 1 Механические повреждения двигателей (Автосохраненный).docx, Моделирование процессов упругого и неупругого ударов (1).pdf, АВТОМАТИЗАЦИЯ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ.pdf, Определение основных параметров производственного и технологичес, Теория информационных процессов и систем.docx, Моделирование экономических процессов.docx, моделирование экономических процессов.docx, практическая моделирование экономических процессов.docx2 Реакторы идеального смешения непрерывного действияНепрерывный реактор идеального смешения (РИС-Н) – это реактор с мешалкой, в который непрерывно подают реагенты и выводят из него продукты реакции (рис. 2.7). Благодаря интенсивному перемешиванию потоков мгновенно устанавливается одинаковая по всему объему реактора концентрация реагента CA, равная его концентрации на выходе из реактора (рис. 2.7). Резкое изменение концентрации при выходе реагентов в реактор происходит за счет мгновенного смешения поступающих реагентов с реакционной массой, уже имеющейся в реакторе, где концентрация компонента А значительно ниже, чем в подаваемой реакционной смеси.
Величина перепада между начальной CAo и конечной концентрацией CA исходного реагента зависит при прочих условиях от величины скорости химической реакции. Чем она выше, тем меньше концентрация реагента А в реакторе и больше перепад CAo – CA. С другой стороны, при одной и той же скорости реакции величина перепада зависит от времени пребывания реагентов в реакторе, . Чем больше , тем полнее проходит реакция, и тем ниже концентрация реагента, CA, в реакционной смеси (рис. 2.8). Точка, соответствующая входу реагентов в реактор, нанесена на оси абсцисс правее начала координат, что дает более наглядное представление об изменении концентрации при входе реакционной смеси в реактор.
Так как концентрация реагентов в проточном реакторе идеального смешения одинакова во всех точках реакционного объема, то постоянны по объему и другие параметры – степень превращения и скорость реакции (рис 2.9). Поэтому материальный баланс по какому-либо компоненту, необходимый для получения характеристического уравнения, составляют в конечных величинах (по разности концентраций реагента на входе в реактор и выходе из него), то есть используют уравнение (1.7):
Из уравнения (2.46) видно, что условием стационарности процесса является равенство скорости конвективного переноса вещества А и скорости его химического превращения.
При стационарном режиме ВАнак.= 0, и
Найдем значения величин, входящих в уравнение (2.46). Так по уравнению (1.6)
Подставляя (2.47-2.49) в (2.46), получаем:
или, учитывая, что ВAo = CAoV, где V – объемный расход реагентов, имеем:
Отношение Vr/V – это условное время пребывания, (см. уравнение (2.17)). Тогда
Это характеристическое уравнение реактора идеального смешения. Для более общего случая, когда начальная степень превращения xAo не равна нулю, оно записывается
Для простой необратимой реакции n-го порядка с учетом уравнения (2.7) уравнение (2.52) принимает вид:
Реактор идеального смешения непрерывного действия (РИС-Н). Для реакции нулевого порядка: CA0xA=CA0—CA
Для реакции первого порядка
Единичный реактор идеального смешения не дает высокой степени превращения, так как концентрация исходных реагентов в нем мгновенно падает до конечного значения. Поэтому применяют ряд последовательно расположенных непрерывных реакторов смешения – каскад реакторов – К-РИС (рис. 2.15). Концентрация CА в такой системе падает до конечного значения не сразу, а постепенно, от реактора к реактору (рис. 2.16). В каждом реакторе концентрация компонента в объеме постоянна и равна концентрации на выходе из реактора. Изменение концентрации в реакторах происходит мгновенно скачком при входе реакционной смеси в реактор. Рабочая концентрация CA в каскаде реакторов в общем выше, чем в единичном реакторе смешения и приближается с увеличением числа реакторов к значению ее в реакторе вытеснения. Чем больше степеней изменения концентрации в каскаде m (чем больше реакторов), тем больше каскад реакторов приближается к реактору идеального вытеснения (рис.2.16). Выдача расчета каскада реакторов заключается в определении числа ступеней (числа реакторов) – m, необходимых для достижения заданной степени превращения xA.
Существуют аналитический и графический методы расчета каскада реакторов. Аналитический метод выгодно применять при протекании реакции первого порядка, а для реакций более высоких порядков удобнее второй – графический метод.
Для расчета каскада реакторов необходимо: 2) знать концентрацию исходного реагента А на входе в первый реактор, CAo, и на выходе из последнего реактора, CAm, то есть общую степень превращения xA, 3) задаться объемом единичного реактора (то есть временем пребывания в единичном реакторе смешения, см), при этом предполагают, что объемы единичных реакторов в каскаде равны. Для единичного m-го реактора идеального смешения, исходя из уравнения (2.52), имеем:
Из уравнения (2.70) можно найти скорость процесса в реакторе. Для этого представим его в таком виде:
Концентрация реагента на входе в реактор, CAm-1, и время пребывания, см, – величины известные и постоянные, так как даются по условию. Таким образом, из уравнения (2.71) следует, что скорость реакции (- rA) линейно зависит только от концентрации на выходе, CAm. Если эту зависимость выразить графически, то прямая, описываемая уравнением (2.71), пересекает ось абсцисс в точке СAm-1 и имеет тангенс угла наклона , равный
Поэтому, для нахождения концентрации реагента на выходе из первого реактора, CA1, необходимо из точки CAo, лежащей на оси абсцисс, провести прямую с тангенсом наклона Если опустить перпендикуляр из точки пересечения прямой и кривой (точка М, см. рис. 2.17), то на оси абсцисс можно получить значение концентрации CA1 в первом реакторе. Эта же концентрация является входной для второго реактора. Для нахождения концентрации во втором реакторе CA2 операция повторяется из точки CA1. Такие операции продолжают повторять до тех пор, пока в последнем реакторе не будет достигнута заданная конечная концентрация CAк. Так как время пребывания во всех реакторах одинаково, то постоянен угол наклона прямых и, следовательно, они параллельны. Число ступеней изменения концентрации и будет числом реакторов в каскаде, необходимым для достижения заданной степени превращения xAк. Как было показано ранее, с увеличением числа реакторов в каскаде характер изменения параметров в нем приближается к реактору идеального вытеснения. Поэтому при увеличении числа реакторов в системе будут сильнее проявляться все свойства, присущие реактору идеального вытеснения, и наоборот. В качестве примера на рисунке 2.18 приведена зависимость степени превращения от величины k (где k – константа скорости реакции) для реакции первого порядка в каскаде с различным числом реакторов m; произведение k характеризует общий объем системы.
Из рисунка 2.18 видно, что при одинаковом объеме каскада (k) степень превращения xA повышается с увеличением числа реакторов в каскаде, приближаясь к степени превращения, получаемой в реакторе идеального вытеснения ( при m ). Если же сравнить каскады, где получена одна и та же степень превращения xA, то общий объем системы будет меньше там, где взято большее число реакторов [(k)2 размер реактора ( то есть его интенсивность), избирательность процесса , то есть селективность и выход продукта . Для простых реакций имеет значение только первый фактор, то есть размер реактора, необходимый для достижения заданной степени превращения xA, поэтому рассмотрим вначале этот более простой случай. В реакторе вытеснения наблюдается постепенное изменение концентрации по длине реактора, а в реакторе смешения – резкое падение концентрации до конечного значения CA (рис. 2.10). Такой же характер (рис. 2.11) имеет для этих реакторов изменение скоростей реакции (при постоянной температуре).
Из рисунка 2.11. видно, что средняя скорость реакции в реакторе идеального смешения всегда ниже, чем в реакторе вытеснения.
Для необратимых реакций, порядок которых n=0, это не оказывает влияния на интенсивность процесса (для таких реакций скорость не зависит от концентрации реагента) и на выбор типа реактора, что и следует из уравнений (2.14) и (2.55). Таким образом
Для реакций, порядок которых n>0, тип реактора имеет важное значение, так как для достижения одинаковой степени превращения в реакторе смешения нужно большее время, чем в реакторе вытеснения (см >выт) и, следовательно, его интенсивность ниже. Для необратимых реакций первого порядка это можно показать, исходя из уравнений (2.17) и (2.56):
из которых следует, что см>выт, поскольку при изменении xA от 0 до1:
Неравенство (2.58) тем значительнее, чем больше xA (рис. 2.12).
Сопоставление характеристик реакторов для реакции любого и особенно высокого порядка часто отражают графически. Для реактора вытеснения время выт, необходимое для достижения заданной степени превращения xA, выражается уравнением (2.36)
Для реактора смешения см выражается уравнением:
Из уравнений (2.36) и (2.59) следует, что отношение площадей Sсм и Sвыт равно отношению условных времен пребывания реагентов в реакторах смешения и вытеснения (то есть объемов реакторов):
Для сложных реакций судить об эффективности реактора по его размерам (по степени превращения) недостаточно. Для сложных реакций реактор должен еще обеспечивать и необходимую селективность процесса. Для реакций, селективность которых зависит от концентрации реагента (когда порядки основной и побочной реакций различны), на селективность можно повлиять, выбирая определенный тип реактора. Например, для параллельных необратимых реакций:
Селективность Значения rRи rS определяются по уравнениям:
Следовательно:
Из уравнения (2.65) видно, что для каждого конкретного случая, когда известен порядок основной и побочной реакции, селективность зависит только от концентрации CA, так как отношение констант скорости реакций k1/k2 при постоянной температуре величина постоянная. Если порядок основной реакции выше порядка побочной реакции (n1 – n2>0), то для получения высокой селективности (большого отношения Когда же порядок основной реакции ниже порядка побочной реакции (n1—n2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | (2.66) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Следовательно, в этом случае тип реактора не влияет на селективность, и ее можно изменять, меняя соотношение констант скоростей, а для этого нужно применять катализатор селективного действия, либо изменять температуру, так как по Аррениусу:
 и и  |
Поскольку два основных требования – наименьший размер реактора и селективность – являются часто взаимоисключающими факторами, расчет должен быть направлен на удовлетворение одного из требований. На вопрос, какое из требований целесообразнее удовлетворить, можно ответить после проведения технико-экономического анализа.
В том случае, когда n1 – n2
 ,
,NR – количество продукта R в реакционной смеси в рассматриваемый момент времени;
NRmax – максимально возможное количество R, полученной по данной реакции.
Выбор реактора производится комплексно с учетом связи между xA, GR и ФR.
Для реактора идеального смешения связь между приведенными параметрами для необратимой реакции:
| R |
описывается соотношением:
 | (2.68) |
Для РИВ степень превращения xA и селективность GR меняются по длине реактора, поэтому для реактора вытеснения:
 | (2.69) |
Графическое представление зависимости селективности GR от степени превращения xA позволяет непосредственно выбрать оптимальную модель реактора для достижения максимального выхода ФR. Согласно соотношениям (2.68) и (2.69) выход ФR, достигаемый в реакторе идеального вытеснения, представляется на графике площадью под кривой между значениями xAo и xA (рис. 2.14), выход же в реакторе смешения – площадью прямоугольника со сторонами, равными xA – xAo и GR.
 |
| а – селективность уменьшается с повышением степени превращения; б – селективность увеличивается с повышением степени превращения. Фсм, Фвыт – выход продукта в РИС-Н и РИВ |
| Рис. 2.14 – Зависимость селективности от степени превращения |
Если селективность уменьшается с ростом степени превращения (когда n1 – n2 >0), то есть при снижении CA (рис. 2.14a), для получения большого выхода ФR необходим реактор вытеснения, так как площадь под кривой для этого реактора будет больше Sвыт>Sсм. Если селективность увеличивается с ростом xA (когда n1 – n2 Sвыт (рис. 2.14б).
- Условное и истинное время пребывания в ректоре. Отклонение реальных реакторов от идеализированных.
- Классификация реакторов по тепловому режиму.
В зависимости от теплового режима реакторы разделяются на три группы: адиабатические , изотермические и политропические .
В адиабатическом реакторе отсутствует теплообмен с окружающей средой, и тепло химической реакции полностью расходуется на изменение температуры реакционной смеси.
В изотермическом реакторе путем подвода или отвода тепла поддерживают постоянную температуру в течение всего процесса.
В политропическом реакторе температура не постоянна, при этом часть тепла отводится или подводится.
Адиабатический и изотермический реакторы представляют предельные случаи, которых на практике не бывает, но режим многих реакторов приближается к этим крайним моделям, поэтому с достаточной для практических целей точностью реакторы могут рассчитываться по уравнениям, полученным для адиабатических и изотермических режимов.
Исходным уравнением для расчета реакторов с учетом переноса тепла уравнение теплового баланса, которое обычно составляют по одному из компонентов реакционной смеси.
- Уравнение теплового баланса реактора.
Тепловой баланс в общем виде можно представить уравнением:
 , , | (3.1) |
| где Qприх – количество тепла, поступающего в реактор в единицу времени; Qрасх – количество тепла, расходуемое в единицу времени. | |
Рассмотрим случай, когда простая необратимая реакция (1.2) протекает с выделением тепла, т.е.:
| А R + Qхр | (3.2) |
Тогда приход тепла можно записать в виде:
   , , | (3.3) |
| где Qхр – количество тепла, выделяющееся в результате химического превращения вещества А, в единицу времени; Qреаг– количество тепла, вносимое исходными реагентами, поступающими в реактор, в единицу времени. | |
Расход тепла может быть представлен уравнением:
 , , | (3.4) |
| где: Qпрод – количество тепла, уносимое из реактора продуктами реакции, в единицу времени; Qнак – количество тепла, накапливающееся в реакторе в единицу времени; QТ – количество тепла, расходуемое в единицу времени в результате теплообмена с окружающей средой. | |
Подставив значения Qприх и Qрасх (3.3 и 3.4) в уравнение, получаем:
  | (3.5) |
После перестановки членов уравнения (3.5) может быть записано в таком виде:
  | (3.6) |
Разность между теплом, уносимым из реактора нагретыми продуктами реакции и теплом, вносимым в реактор исходными реагентами, представляет конвективный поток тепла:
  | (3.7) |
С учетом выражения (3.7) уравнение (3.6) примет вид:
 | (3.8) |
Уравнение теплового баланса (3.8) может принимать различную форму в зависимости от типа реактора и теплового режима процесса.
В общем случае имеет место изменение параметров процесса (температура, концентрация и др.) по объему реактора или по времени, в связи с чем тепловой баланс (так же, как и материальный) составляют в дифференциальной форме.
Для этой цели используют дифференциальное уравнение конвективного теплообмена (А.Г. Касаткин, Основные процессы и аппараты в химической технологии, 1971, стр. 294), в которое вводят дополнительные члены, учитывающие отвод тепла в результате теплообмена) и тепло реакции; с такими дополнениями уравнение имеет вид:
 | |
| где – плотность реакционной смеси; Ср – удельная теплоемкость реакционной смеси; x ,y, z – пространственные координаты; – коэффициент молекулярной и турбулентной теплопроводности реакционной смеси; K – коэффициент теплопередачи; T – температура реакционной смеси; TТ – температура в теплообменнике; r – скорость химической реакции; H – тепловой эффект реакции. | |
Группа членов левой части уравнения (3.9) выражает скорость накопления тепла в элементарном объеме, для которого составляется тепловой баланс. Этому члену соответствует величина Qнак, уравнение (3.8), т.е.:
 | (3.10) |
Первая группа членов первой части уравнения (3.9) отражает конвективный перенос тепла по соответствующим координатам (x, y, z) в элементарном объеме.
Вторая группа членов правой части уравнения (3.9) отражает изменение тепла, связанное с теплопроводностью реакционной среды ().
Суммарному переносу тепла конвективным потоком, отражаюшим влияние теплопроводности (обратная диффузия), соответствует в уравнении (3.8) член Qконв, в результате чего можно записать:
 | (3.11) |
Из сравнения уравнений (3.8) и (3.9) далее следует:
    | (3.12) |
 | (3.13) |
Решение уравнения (3.9) часто связано с большими трудностями. Однако, как будет показано ниже, в зависимости от характера протекающей реакции, гидродинамического и теплового режимов в реакторе, значение отдельных членов уравнения становится пренебрежительно мало, что приводит к более простым уравнениям, обеспечивающим достаточно точные решения самых разнообразных практических задач.
Уравнения (3.8) и (3.9) представляют математическое описание потоков тепла в нестационарном режиме, когда имеет место накопление тепла и температура процесса меняется во времени.
Для реакторов непрерывного действия характерен стационарный режим. Неустановившееся состояние наблюдается только в пусковой период и в период остановки реактора.
В дальнейшем все реакторы непрерывного действия будут рассматриваться только в стационарном режиме, когда отсутствует накопление тепла, т.е. Qнак = 0.
В реакторах периодического действия режим всегда нестационарный: происходит накопление тепла в результате химического превращения, и температура в любой точке реактора меняется во времени, т.е. Qнак 0.
С другой стороны, в реакторах периодического действия отсутствует конвективный перенос тепла и член Qконв= 0.
Из приведенных примеров следует, что для описания конкретных типов реакторов уравнения (3.8) и (3.9) приобретут более простой вид. Форма уравнения теплового баланса определяется также тепловым режимом в реакторе, что будет показано в дальнейшем.
Ниже даются выводы уравнений тепловых балансов и способы их решения для различных типов реакторов, работающих в различных тепловых режимах.
- Адиабатический режим реакторов различного типа.
- Изотермический режим реакторов различного типа.
- Политропический режим реакторов с различным гидродинамическим режимом. Примеры.
- Условия поддержания устойчивого режима работы реактора. Параметрическая чувствительность.
- Выбор типа реактора с учетом теплового режима. Создание оптимального теплового реакторах в реакторах. Примеры.
- Устройство реакторов для гомогенных процессов.
Периодические процессы в гомогенной системе проводят в резервуарах, кубах или автоклавах, в которых реакционную смесь перемешивают каким-либо способом (рис. 4.1,в). Гораздо более разнообразны непрерывные реакторы для гомогенных систем. Это может быть и трубчатый реактор (рис. 4.1,е) и кубовый реактор с мешалкой (рис. 4.1,а), а также различные системы из этих реакторов. На рисунке 4.1 показаны основные типы реакторов для проведения гомогенных процессов.
 |
| а – кубовый реактор непрерывного действия с перемешиванием; б – реактор полупериодического действия с перемешиванием; г – каскад кубовых реакторов непрерывного действия; д – то же, с распределением сырья; е – трубчатый реактор непрерывного действия; ж – то же, с предварительным смешением сырьевых потоков; з – трубчатый реактор непрерывного действия с поперечным распределением сырья; и – охлаждаемый однотрубный реактор; к – многотрубный реактор с теплообменом. |
| Рис. 4.1 – Основные типы реакторов и некоторые формы реакторных систем для проведения гомогенных реакций |
- Устройство реакторов для гетерогенных некаталитических процессов в системах Г-Т, Ж-Т, Ж-Ж, Примеры.
При создании реакторов для гетерогенных процессов, необходимо принимать во внимание несколько усложняющих факторов, помимо тех, что рассматривались для гомогенных процессов. Эти факторы в значительной степени определяют конструкцию реактора.
Во-первых, в гетерогенных системах компоненты находятся в различных фазах и процессы связаны с переносом вещества через поверхность соприкосновения фаз. Значительное влияние оказывают на процесс физические факторы: величина и состояние поверхности раздела фаз, диффузия вещества из одной фазы к поверхности и в объем второй фазы, а также обратная диффузия образовавшихся продуктов внутри этой фазы к ее поверхности и затем в объем первой фазы. Поэтому конструкция реакторов для гетерогенных процессов должна обеспечивать наилучшие условия для массопередачи, создавать большую поверхность соприкосновения фаз. В ряде случаев конструкция аппарата должна также создавать условия для обновления поверхности контакта фаз. При разработке гетерогенного процесса необходимо учитывать, что правильно подбирая конструкцию аппарата, можно в значительной степени интенсифицировать процесс, переводя его из одной области протекания в другую, например, снимая при интенсивном перемешивании диффузионное сопротивление, можно перевести процесс из диффузионной области в кинетическую и в дальнейшем повышать уже скорость химической реакции.
Во-вторых, в гомогенных процессах мы имеем какой-либо один из известных нами режимов движения реагентов (либо смешение, либо вытеснение, либо промежуточный режим). В гетерогенных же системах каждая фаза может иметь свой режим. поэтому, возможны различны комбинации режимов контактирующих потоков.
И, наконец, конструкция реактора будет зависеть от конкретного вида фаз, участвующих в реакции. Так, аппараты для осуществления реакции в системе газ–твердое (Г-Т) отличаются по конструкции от аппаратов для системы газ–жидкость (Г-Ж). Поэтому, ниже будут рассматриваться конструкции аппаратов отдельно для каждой из наиболее распространенных гетерогенных систем.
Математические модели процессов в идеальных реакторах
Читайте также:
|
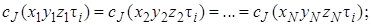
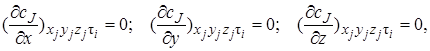
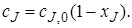
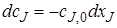
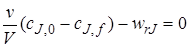
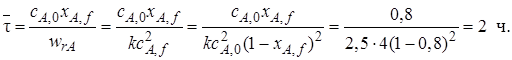
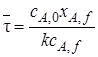
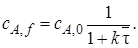





 ,
, ;
; ,
, ;
; =
=










 (рис.2.17). Для нахождения концентрации в m-ом реакторе необходимо уравнение (2.71) решить совместно с кинетическим уравнением (2.11), то есть:
(рис.2.17). Для нахождения концентрации в m-ом реакторе необходимо уравнение (2.71) решить совместно с кинетическим уравнением (2.11), то есть:

 до пересечения с кривой —rA=f(CA) в точке М.
до пересечения с кривой —rA=f(CA) в точке М.


 ,
, ,
, ,
,

 ,
, ,
, и
и  .
.

 (основная реакция порядка n1),
(основная реакция порядка n1), (побочная реакция порядка n2)
(побочная реакция порядка n2) зависит от отношения скоростей образования целевого продукта rR и побочного rS , то есть
зависит от отношения скоростей образования целевого продукта rR и побочного rS , то есть  .
. ,
, .
.
 ) необходимо поддерживать концентрацию реагента А на максимальном уровне. Следовательно, для этого следует применять реактор вытеснения, так как средняя текущая концентрация CA в нем выше, чем в реакторе смешения.
) необходимо поддерживать концентрацию реагента А на максимальном уровне. Следовательно, для этого следует применять реактор вытеснения, так как средняя текущая концентрация CA в нем выше, чем в реакторе смешения.

















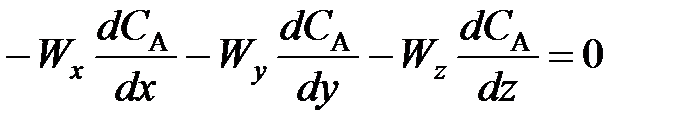 ; (77)
; (77) (78)
(78)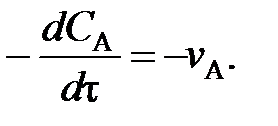 (79)
(79) . Поэтому перед
. Поэтому перед 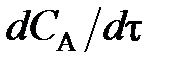 и vA ставят знак «–», чтобы скорость являлась положительной величиной.
и vA ставят знак «–», чтобы скорость являлась положительной величиной. (80)
(80)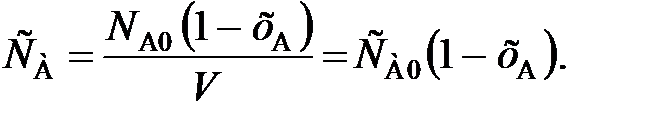 (81)
(81)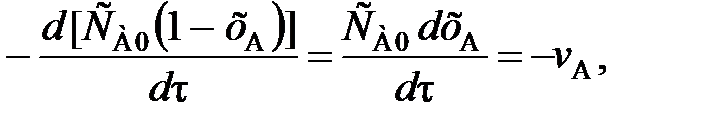 (82)
(82)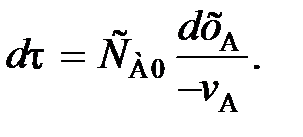 (83)
(83)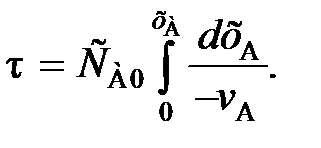 (84)
(84)
 (85)
(85)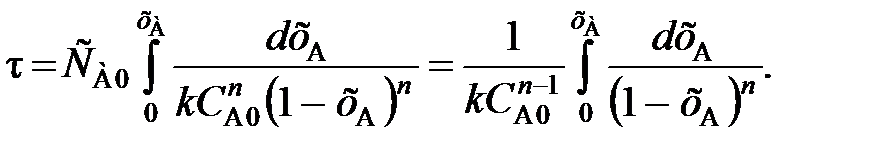 (86)
(86)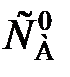 = k. (87)
= k. (87)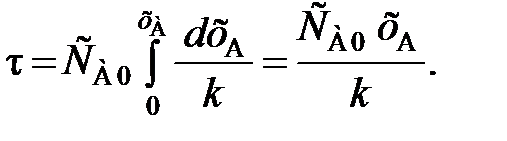 (88)
(88)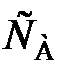 = k
= k 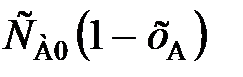 , (89)
, (89)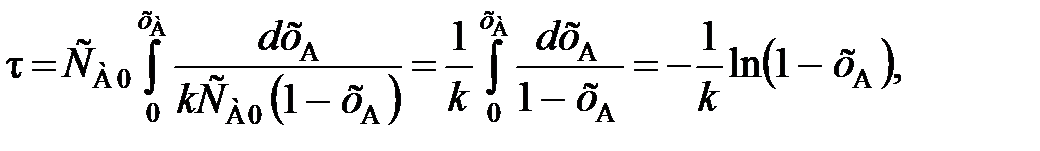 (90)
(90)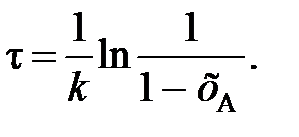 (91)
(91)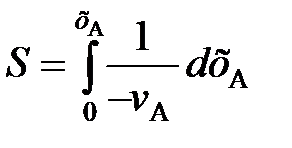 . (92)
. (92)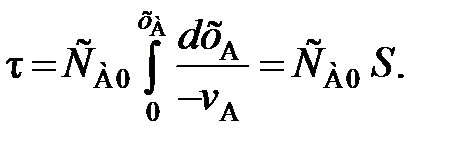 (93)
(93)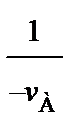
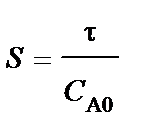
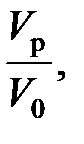 (94)
(94)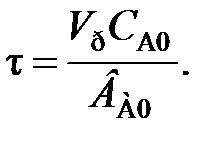 (95)
(95)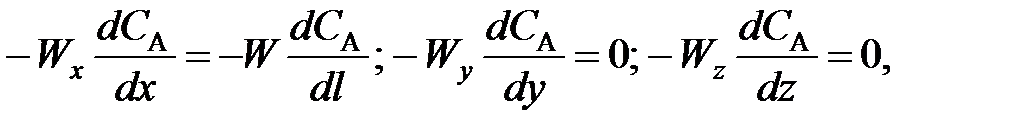 (96)
(96)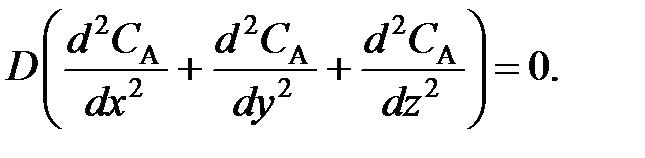 (97)
(97)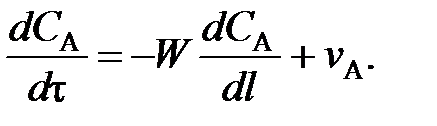 (98)
(98)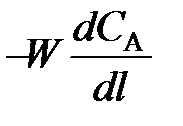 и от расхода вещества на химическую реакцию vА.
и от расхода вещества на химическую реакцию vА. (99)
(99)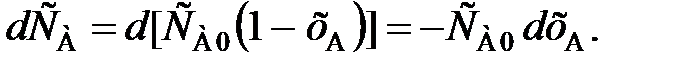 (100)
(100)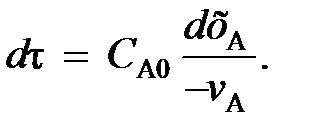 (102)
(102)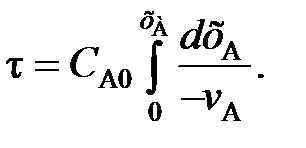 (103)
(103)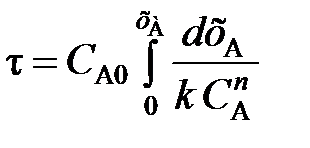 (104)
(104)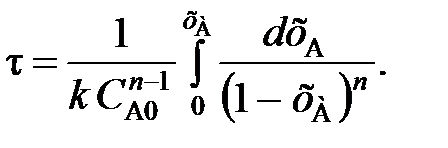 (105)
(105) (106)
(106)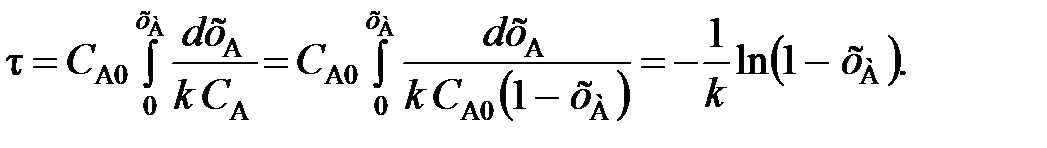 (107)
(107)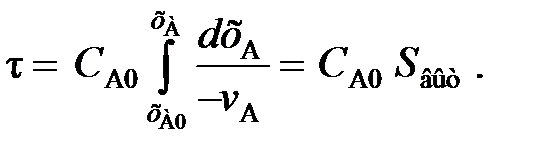 (108)
(108)
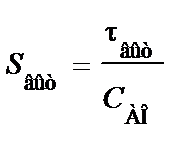
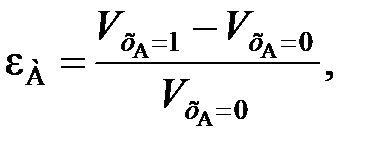 (109)
(109)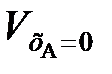 ,
, 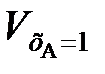 – объемы реакционной смеси соответственно при хА = 0 и хА = 1.
– объемы реакционной смеси соответственно при хА = 0 и хА = 1.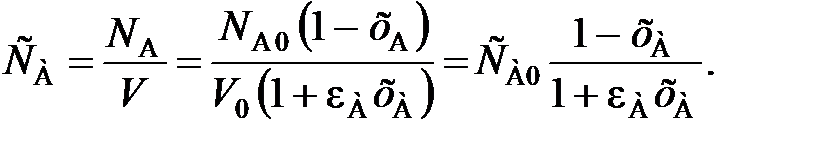 (111)
(111)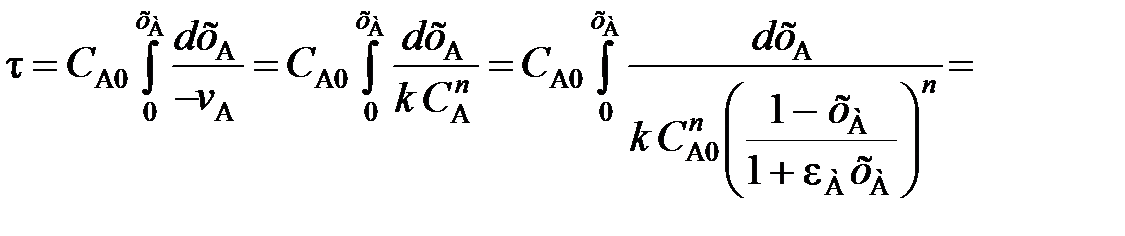
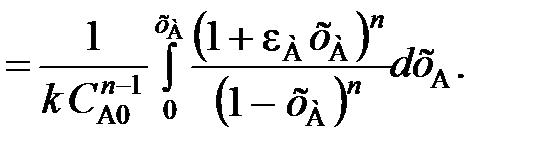 (112)
(112)