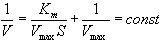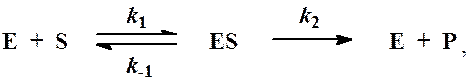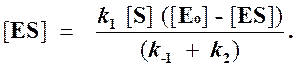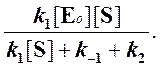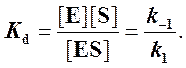Это и есть уравнение Михаэлиса-Ментен.
Вариант 3.
Уравнение Михаэлиса – Ментена, его вывод и анализ приложенности к описанию зависимости начальной скорости ферментативных реакций от концентрации субстрата.
ВЫВОД И АНАЛИЗ УР МИХАЭЛИСА-МЕНТЕН
Михаэлис и Ментен предположили, что мех-м ферм р-й описывается моделью:
При формулировке кинетического выражения для скорости ферментативной реакции Михаэлис и Ментен сделали три допущения:
1) Стационарное состояние реакции в момент равновесия, когда скорости образования и расходования ES равны;
2) Весь фермент в условиях насыщающих концентраций субстрата превращается в энзимсубстратный комплекс ES;
3) Если весь фермент в виде ES, то скорость реакции максимальна и Vmax=k2[ES].
Образование ES: [ES]=k1[S][E] (I)
Расходование ES: [ES]=k-1[ES]+k2[ES] (II)
Приравнивая выражения (I) и (II) и сокращая обе части на k1 получаем:
[S][E] = [ES](k-1 + k2)/k1 = [ES]Km, где Km = (k-1 + k2)/k1
Выразим равновесную концентрацию [E] через начальную [Eo]: [E] = [Eo] — [ES]
[S]([Eo]-[ES])= [ES]Km, переносим [S] в правую часть выражения и делим обе части на [ES]:
Поскольку трудно (если не невозможно) измерить [ES], произведем замену с учетом того, что в насыщающих концентрациях [S] весь [Eo] перейдет в [ES] и максимальная скорость при этом будет равна Vmax=k2[ES]=k2[Eo].
В это же время скорость реакции равна V=k2[ES]. Через отношение этих скоростей выразим [Eo]/[ES]:
В уравнении (III) произведем замену отношения [Eo]/[ES] на Vmax/V и получаем:
Это и есть уравнение Михаэлиса-Ментен.
Ограничения кинетики Михаэлиса-Ментен
Михаэлис и Ментен вывели уравнение с учетом двух предположений (быстро устанавливающееся равновесие и избыток субстрата). Позднее было показано, что уравнение справедливо, то есть хорошо описывает реакцию, при выполнении всех следующих условий.
7 основных постулатов для выполнения уравнения Михаэлиса-Ментен.
1. В ходе реакции образуется кинетически устойчивый фермент-субстратный комплекс.
2. Определяемая с помощью уравнения константа Кs является константой диссоциации фермент-субстратного комплекса: это справедливо, только если k2
V = Vmax[S]/(Km+[S]) — ур михаэлиса-ментен
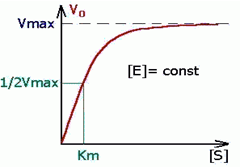
Граф зав-сть для ур имеет вид: Кривая уравнения Михаэли-са-Ментен: гиперболическая зависимость начальных скоростей катализируемой ферментом реакции от концентрации субстрата.
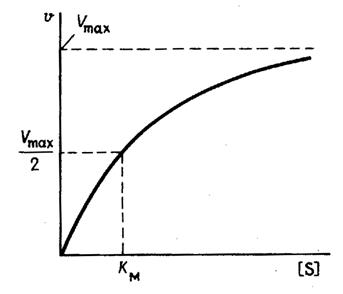
Константа Михаэлиса измеряется в молях на литр и бывает от 10-2 до 10-7, чем меньше Кm, тем активнее фермент. При V=1/2Vmax, имеем Km = [S]. Однако, определение Vmax затруднительно по асимптоте. Для устранения этого неудобства ЛАЙНУИВЕР и БЭРК приравняли обратные зависимости левой и правой частей уравнения.
Своеобразие проявления второго закона термодинамики в биологических системах.
— ограничивает переход какой –либо Е в работу или в другой тип энергии. Ни какой тип Е не может перейти в работу с КПД – 100%.
1) не возможно перевести тепло от более холодной системы к более горячей без соответствующих изменений в этих системах и в окр. среде, т.е нельзя закипятить стакан с водой в холодильнике.
2) Самопроизвольно могут протекать лишь те процессы, которые связаны с переносом Е от более высокого уровня к более низкому, т.е. по градиенту.
3) Невозможно совершить работу против градиента без соответствующих изменений.
Градиент — векторная величина, разность величин того или иного параметра в 2-х точках, отнесенных к расстоянию между ними. Градиент концентрации – это концентрация «в» и «извне» на толщину мембраны (осмотич. градиент, концентрационный гр. (транспорт ионов и др. в-в), электрический гр.).
Все процессы, протекающее в природе, подчиняются первому закону ТД, однако не всякий возможный процесс осуществим на практике. Исходя из первого закона, нельзя определить направление самопроизвольного процесса. Второй закон ТД позволяет предсказать направление пр-са при заданных усл.. В отл. от 1 закона ТД он не носит всеобщего характера и применим лишь к сист., сост. из большого числа частиц.
14. Доказательства применимости второго закона ТД к биосистемам.
Применимость второго закона ТД к биосистемам:
1. Второй закон ТД был сформулирован для характристики изолированных систем. Реальные био системы являются открытыми.
2. Значение энтропии строго определено для равновесного состояния. Био системы в своем развитии проходят через целый ряд неравновесных состояний.
Развитие орг-мов сопровождаются усложнением их организации – это самопроизвольное ↓ энтропии живых систем. В реальных усл. развитие орг-мов, сопр-ся ↓ общей величины их энтропии за счет того, что в др. участках внешней среды идут сопряженные процессы с обр-нием положительной энтропии. Суммарное изменение энтропии в системе организм + внешняя среда всегда положительно.
Био системы характеризуются наличием большого кол-ва градиентов (осмотический, электрический, концентрационный). Градиент какого-либо т/д параметра изменяется с расстоянием. Биосистема способна совершать работу, если в ней имеется градиент. Градиент – своеобразное депо энергии.
Совершение работы в системе связано с реализацией этой свободной энергии. Если совершается работа, то градиент, за счет Е которого это происходит, ↓, но параллельно возникает другой градиент противоположной направленности. При необратимых пр-сах величина второго градиента будет меньше, чем величина первого.
Вариант 1.
Закон термодинамики, закон Гисса, термодинамическое равновесие, стационарные системы.
8. Первый закон ТД в биологии; доказательства его применимости к живым системам. Своеобразие проявления первого закона ТД в биосистемах.
Закон: работа совершаемая системой = разности м/у количеством теплоты, сообщаемой системой и изменением её внутр. Е: ∆А = ∆Q — ∆U. Закон – это количественная форма закона сохранения энергии. Кол-во теплоты, поступающей в систему расходуется на ↑ внутр. Е системы за вычетом совершенной работы.
Внутренняя Е (U) – сумма (совокупность) всех типов Е и взаимодействий входящих в систему частиц. (Е вращательного движения атомов, Е взаим-вия водородных атомов).
Работа биоситемы может совершаться за счёт энтропии и внутр. Е (но не внеш. теплоты, т.к. если бы можно было за счёт притока из вне биосист. нагревались бы 1740С, см. ниже в этом же вопросе – это типа своеобразие закона) (это следствие 1 закона).
Доказательство справедливости закона для био систем: 1780 Лавуазье и Лаплас опыт с морскими свинками. Е хим. связей в белках, жирах и углеводах переходит в тепловую – метод непрямой (?) калориметрии. Свинок кормили – мерили тепло, столько же хавчика сжигали – тоже мерили, сравнили, получили числа одного порядка. По умному: совпадение тепловых эффектов при прямом сжигании продуктов и при их окислении в орг-ме морской свинки свид-т о том, что пути превращения прод-в питания в метаб-ких процессах и хим. р-циях вне живой клетки яв-ся эквивалент-ми с точки зрения суммарных тепловых эффектов. Живые орг-мы не являются источником новой Е. Окисление поступающих в живой организм пит. в-в приводит к высвобождению в нем эквивалетного к-ва Е.
Еще док-во: работа мышцы при 250С (289К = Т), КПД = 30% = 1/3.
Т1 = (298*3) /2 = 447К = 1740С.
Метод прямой калориметрии исполь-ся и на человеке (Этуотер). Исполь-ся герметичная камера: ч/з систему труб подается определ. кол-во О2, считают сколько выд-ся СО2, Н2О и т.д. есть датчики на t. Ограничения: 1) живой объект не должен накапливать массу и расти. 2) жив организм не должен совершать работу (физ. нагрузку). Кол-во Е, поглощенной за сутки чел. орг-мом вместе с пит. в-ми, равно выделенной за это же время теплоте. След-но, закон справедлив для жив. орг-мов.
Метод непрямой калориметрии: С полным и неполным газовым анализом. Ввели коэффициент: при расщеплении 1 мол-лы глюкозы исп-ся 6 мол-л О2, а выделяется 6 мол-л СО2, 6 мол-л Н2О и 678 кал. ДК = выд СО2 в ед времени / погл О2 в ед времени. Производят сравнение состава и объема вдых. и выдых. воздуха. Исп. мешок Дугласа. Для анализа исп. газоанализаторы: ГА Холдейна: система стеклян. трубочек, погл-щая CO2 и O2. Сейчас ГА с поглощением световых потоков. Нормальный дых. коэфф. 0,85±0,03. Нахождение КЭК (калориметрический эквивалент кислорода) – численно равен кол-ву Е, высвобождающейся в организме при потреблении 1 л О2. В клинических условиях исп. неполный ГА, не считают СО2. Считают объем поглощенного О2 с пом. спирографа. Диаграмма под наклоном, из замкнутой системы постепенно уходит О2.
10. Закон Гесса, его применимость к биопроцессам.Следствие закона Гесса, его практическое значение.
Теплоту у теплокровных раздел. на 2 типа:1) первичная (осн. обмен, Q, кот. выд-ся сразу после поглощения пищи при взаимод. с О2, т.е выд-ся в рез-те протекания биохим. проц-ов. В живых орг-мах любая хим. р-ция идет с КПД термин «тепловой эффект р-ции» заменяют термином «энтальпия р-ции». Энтальпия р-ции – это изменение энтальпии системы при протекании химической реакции. Она может быть больше нуля или меньше нуля. Если ∆H > 0, то Q > 0 (эндотермические реакции).
Для равновесного сост. S стремится к мах, U=0. Стац. сост. отличается тем, что S ≠ мах, а является постоянной величиной, S=const, U не равняется 0, U=const. Ежесекундный прирост энтропии стремится к min. Любая живая система может находиться только в стац. сост. Если достигнуто состояние ТД равновесия — это уже не живая система. Качество стационарного состояния может быть различным.
В открытых системах:
S состоит из двух показателей.
Si – внутри самой сист., S — самой системы, Se – внешняя среда.
dS=dSi+dSe (d – это ∆ — это изменение)
Когда dSe > dSi и dSe 0.
Состоянию ТД равновесия — характерно мах значение S (S=max), U=0, т.е. Е, которая расходуется на совершение А.
Сходство: стац. и равновесное состояния не зависят от времени.
Отличия стац. сост. от равновесия (из конспекта):
1) своб. Е (∆G) в стац. сост. есть величина постоянная во времени и не равна 0. В ТД равн. ∆G=const, но ∆G =0 => открытые сист., если вывести из стац. сост. могут совершать работу; при ТД равновесии не способны совершать работу.
2) энтропия. В стац. сост. =const, но она не max. (∆G) ∆S ≠ max = const.
3) . в стац. сост. проявляется кинетический параметр (фактор) (изменение энтропии во времени) dS/dt = dSi/dt + dSe/dt.
* постоянный обмен энергией с окружающей средой
* постоянно тратится свободная энергия на поддержание состояния
* т/д потенциалы постоянны, G и F не равны 0
* энтропия постоянна, но не максимальна
* отсутствует поток вещества и энергии в окружающую среду и обратно
* на поддержание этого состояния не затрачивается свободная энергия
* работа способности системы равна 0, т/д потенциалы равны 0
* в системе отсутствуют градиенты
Переход на новый стац. уровень:
2 пути: 1) «овершот» — по нему переходят живые организмы при изм внеш. усл. (приспособление). График.
Нижняя стрелочка – это старый стац. уровень.
Верхняя стрелочка – это новый стац. уровень.
2) «ложный старт» — усиление или уменьшение О2, выращивание лука с О2 и без. График. С О2 – аэробный распад углеродов. Без О2 – обмен в-в переходит на анаэробный путь. А если потом снова дать О2 – то получится график 2 (то что обведено кружочком – там осущ-ся уничтожение продуктов анаэробного пути). Пример для чела: пока не расщепится молочная к-та осуществлять работу дальше нельзя.
17. Теорема Пригожина и направленность эволюции биосистем. Энтропия и биологический прогресс.
Стац. сост. хар-ся min ежесекундным приростом энтропии (благодаря этому происходит эволюция).
Теорема: при постоянных внеш. усл. в системе, находящейся вблизи положения ТД равновесия в стац. сост., скорость возрастания энтропии, за счёт необходимости внутр. процессов, принимает постоянное минимальное значение отличное от нуля.
Или: В стационарных состояниях при фиксированных внешних параметрах локальная продукция энтропии в открытой т/д системе стремится к минимальному значению.
Энтропия – мера рассеивания свободной энергии, следовательно любая открытая т/д система в стационарном состоянии стремится к минимальному рассеиванию свободной энергии. Если в силу причин система отклонилась от стационарного состояния, то вследствие стремления системы к минимальной энтропии, в ней возникают внутренние изменения, возвращающие ее в стационарное состояние.
Величина, кот это всё характеризует:
β= T* (dS/dt), где β – диссипативная фукнкция. β>0, min. С этим связан Критерий эволюции открытых систем: ∆β/dt происходит преобразование одного вида Е в другой – это центральное событие фотосинтеза.
Физ-хим. сущность фотосинтеза: Ф. – процесс преобразования электромагнитной Е в Е хим. связей, сопровождающийся ↑ энергетического потенциала системы. Система является ТД открытой. При поглощении солнечного излучения растениями, водорослями, нек. микро, возрастают уровни свободной Е (∆F) и общей энергии (∆U), в которой значительную часть составляет Е электрона: ∆F = ∆U — Т∆S
КПД процесса фотосинтеза составляет обычно 6-8%, у хлореллы он достигает 20-25%. Большая часть поглощённой листом энергии теряется на тепловое излучение. В энергию химич. связей включается в ср. 1—2% поглощённой ФАР. Осн. показатель Ф.— его интенсивность, т. е. кол-во газа, поглощённого или выделенного единицей массы или поверхности листа в единицу времени. Интенсивность Ф. зависит от вида растений, состояния листьев, внеш. условий (свет, СO2). Ф. лесных древесных растений в 5—8 раз ниже, чем Ф. травянистых растений открытых местообитаний.
Реакции, протекающие под воздействием светового излучения, называются фотохимическими Основной закон фотохимии – закон квантовой эквивалентности (А. Эйнштейн, 1912 г): каждый поглощенный квант света hν вызывает изменение одной молекулы.
Важнейшим параметром фотохимической реакции служит квантовый выход γ:
γ = число фотохим. превращений/число поглощений квантов.
В зависимости от типа фотохимической реакции квантовый выход может меняться в широких пределах. Это связано с возможностью потери поглощенной энергии до фотопревращения. Если время существования фотовозбужденной молекулы и скорость фотодиссоциации совпадают, то γ
1. При γ >> 1 фотореакция идет по цепному механизму. В частности для реакции H2 + Cl2 = 2HCl γ = 105.
Типы фотохимических реакций:
1) Фотодиссоциация (фотолиз) приводит к разложению исходного вещества, поглотившего световую энергию. Примерами реакции фоторазложения служат такие: разложение галогенидов серебра (основа серебряной фотографии), фотолиз паров ацетона CH3CO CH3 → CO + другие продукты.
2) Фотосинтез приводит к образованию более сложных соединений. Примерами реакций фотосинтеза служат:
фотосинтез озона в верхних слоях атмосферы, создающий защитный озоновый слой:
О2→О +О — фотодиссоциация
О2+ О→ О3 — фотосинтез
фотосинтез органических соединений из углекислого газа, воды, минеральных веществ зелеными растениями. В частности, синтез глюкозы может быть описан уравнением:
6СО2 + 6Н2О →глюкоза + 6О2
3) Фотохромизм – явление обратимого изменения пространственного или электронного строения молекул под действием света, сопровождающееся изменением окраски вещества. На основе фотохромных материалов изготовляются линзы с переменным светопропусканием, оконные стекла, фотохромные системы на основе некоторых органических и координационных соединений.
Вариант 2.
Графическая зависимость скорости реакции от субстрата, фермента и температуры
42 Зависимость скор р-ции от темп. Ур Аррениуса
Для характеристики зависимости скорости химической реакции от температуры было введено понятие температурного коэффициента скорости (γ), равного отношению константы скорости при температуре (Т + 10) к константе скорости при температуре Т (т.е. γ показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов):
Температурный коэф. Вант-гоффа-Q10= V t+10/V t.
Экспериментально было установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость многих гомогенных реакций в 2 4 раза, т. е. для этих реакций γ = (2 4). Это правило называется правилом Вант–Гоффа.
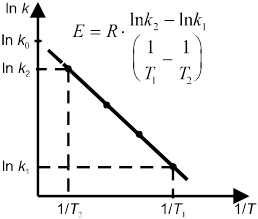
В общем случае отношение констант скорости реакции k2 и k1, определенных при двух различных температурах Т2 и Т1, равно
Более точную зависимость скорости реакции от температуры дает уравнение Аррениуса:
где k — константа скорости реакции, R — универсальная газовая постоянная, Е — энергия активации химической реакции. В случае простых реакций величина Е показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. В случае сложных реакций величина Е называется эмпирической или кажущейся энергией активации и в общем случае зависит от энергий активации отдельных стадий данной реакции.
Проинтегрировав уравнение (10.16), получим уравнение Аррениуса в интегральной форме:
где А — предэкспоненциальный множитель. Физический смысл А в случае простых реакций: мономолекулярных — это частота колебаний по разрываемой связи (А 1013 сек-1), бимолекулярных — величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А 10-10 10-11 см3/(мол-л•сек).
Есть еще такое Ур-е: V= pZeEакт/RT, где р-стерический фактор, Z- число столкновений молекул, Еакт — энергия активации
Зависимость скорости реакции от температуры дает уравнение Аррениуса:
где k — константа скорости реакции, R — универсальная газовая постоянная, Е — энергия активации химической реакции. В случае простых реакций величина Е показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. В случае сложных реакций величина Е называется эмпирической или кажущейся энергией активации и в общем случае зависит от энергий активации отдельных стадий данной реакции.
Проинтегрировав уравнение (10.16), получим уравнение Аррениуса в интегральной форме:
где А — предэкспоненциальный множитель. Физический смысл А в случае простых реакций: мономолекулярных — это частота колебаний по разрываемой связи (А 1013 сек-1), бимолекулярных — величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А 10-10 10-11 см3/(мол-л•сек).
Проинтегрировав ур-е (10.16) в пределах температур от Т1 до Т2, получим:
Энергию активации можно определить как аналитически по уравнению (10.18), так и графическим методом. Для этого необходимо знать ряд констант скоростей при разных температурах. Если реакция подчиняется уравнению Аррениуса, то зависимость lnk от 1/T должна выражаться прямой линией, что следует из уравнения (10.17) (рис. 7).
Для очень большого числа реакций энергия активации находится в пределах от 60 до 240 кДж/моль, т.е. примерно соответствует энергиям химических связей.
Энерг актив. Связана с Q10: Е=0,46T1*T2lgQ10
44 КИНЕТИКА ФЕРМЕНТ РЕАКЦИЙ, акт ферм, ед измерен акт и колич ферм.
ферм– это специфические органические катализаторы, синтезируемые живыми клетками. Как правило все ферменты представляют собой белки с различными молекулярными массами: от 9 кДа до 1000 кДа. Каждый фермент катализирует определённую химическую реакцию.
Субст- это вещества, с которыми происходит химическое превращение под действием ферментов. Субстратами ферментов могут быть как природные, так и химически синтезированные вещества.
1. с 1 активным центром (связывает S, расщепляет связи + связан с активацией и
2. кроме активного каталитического центра имеется аллостерический центр.
По взаимодействию с кофакторами:
1. ковалентная связь с кофактором — простетическая группа
2. нековалентное связывание — отделяется при гидролизе.
1. ускоряют протекание реакций
2. являются специфичными (мало-, относительно, абсолютно)
При присоединении субстрата к ферменту, его связи переходят в напряжённое состояние, что снижает энергию активации.
Факторы влияющие на активность:
t — идет как ферментативный процесс, так и денатурация белка. Q10 – 2
2. кислотность среды. Амилаза слюны — рН =7-7.5 , пепсин желудка
3. концентрация S
На начальном участке графика [S] низкая→ реакция первого порядка.
На втором — переходная стадия → переходный порядок реакции. На третьем участке (плато) → перенасыщение S→0 порядок реакции.
Кат. акт ферм — это способность фермента превращать большое количество молекул субстрата, в то время как сам он к концу реакции остается неизменным. Ферменты различаются по своей каталитической способности. Например, 1 моль трипсина осуществляет 102 циклов в секунду, глюкозоксидаза — 17×103 циклов в секунду и т.д. Это называется “числом оборотов фермента”. Число оборотов варьирует от 1 до 106 в зависимости от природы фермента. Каталитическую активность ферментов выражают в единицах активности.
Международная ед акт (E) — это количество фермента, которое катализирует превращение 1 мкмоля субстрата в 1 минуту в оптимальных условиях.
Ед акт в системе СИ (катал) — соответствует количеству фермента, которое катализирует превращение 1 моля субстрата в 1 секунду.
Соотношение между единицами активности: 1 E = 16,67 нанокатал; В медицине активность ферментов выражают чаще всего в единицах активности на 1 л биологической жидкости. Удельная активность фермента — это активность, выраженная в единицах активности на 1 мг (или 1 г) белка или 1 мг (1 г) препарата фермента. Используется в биохимической практике.
45 Осн положен теор ферм кинетики и общ теор действ фер-та
Предварительные эксперименты по изучению кинетики ферментативных реакций показали, что скорость реакции E + S —> E + P, вопреки теоретическим ожиданиям, не зависит от концентрации фермента и субстрата так, как в случае обычной реакции второго порядка. Самая ранняя попытка математически описать ферментативные реакции была предпринята Дюкло в 1898 г. Браун (1902) и независимо от него Анри (1903) впервые выдвинули гипотезу об образовании в ходе реакции фермент-субстратного комплекса. Это предположение основывалось на трех экспериментальных фактах:
1. папаин образовывал нерастворимое соединение с фибрином
2. субстрат инвертазы — сахароза могла защищать фермент от тепловой денатурации
3. было показано, что ферменты являются стереохимически специфическими катализаторами
Х-КА ДЕЙСТВИЯ ФЕРМ:
1. специфичность действия-способность ускорять протекание 1 или нескольких реакций (амилазная реакция расщепляет крахмал до глюкозы)
а. абсолютная- определенный субстрат;
б. относительная- ферменты, которые катализируют ращепление определенного типа связи. (пепсин)
2. ускорение протекания ферментативн. Реакций- каталитичность. Ферменты действуют в мыгких условиях (норм давление, pH, температура): гидролиз крахмала
Амилаза = 37 градусов, pH7, скорость выше, чем при неорган.катализе.
2. регулируемость – есть факторы под воздействием которых скорость может увеличится или уменшаться
В 1913 году Михаэлис и Ментен опубликовали свою теорию общего механизма ферментативных реакций. Их уравнение стало фундаментальным принципом всех кинетических исследований ферментов вот уже почти целый век.
т.е. фермент Е вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р. Математическая обработка на основе закона действующих масс дала возможность вывести уравнение, названное в честь авторов уравнением Михаэлиса–Ментен, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
где v – наблюдаемая скорость реакции при данной концентрации субстрата [S]; KS– константа диссоциации фермент-субстратного комплекса, моль/л; Vmax– максимальная скорость реакции при полном насыщении фермента субстратом.
Основной механизм действия ферментов-они снижают Е активации за счет образования фермент-субстрат копмлекса.
Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто ступенчато.
Три стадии процесса:
1) E + S —— ES (K = k1/k-1) (БЫСТРАЯ)
2) ES —— EP (k2)(медленная)
Таким образом, в момент равновесия скорости образования и исчезновения энзимсубстратного комплекса (ES) равны:
Уравнение Михаэлиса-Ментен. Ингибирование ферментов
Страницы работы
Содержание работы
УРАВНЕНИЕ МИХАЭЛИСА —МЕНТЕН
Простейшей моделью для построения и обсуждения теорий ферментативной кинетики является кинетика односубстратных реакций. Хотя чаще всего в реакциях участвует не один, а большее число субстратов, реакцию можно рассматривать как односубстратную, если второй субстрат присутствует в очень большой концентрации. Большинство получаемых выводов можно использовать непосредственно при рассмотрении более сложных ферментативных реакций.
Как уже упоминалось, концентрация субстрата является одним из наиболее важных факторов, определяющих скорость ферментативной реакции.
В начале XX столетия Л. Михаэлисом и М. Ментен было предложено простейшее кинетическое выражение для скорости ферментативной односубстратной реакции.
Схема ферментативного процесса записывается следующим образом:
где Е — фермент; S — субстрат, подвергающийся ферментативной реакции; Р — образующийся в результате продукт;
Уравнение скорости ферментативной реакции, выведенное Михаэлисом и Ментен, предположивших, что превращение субстрата происходит только в переходном фермент-субстратном комплексе, основывается на двух предпосылках.
1. Реакция между ферментом и субстратом находится в равновесии. Это условие выполняется, если скорость распада комплекса на свободный фермент и субстрат значительно больше скорости распада его до свободного фермента и продукта (k-1 >> k2).
2. Концентрация свободного субстрата остается практически постоянной в течение начального периода реакции, тогда концентрация субстрата [S] может быть принята равной полной концентрации субстрата [So]. Это условие выполняется, если полная концентрация субстрата значительно больше полной концентрации фермента, как это обычно имеет место при кинетических исследованиях.
При высокой каталитической активности фермента реальное значение концентрации фермент-субстратного комплекса отличается от его значения в условиях равновесия. Для анализа кинетики реакции с учетом этого обстоятельства Бриггс и Холдейн предложили дополнить теорию Михаэлиса — Ментен условием стационарного состояния.
Согласно этому условию в любой момент реакции скорости образования и распада комплекса ES практически равны, так что концентрация комплекса [ES] может считаться постоянной (квазистационарной) в течение короткого периода времени, необходимого для измерения скорости. В течение более продолжительного периода времени концентрация комплекса [ES] будет изменяться по ходу реакции в связи с падением концентрации субстрата, но скорость изменения ее всегда будет существенно меньше, чем скорость ферментативной реакции.
Для стационарного состояния, при котором
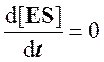
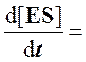

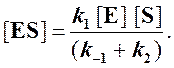
Из уравнения материального баланса для фермента
где [Eo] ─ его начальная концентрация, а [E] ─ текущая концентрация свободного, не связанного в фермент-субстратный комплекс белка, можно записать
и подставить в выражение (1):
Отсюда концентрация ES равна
[ES] =
Тогда начальная скорость ферментативной реакции, измеряемая по скорости образования продукта Р, равна
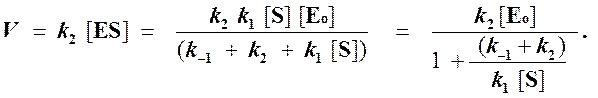
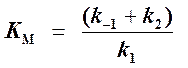
то выражение (2) можно записать в следующем виде:
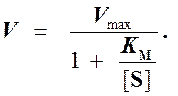
Выражение (3) называется уравнением Михаэлиса —Ментен и описывает зависимость скорости односубстратной ферментативной реакции от концентрации субстрата. Из этого уравнения видно, что при увеличении концентрации субстрата (при неизменной концентрации фермента) скорость реакции стремится к предельному значению, равному Vmax.
При выводе уравнения Михаэлиса — Ментен, кроме вышеперечисленных, принимается во внимание еще несколько не совсем реальных допущений, таких как:
1) отсутствие образования значимого количества комплекса ЕР и других форм фермента;
2) необратимость второй стадии реакции, т. е. образования продукта Р. Это связано с тем, что мы рассматриваем только начальную скорость процесса, когда обратной реакцией из-за фактического отсутствия продукта еще можно пренебречь;
3) связывание с активным центром на каждой субъединице фермента только одной молекулы субстрата;
4) использование для всех реагирующих веществ вместо активностей их концентраций.
Если k2 значительно меньше k-1, то этим членом в выражении константы Михаэлиса можно пренебречь, и КM становится равной отношению 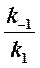
Таким образом, являясь аналогом константы диссоциации фермент-субстратного комплекса ES, константа Михаэлиса характеризует сродство фермента к субстрату. Чем ниже КM, тем выше сродство.
На рис. 1 приведено графическое изображение уравнения Михаэлиса — Ментен.
Рис. 1.Зависимость скорости ферментативной реакции от концентрации субстрата
Уравнение Михаэлиса-Ментен
Впервые А. Браун (Brown A.J.) и затем В.Анри (Henri V.) в начале ХХ века высказали предположение о том, что в основе ферментативной реакции лежит обратимое взаимодействис субстрата с ферментом с образованием комплекса, который далее распадается с образованием продуктов реакции и регенерацией исходного фермента. Эта гипотеза была далее развита в работах Михаэлиса (L. Michaelis) и Ментен (M.L. Menten) (1913 г.) и позднее – Бригсом (G.E. Briggs) и Холденом (J.B.S. Haldane) (1925 г.).
Кинетическую схему простейшей односторонней ферментативной реакции превращения одного субстрата в продукт можно представить следующим образом:

Ферментативная реакция протекает в два этапа. На первом этапе фермент и субстрат образуют фермент-субстратный комплекс ES. Этот этап является быстрым и обратимым, он не сопровождается какими-либо химическими изменениями субстрата. Константы скорости реакции образования фермент-субстратного комплекса и обратного его распада равны соответственно k+1 и k-1. В образовании фермент-субстратного комплекса (ФСК, комплекс Михаэлиса) принимают участие нековалентные взаимодействия.
Каталитический процесс осуществляется на втором этапе реакции с константой первого порядка k+2 (kcat, число оборотов фермента). Комплекс Михаэлиса распадается с образованием конечного продукта реакции Р и регенерацией исходного фермента. Распад фермент-субстратного комплекса может происходить по-разному: в данной кинетической схеме он распадается в одну стадию, но в других случаях этих стадий может быть несколько.
Исходя из уравнения (1), можно расписать уравнения для скоростей отдельных стадий реакции.
Скорость образования фермент-субстратного комплекса:

Скорость обратной реакции (диссоциации комплекса на исходные вещества):

Скорость распада комплекса ES с образованием продуктов реакции и регенерацией фермента:

Стационарное течение процесса возможно тогда, когда концентрация субстрата существенно превосходит концентрацию фермента ([S]>> [E]). В этом случае распад комплекса ES по реакциям (+2) и (-1) уравновешивается его образованием по реакции (+1). Поэтому для условия стационарности можно записать:

Обозначив общую концентрацию фермента через [E]0, при условии, что [E]0 = [E] + [ES], преобразуем предыдущее уравнение
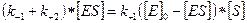
Откуда концентрация фермент-субстратного комплекса будет равна



Скорость ферментативной реакции, измеряемая согласно схеме (1) по образованию продукта реакции Р из комплекса ES, может быть выражена следующим образом

Подставляя в это выражение найденное значение [ES], получим
|
Данное уравнение отражает зависимость скорости ферментативной реакции от концентрации фермента и субстрата. Константа Км носит название константы Михаэлиса и имеет размерность концентрации субстрата. Уравнение (2) свидетельствует, что зависимость скорости ферментативной реакции от концентрации субстрата при [E]0=const является гиперболической функцией (рис. 2.2.1).
Рис.2.2.1. Зависимость скорости ферментативной реакции от концентрации субстрата
Кривая представляет собой равнобочную гиперболу. При достаточно малых концентрациях субстрата, когда [S] > Км, можно принять, что Км + [S] ≈ [S], и тогда
а реакция имеет нулевой порядок по отношению к субстрату. Следовательно, при достижении определенной концентрации субстрата скорость ферментативной реакции достигает максимального значения Vmax и при дальнейшем увеличении концентрации субстрата не изменяется.
Смысл такого рода зависимости очевиден: скорость ферментативной реакции определяется в целом концентрацией фермент-субстратного комплекса и при малых концентрациях субстрата концентрация комплекса Михаэлиса пропорциональна [S], тогда как при избытке субстрата фактически весь фермент находится в форме ES. Дальнейшее повышение концентрации субстрата не приводит к увеличению [ES].
С учетом приведенного выше выражения, окончательное уравнение зависимости скорости ферментативной реакции от концентрации фермента и субстрата приобретает вид

Уравнение (3) является фундаментальным уравнением ферментативной кинетики и обычно называется уравнением Михаэлиса-Ментен.
Скорость реакции приближается к максимальной достаточно медленно, и даже при [S]= 10Км, величина скорости достигает только 0,91 Vmax. В связи с этим значение максимальной скорости очень часто трудно измерить и его приходится рассчитывать из скоростей, наблюдаемых при концентрациях субстрата ниже насыщающих.
Согласно уравнения (3), скорость реакции при данной концентрации субстрата линейно зависит от концентрации фермента. В случае значительного числа ферментативных реакций это наблюдается в действительности. На рис. 2.2.2 приведен пример зависимости скорости ферментативной реакции от концентрации фермента.
Рис. 2.2.2. Зависимость скорости от концентрации фермента
Линейный характер этой зависимости, наблюдающийся в достаточно широком интервале [E]0, не будет меняться до тех пор, пока соблюдаются условие существенного превышения концентрации субстрата над концентрацией фермента. При значительном повышении концентрации фермента будет наблюдаться отклонение от линейной зависимости и при некоторой концентрации фермента дальнейшего повышения скорости реакции происходить не будет, что обусловлено отсутствием достаточного количества свободного субстрата. В связи с этим при изучении влияния различных концентраций фермента необходимо, как и всегда, определять начальную скорость ферментативной реакции, когда глубина превращения субстрата незначительна и его концентрация остается достаточно высокой (соблюдается условие [S]>> [E]0).
В тех же случаях когда при соблюдении условия [S]>> [E]0 не наблюдается линейной зависимости между скоростью реакции и общей концентрацией фермента, для описания кинетики фермента нельзя применять уравнение Михаэлиса-Ментен.
http://vunivere.ru/work25078
http://www.megapredmet.ru/1-24939.html