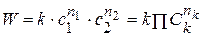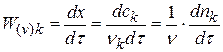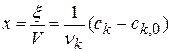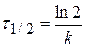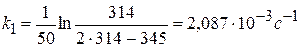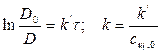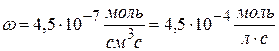Интегральное уравнение реакции первого порядка
Из уравнений (4) и (5) видно, что критериями первого порядка реакции по реагенту А является линейная зависимость ln [ A ] – t или ln 
В тоже время по тангенсам углов наклона линейных зависимостей можно определить константы скорости.
Другой тест правильности выбранного первого порядка является постоянство константы скорости реакции, вытекающее из уравнения (5)
Размерность константы скорости первого порядка dim < k >= [1/ c ], [1/мин] или соответственно с -1 , мин -1
Третий тест основан на концентрационной зависимости времени полупревращения. Условие полупревращения [ A ] = 0,5[ A ]0 , тогда в соответствии с уравнением (5)
Можно видеть, что критерием первого порядка реакции является независимость времени полупревращения t ½ от начальной концентрации реагента [ A ]0.
Примерами подобных реакций первого порядка являются реакции изомеризации, а также реакции разложения некоторых сложных молекул в газовой фазе.
и в жидкой фазе, например, гидролиз трет-бутилбромида.
Для реакции A + B → C + D можно записать уравнение скорости
Обозначим [ A ]0 и [ B ]0 – начальными концентрациями реагентов А и В, а Х – количество прореагировавших А и В, тогда уравнение (1) приобретет вид
Разделяя переменные, имеем
Проинтегрируем левую часть этого уравнения методом неопределенных коэффициентов, для чего представим дробь
в виде суммы дробей
Решая совместно эти уравнения, имеем

Подставляя значения α и β в уравнение (3) и (4) и интегрируя полученные уравнения в соответствующих пределах
Из уравнения (5) видно, что критерием правильности выбранного второго порядка реакции является линейность зависимости

По тангенсу угла наклона этой зависимости можно определить константу скорости реакции. Другим критерием правильности выбранного второго порядка является постоянство значений k , вычисленных в соответствии с уравнением (5):
во всем диапазоне пар значений τ – х.
Размерность константы скорости второго порядка

Если вещества А и В взяты в равных количествах или реакция идет с участием одного вещества, например
то при постоянстве объема удобно использовать в качестве переменной концентрацию одного из исходных веществ
тогда кинетическое уравнение будет иметь вид
Интегрируя это уравнение в соответствующих пределах
приходим к выражению
Из уравнений (7) и (8) следует, что критериями правильности выбранного второго порядка являются линейный характер зависимости 1/[ A ] от t и постоянство значения k , вычисленных для различных пар значений [ A ] – t по формуле
Третий критерий правильности второго порядка основан на определении времени полупревращения t ½ . Так как [ A ] = 0.5[ A ]0, то в соответствии с уравнением (7)

Можно видеть, что критерием второго порядка является обратно пропорциональная зависимость между t ½ и начальной концентрацией реагента. В соответствии с выражениями (7) и (8) константы скорости второго порядка можно определить по тангенсу угла наклона зависимостей 

Имеется множество реакций протекающих по кинетике второго порядка:
и простой случай, соответствующий равенству исходных и текущих концентраций реагентов
Разделяя переменные и интегрируя
Из уравнения (3) видно, что критериями правильности выбранного третьего порядка является линейность зависимостей 

для всех пар значений t и [ A ] и обратно пропорциональная зависимость между временем полупревращения и квадратом начальной концентрации реагента
В соответствии с уравнением (3) константа скорости третьего порядка может быть определена по тангенсу угла наклона зависимости 

Интегрирование уравнения (1)
приводит к выражениям
Из уравнений (2) и (3) следует, что критериями нулевого порядка по реагенту А являются линейный характер зависимости [ A ] от t , постоянство k , вычисленного по формуле

Из уравнений (2) и (3) следует, что константа скорости нулевого порядка может быть определена по тангенсу угла наклона зависимостей [ A ]0 – [ A ] или [ A ] от времени
Сложные реакции представляют собой совокупность простых реакций. К сложным реакциям относятся обратимые реакции.
При кинетическом анализе сложных реакций руководствуются принципом независимости простых реакций, согласно которому каждая простая реакция, входящая в сложную ведет себя кинетически так, как если бы она была единственная.
в начальный момент времени концентрация реагента A составляет [ A ]0, а [ B ] = 0, то уравнение этой реакции запишется как
Выражая r через концентрацию [A] имеем


где X – количество молей вещества A в единице объеме, которое прореагировало к моменту τ и соответственно количество молей вещества B в единице объеме, которое образовалось к этому моменту. Преобразуя правую часть уравнения (2)

В условиях равновесия
При τ ® ¥ X стремится к своему равновесному значению X ® X ¥ . Тогда
где
Тогда кинетическое уравнение (3) примет вид
Интегрируя это уравнение в соответствующих пределах
и
В соответствии с выражениями (6) и (7) кинетические зависимости для A и B будут иметь следующий вид
Пользуясь интегральной формой кинетического уравнения (5) и соотношением 
Так, в соответствии с (5)
так как 
Подставляя последнее выражение в уравнение (8), имеем
Подставляя выражение (10) в уравнение (8), имеем
Рассмотрим систему параллельных реакций первого порядка
В соответствии с ранее принятыми обозначениями суммарная скорость расходования реагента A выразится уравнением
По форме уравнение (1) подобно кинетическому уравнению необратимой реакции первого порядка, поэтому его интегральная форма имеет вид.
Разрешая уравнение (2) относительно [ A ] имеем
Для определения констант k 1 и k 2 рассмотрим уравнения конкурирующих параллельных реакций.
Поделив почленно, левые и правые части уравнений (5) и (6), имеем уравнение 
Разделяя, левые и правые части уравнений (5) и (1), (6) и (7), приходим к очевидным равенствам

интегрирование которых дает уравнения:

Подставляя в последние уравнения выражение (4) приходим к равенствам
Уравнения (2) и (8) являются основой для определения абсолютных значений констант скорости конкурирующих реакций k 1 и k 2 . На первом этапе можно определить сумму констант скоростей k 1 + k 2 , пользуясь уравнением (2). Затем на основе линейных зависимостей между XB и X , а также XC и X определяют брутто константы 

Нетрудно показать, что для трех параллельных реакций первого порядка


Этот случай более сложен по сравнению с предыдущим. Рассмотрим систему параллельных реакций
Уравнение скорости расхода A в этой системе реакций с учетом его количества, прореагировавшего к моменту времени t (Х) имеет вид:
или с учетом преобразований
обозначая 
Разделяя переменные, приходим к выражению
Интегрируем левую часть уравнения (3) методом неопределенных коэффициентов, для чего представим левую её часть в виде суммы дробей.

так как 

Тогда 
Откуда 

С учетом (4) возвращаемся к уравнению (3)
Интегрирование уравнения (5) приводит к выражению
Откуда
или
Возвращаясь к соотношению 
Рассмотрим систему двух последовательных реакций первого порядка
В силу принципа независимости скорости расходования реагента A выражается уравнением скорости необратимой реакции первого порядка
Решение которого дается в виде


Уравнение скорости изменения концентрации промежуточных продуктов
Разделим почленно левые и правые части уравнений (3) и (1)
Уравнение (4) имеет признаки однородного уравнения первого порядка. Для его решения вводим обозначение
Подставляя последнее выражение в уравнение (4), имеем:
Разделяем переменные и интегрируем
и
тогда
и
или
Так как 
В тоже время в соответствии с уравнением (2)
Тогда уравнение (5) можно преобразовать в форму
Выведенные зависимости показывают, что в случае необратимых последовательных реакций уравнение для первого промежуточного продукта связано с характеристиками лишь первых двух стадий, оставаясь одинаковым при любом числе и характеристиках последующих стадий. При этом независимо от начальной концентрации реагента A , значение второй характеристики материального баланса 
Используя уравнение (5) можно найти 
Из анализа уравнения (6) следует, что при XA = 0 и XA = 1 

откуда
и значение максимума
Из выражений (8) и (9) видно, что положение и величина максимума промежуточного продукта в необратимых реакциях первого порядка зависит только от соотношения констант скоростей первых двух стадий. При этом, чем больше величина 

Уравнение образования продукта C :
Максимальная скорость 
Легко видеть, что это условие соответствует одновременно условию максимума концентрации B , определяемого уравнениями(8) и (9). Качественно проанализированные зависимости могут быть представлены графически.
Неэлементарные реакции состоят из ряда элементарных стадий, составляющих их механизм. Кинетика таких реакций определяется последовательностью элементарных стадий, их характером (обратимые, необратимые), природой реагентов, интермедиатов и продуктов реакции. При кинетическом анализе неэлементарных реакций возникает задача определения концентраций интермедиатов, играющих ключевую роль в образовании продуктов или расходовании реагентов. В качестве инструмента такого определения используется принцип квазистационарных концентраций Боденштейна – Семенова. Согласно этому принципу скорость изменения концентраций нестабильных интермедиатов пренебрежимо мала по сравнению со скоростью изменения концентраций реагентов и продуктов реакции и её можно считать равной нулю. Применение принципа стационарных концентраций к неэлементарным реакциям, протекающим по сложному механизму, позволяет исключить из кинетического описания процессов неизвестные концентрации интермедиатов и получить одно или некоторый минимум дифференциальных уравнений скорости, выраженных через подлежащие измерению концентрации реагентов и продуктов реакции.
Рассмотрим пример неэлементарной реакции, описываемой стехиометрией
и протекающей через образование интермедиата Q
Скорость реакции можно приравнять к скорости образования продукта B
В соответствии с принципом квазистационарных концентраций
откуда
Подставляя последнее выражение в уравнение (1) приходим к уравнению скорости реакции
Если экспериментально возможно непосредственно измерить скорость реакции, то обработку кинетических данных можно провести, преобразуя уравнение (3) как:
Последнее уравнение приводится к виду
Обрабатывая зависимость (4) в координатах 

Тема 2: Реакции первого и второго порядка
НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ
В СЛОЖНЫХ ХИМИЧЕСИХ ПРОЦЕССАХ
Примеры решения задач
для студентов, обучающихся
по программе бакалавриата по направлению подготовки
240100 – Химическая технология
Тема 1: Кинетика химических реакций.
Реакции первого и второго порядка
Основные расчетные формулы:

Глубина протекания химической реакции
Плотность глубины реакции
Реакция I порядка, интегральное уравнение:

Реакция II порядка: А+В=С

Существует понятие суммарный порядок реакции n = ∑nk и частный порядок реакции по компоненту

Графическое или аналитическое определение Еа

Задача № 1
Термическое разложение в газовой фазе (Т = 849 К, V-const)
происходит как одностадийная реакция. Эта стадия является односторонней, мономолекулярной. Рассчитайте константу скорости прямой реакции по следующим данным:
| τ, с | ∞ |
| р, мм.рт.ст. (общее давление) |
Решение:
1) Для реакции I порядка справедливо интегральное уравнение

k должно быть постоянной.
2) Рассмотрим реакцию
| С2Н5СНО = С2Н6 + СО | |||
| τ = 0 | р0 | х=0 | х=0 |
| τ = τ | р0 – х | х | х |
Р0 – исходное давление С2Н5СНО. В любой момент времени общее давление пара равно


3)
Значение k внесем в таблицу:
| τ, с | ∞ | ||||
| k∙10 3 , с -1 | 2.08 | 1.67 | 1.59 | 1.60 | 1.59 |
4) Вычислим значение kср

Задача № 2
В реакции формальдегида с пероксидом водорода образуется муравьиная кислота (реакция II порядка, 
За время τ = 2 часа при 333,2 К 

Дано:
Реакция II порядка
Решение:
| НСНО + Н2О2 = НСООН + Н2О | ||||
| τ = 0 | с0 = 1 моль/л | с0 = 1 моль/л | 0 моль/л | 0 моль/л |
| τ1 = 2 часа | сτ1 = 0,215 моль/л | сτ1 = 0,215 моль/л | х моль/л | х моль/л |
| τ2 = ? | сτ2 = 0,1 моль/л | сτ2 = 0,1 моль/л | 0,9 моль/л | 0,9 моль/л |
| τ3 = ? | сτ3 = 0,01 моль/л | сτ3 = 0,01 моль/л | 0,09 моль/л | 0,09 моль/л |
Для реакции II порядка при с1,0=с2,0
1) 
2)
3)
Вывод: Если исходные компоненты разбавить в 10 раз, то для достижения той же глубины реакции нужно в 10 раз больше времени.
Задача № 3
Для реакции А→В к = 0,5. Вычислить степень превращения вещества А за время 1 час, если реакция идет по 0, 1 и 2 порядку и с0,1 = 1 моль/л . Определите, как зависит степень превращения вещества от порядка реакции.
Дано:
Решение:
1) Реакция 0 порядка:
2) Реакция 1 порядка:

3) Реакция II порядка

Сведем данные расчета в таблицу:
| Порядок реакции, n | |||
| Степень превращения, α | 0,5 | 0,394 | 0,333 |
Вывод: При одинаковом значении константы скорости реакции с увеличением порядка реакции уменьшается степень превращения вещества.
Задача № 4
Рассчитать константу скорости реакции кристаллического фиолетового со щелочью по следующим данным
| τ, с | ||||||
| D | 0,600 | 0,405 | 0,320 | 0,220 | 0,140 | 0,091 |
Щелочь берется в избытке: сщ,0 = 1,8 моль/л, скр,0 = 0,01 моль/л, t = 27 0 С.
Решение:
1) Реакция цветная, за концентрацией красителя можно судить по изменению D: D=ε с l

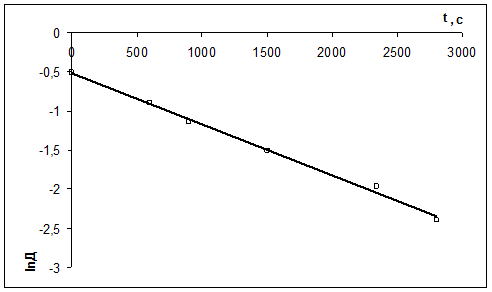
2) Рассчитать k можно графически или аналитическим расчетным способом. Строим график в координатах lnD = f(τ); k ’ = -a = −tgα
| τ, с | ||||||
| lnD | -0,511 | -0,903 | -1,139 | -1,514 | -1,966 | -2,397 |
2)
Задача № 5
Дана реакция 2 порядка А+В=С. Исходные концентрации с0,А = с0,В. За время 500 с реакция проходит на 20%. За какое время она пройдет на 60%?
Решение:
1) Интегральное уравнение реакции II порядка:

Ответ: за 3000 с реакция пройдет на 60%.
Тема 2: Реакции первого и второго порядка
Задача № 1
Рассчитайте k, если скорость реакции II порядка равна 4,5∙10 -7 моль/см 3 ∙с при концентрации одного компонента 1,5∙10 -2 моль/л и другого 2,5∙10 -3 моль/л.
Решение:
Ответ: k = 1,2 л/моль∙с
Задача № 2
Определите возраст мумии, если содержание изотопа углерода 14 С в ее тканях составляет 80% от его содержания в живом организме, а период полураспада 14 С равен 5600 лет. Реакция распада углерода относится к реакциям 1 порядка.
Дано:
Решение:
1) Допустим, что с0 = 1 моль/м 3 , тогда сτ = 0,8 моль/м 3 .
2) Рассчитываем возраст мумии:
Ответ: возраст мумии 1802 года.
Задача № 3
Реакция взаимодействия уксусного ангидрида с водой является реакцией первого порядка
Дано:
Решение:
1) Рассчитываем k:
2)
3)
4)
Вывод: ко времени полупревращения скорость реакции уменьшается в два раза по сравнению с начальным моментом.
Задача № 4
Превращение перекиси водорода в диэтиловый эфир протекает как реакция I порядка. При 333 К за время 10 мин превращение прошло на 75%. Вычислите константу скорости реакции.
Решение:
Допустим, что с0 = 1 моль/л, тогда сτ = с0 – х = 100-75,2 = 24,8%
Задача № 5
Фенилдиазохлорид разлагается по уравнению:
При 323 К и начальной концентрации 10 г/л были получены следующие результаты:
| τ, мин | ∞ | |||
| VN2, cм 3 | 19,3 | 32,6 | 50,4 | 58,3 |
Рассчитайте константу скорости реакции, постойте график VN2 = f(τ) и сделайте вывод о порядке реакции.
Решение:
В данной химической реакции за ходом процесса удобно следить по объему выделившегося газа. Реакция мономолекулярная, скорее всего, протекает согласно реакции I порядка. Кинетическое уравнение для реакции I порядка выглядит так:

Рассчитаем значение константы:
Значения констант скорости реакции имеет почти одинаковые значения, то это реакция I порядка и взятое нами уравнение удовлетворяет или описывает кинетику этого процесса.
Задача № 6
Найдите время, за которое реакция А→В с константой скорости 6,5∙10 -5 с -1 пройдет а) наполовину; б) на 98%.
Решение:
1) по единице измерения константы можно сказать, что данная реакция относится к реакции I порядка.
2) Кинетическое интегральное уравнение можно записать:
При τ = τ1/2 сτ = 0,5с0, если с0 = 1 моль/м 3 , то сτ = 0,5 моль/м 3 .
Химическая кинетика
Химическая кинетика – раздел физической химии, который изучает влияние различных факторов на скорости и механизмы химических реакций.
Под механизмом химической реакции понимают те промежуточные реакции, которые протекают при превращении исходных веществ в продукты реакции.
Основным понятием химической кинетики является понятие скорости химической реакции . В зависимости от системы, в которой протекает реакция, определение понятия «скорость реакции» несколько отличается.
Гомогенными химическими реакциями называются реакции, в которых реагирующие вещества находятся в одной фазе. Это могут быть реакции между газообразными веществами или реакции в водных растворах. Для таких реакций средняя скорость (равна изменению концентрации любого из реагирующих веществ в единицу времени)

Мгновенная или истинная скорость химической реакции равна

Знак минус в правой части говорит об уменьшении концентрации исходного вещества. Значит, скоростью гомогенной химической реакции называют производную концентрации исходного вещества по времени.
Гетерогенной реакцией называется реакция, в которой реагирующие вещества находятся в разных фазах. К гетерогенным относятся реакции между веществами, находящимися в разных агрегатных состояниях.
Скорость гетерогенной химической реакции равна изменению количества любого исходного вещества в единицу времени на единицу площади поверхности раздела фаз:

Кинетическим уравнением химической реакции называют математическую формулу, связывающую скорость реакции с концентрациями веществ. Это уравнение может быть установлено исключительно экспериментальным путём.
В зависимости от механизма все химические реакции классифицируют на простые (элементарные) и сложные. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы. Поэтому простые реакции классифицируют на мономолекулярные, бимолекулярные и тримолекулярные реакции. Так как с точки зрения теории вероятности одновременное столкновение четырёх и более молекул маловероятно, реакции более высокой, чем три, молекулярности не встречаются. Для простых реакций кинетические уравнения относительно просты. Например, для реакции H2 + I2 = 2 HIкинетическое уравнение имеет вид

Сложные реакции протекают в несколько стадий, причём все стадии связаны между собой. Поэтому кинетические уравнения сложных реакций более громоздки, чем простых реакций. Например, для сложной реакции H2 + Br2 = 2 HBrизвестно


Сложность кинетического уравнения напрямую связана со сложностью механизма реакции.
Основным законом химической кинетики является постулат, вытекающий из большого числа экспериментальных данных и выражающий зависимость скорости реакции от концентрации. Этот закон называют законом действующих масс.Он утверждает, что скорость химической реакции в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведённым в некоторые степени.
Если уравнение химической реакции имеет вид
a A + b B + d D → продукты,
то формулу закона действующих масс можно представить в виде


В этом уравнении k – константа скорости химической реакции – важнейшая характеристика реакции, не зависящая от концентраций, а зависящая от температуры. Константа скорости химической реакции равна скорости реакции, если концентрации всех веществ равны 1 моль/л. Показатели степеней n1 , n2 , n3 называют частными порядками химической реакции по веществам А, В и D. Для простых реакций частные порядки – небольшие целые числа от нуля до трёх. Для сложных реакций частные порядки могут быть и дробными, и отрицательными числами. Сумма частных порядков называется порядком химической реакции n = n1 + n2 + n3 . Таким образом, порядком химической реакции называют сумму показателей степеней концентраций в кинетическом уравнении.
Кинетическая классификация простых гомогенных химических реакций
С точки зрения химической кинетики простые химические реакции классифицируют на реакции нулевого, первого, второго и третьего порядков . Реакции нулевого порядка встречаются чрезвычайно редко. Для того чтобы реакция протекала по нулевому порядку необходимы специфические условия её проведения. Например, реакция разложения оксида азота (5+) N2 O5 → N2 O4 + ½ O2 протекает как реакция нулевого порядка только в случае твёрдого оксида азота (5+).
Если же взят газообразный оксид, то реакция протекает как реакция первого порядка.
В то же время следует сказать, что встречается большое количество реакций, в которых частный порядок по какому-либо веществу равен нулю. Обычно это реакции, в которых данное вещество взято в большом избытке по сравнению с остальными реагентами. Например, в реакции гидролиза сахарозы
Сахароза Глюкоза Фруктоза
частный порядок реакции по воде равен нулю.
Самыми распространёнными являются реакции первого и второго порядков. Реакций третьего порядка мало.
Рассмотрим для примера математическое описание кинетики химической реакции первого порядка. Решим кинетическое уравнение такой реакции

Разделим переменные dC = – kdt. После интегрирования
∫ 
lnС = – kt + const.
Найдём постоянную интегрирования, учитывая начальное условие: в момент времени t = 0 концентрация равна начальной С = С0 . Отсюда const = lnC0 и
ln С = ln С0 – kt,
ln С – ln С0 = – kt,
ln 
Это интегральное кинетическое уравнение реакции первого порядка.
Важной кинетической характеристикой реакции любого порядка является время полупревращения τ½ . Временем полупревращения называют время, в течение которого реагирует половина начального количества вещества. Найдём выражение для времени полупревращения реакции первого порядка. Для t = τ½ C = C0 /2. Поэтому
ln 

τ½ = 

Результаты решения дифференциальных кинетических уравнений для реакций всех порядков представим в виде таблицы (табл. 2). Данные этой таблицы относятся к случаю, когда все вступающие в реакцию вещества имеют одинаковые начальные концентрации.
Таблица – Кинетические характеристики простых гомогенных реакций
| Кинетическаяхарактеристика | Порядок химической реакции | |||
| n = 0 | n = 1 | n = 2 | n = 3 | |
| 1Дифференциальное кинетическое уравнение |  = k. = k. |  = kC. = kC. |  = kC 2 . = kC 2 . |  = kC 3 . = kC 3 . |
| 2 Интегральное кинетическое уравнение | С0 — С = kt | C = C0 ∙e -kt | (  ) = kt ) = kt | (  ) = 2kt ) = 2kt |
| 3 Константа скорости реакции, её размерность | ||||
| 4 Время полупревращения | τ½ =  | τ½ =  | τ½ =  | τ½ =  |
| 5 Функция, линейно зависящая от времени | C | ln C |  |  |
Способы определения порядка реакции
Для определения порядков химических реакций используют дифференциальные и интегральные способы. Дифференциальные способы используют дифференциальные кинетические уравнения. Порядок реакции с помощью этих способов рассчитывается и представляется в виде числа. При этом, так как способ базируется на кинетическом эксперименте, результат расчёта содержит в себе некоторую погрешность.
Приведём в качестве примера дифференциальный способ определения порядка реакции
Дифференциальное кинетическое уравнение этой реакции имеет вид


Задача определения порядка реакции сводится к определению частных порядков n1 и n2 , т.к. n = n1 + n2 . Для определения каждого частного порядка проводят отдельный эксперимент. В первом поддерживают постоянную концентрацию вещества А и меняют концентрацию вещества В, вовтором – наоборот.
В каждом эксперименте на скорость будет влиять только одна концентрация:




Здесь kB = k ∙ 

Данные эксперимента представляем в виде графиков в координатах lnW – lnC, получаем уравнения двух прямых, в которых коэффициенты перед аргументами и есть искомые частные порядки.
Интегральные способы базируются на проверке уже известных интегральных зависимостей (табл.). Порядок реакции не рассчитывается, а находится на основании вывода о выполнении или невыполнении той или иной зависимости.
Наибольшее значение имеют два интегральных способа определения порядка реакции.
Графический способ состоит в нахождении линейной зависимости f(C) – tи сравнении её с возможными зависимостями для реакций разных порядков. Известно, что для реакций разных порядков разные функции от концентрации линейно зависят от времени.
Данные кинетического эксперимента (концентрации в разные моменты времени) представляют в виде графиков в различных координатах (рис. 3). Те координаты, в которых зависимость больше напоминает линейную, и отвечают реальному порядку реакции.
Способ подстановки заключается в проверке выражений для константы скорости для реакций разных порядков (табл. 2). Из данных кинетического эксперимента для разных моментов времени по одной из формул рассчитывается значение k. Если рассчитанные значения явно показывают, что константа скорости реакции не зависит от времени, считают, что формула соответствует реальному порядку реакции. В противном случае (если наблюдается либо рост, либо уменьшение константы скорости при изменении времени) выбирается следующая формула и расчёт повторяется.
Влияние температуры на скорость химических реакций
Известно, что скорость большинства химических реакций увеличивается с повышением температуры. Количественно влияние температуры на скорость реакций можно оценить двумя путями.
Для реакций в растворах, протекающих при сравнительно низких температурах, можно использовать эмпирическое правило Вант Гоффа:
При повышении температуры на каждые 10 о С скорость реакции возрастает в 2–4 раза.
Более точно и научно обоснованно влияние температуры на скорость реакции описывает теория активных столкновений, основы которой предложены шведским учёным С. Аррениусом. Суть этой теории отражена в трёх её положениях:
1 Для того чтобы прореагировать, молекулы реагентов должны столкнуться.
2 Чтобы столкновения частиц действительно привели к химическому превращению, избыточная энергия сталкивающихся молекул должна превышать энергию активации (Еа ), т.е. молекулы реагентов должны преодолеть некий потенциальный барьер.
Энергией активации химической реакции называют избыточную энергию, которой должны обладать молекулы в момент столкновения, чтобы прореагировать.
Молекулы, имеющие избыточную энергию, больше, чем энергия активации, называются активными молекулами. В зависимости от доли активных молекул, скорость реакции может быть больше или меньше. Зависимость константы скорости реакции от температуры и энергии активации описывает уравнение Аррениуса:

Здесь k0 – предэкспоненциальный множитель – постоянная величина.
Одной из проблем химической кинетики является нахождение k0 и Еа по экспериментальным данным. В качестве примера рассмотрим методику нахождения значений этих величин для реакции
Сахароза Глюкоза Фруктоза
Была изучена кинетика этой реакции в присутствии серной кислоты концентрации 1,45 моль/л при различных температурах. По экспериментальным данным строится график зависимости lnk – 1/T. Исходя из уравнения Аррениуса, – это линейная зависимость (рис. 4). Находится уравнение прямой, и сопоставлением его с прологарифмированным уравнением Аррениуса
lnk = lnk0 –
рассчитываются искомые величины:
Ea = 12064∙R = 12064∙8,314 = 100300 Дж/моль,
k0 = e 36,729 = 8,94 ∙ 10 15 .
Рисунок – Нахождение коэффициентов уравнения Аррениуса
Для некоторых химических реакций, особенно в органической химии, даже при больших долях активных молекул скорость реакций оставалась незначительной. Теория активных столкновений объясняет это особенностями столкновения молекул.
3 Молекулы перед столкновением должны быть сориентированы друг относительно друга определённым образом.
Нужный вариант относительной ориентации приводит к реакции, в противном случае взаимодействия не происходит. Из термодинамики известно, что функция, характеризующая беспорядок в системе (движение молекул), – это энтропия. В соответствии с третьим положением теории уравнение Аррениуса было преобразовано:

В этом уравнении Sa – энтропия активации химической реакции. Энтропия активации, как и энергия активации, может быть найдена из экспериментальных данных.
Катализ
Катализ – изменение скорости химической реакции в присутствии веществ, называемых катализаторами, которые, вступая во взаимодействие с реагентами, сами к концу реакции остаются химически неизменными.
Все важнейшие промышленные процессы протекают в присутствии катализаторов. В живых и растительных системах протекает громадное количество каталитических реакций. При этом увеличение скорости под действием катализаторов может достигать миллионов раз.
Общие свойства каталитических реакций:
1 Участие катализатора в реакции не отражается на её химическом уравнении. Однако скорость реакции пропорциональна количеству катализатора.
2 Катализатор обладает специфичностью действия. Он может изменять скорость одной реакции и не влиять на скорость другой.
3 Катализатор не смещает химического равновесия, так как он в равной мере изменяет скорость и прямой, и обратной реакции.
4 Некоторые вещества усиливают действие катализатора (промоторы), другие – ослабляют (яды).
Различают положительный и отрицательный катализ. Положительный катализ называют просто катализом, отрицательный – ингибированием.
Катализ бывает гомогенным и гетерогенным. Гомогенный катализ наблюдается в том случае, когда катализатор и реагенты находятся в одной фазе. Примерами гомогенного катализа являются реакции в водных растворах в присутствии кислот или щелочей.
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Большая часть каталитических реакций протекает в гетерогенных системах на твёрдых катализаторах.
Механизм действия катализатора может быть отражён следующей схемой:
1 А + В = АВ без катализатора;
б) АК + В = АВ + К с катализатором.
Видно, что катализатор сначала связывается с одним из веществ в нестойкое соединение, а затем второй реагент вытесняет его из этого соединения.
http://poisk-ru.ru/s3490t4.html
http://www.zinref.ru/000_uchebniki/02800_logika/011_lekcii_raznie_31/417.htm